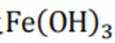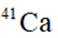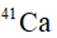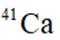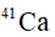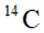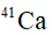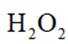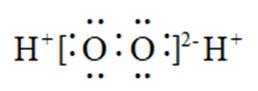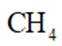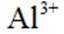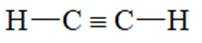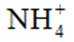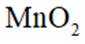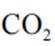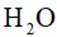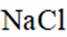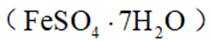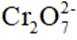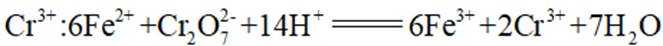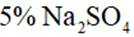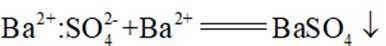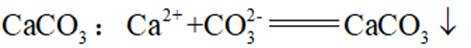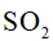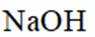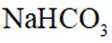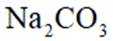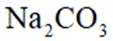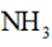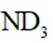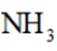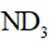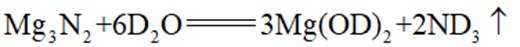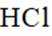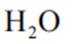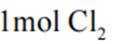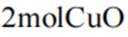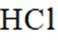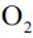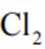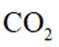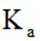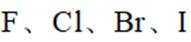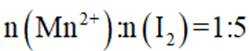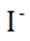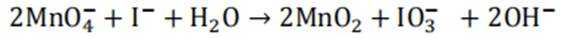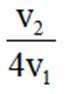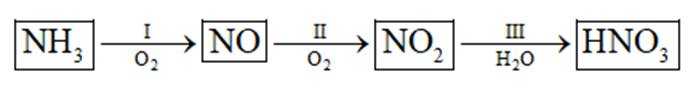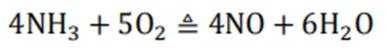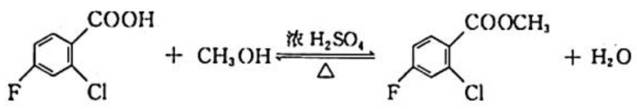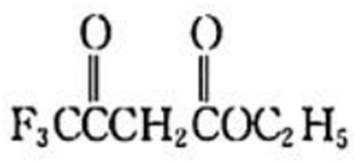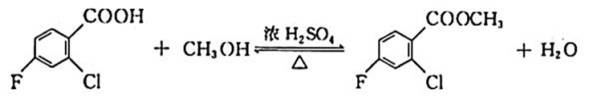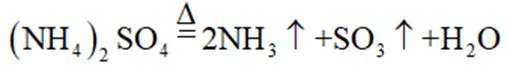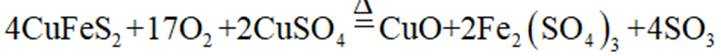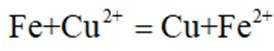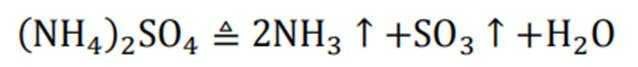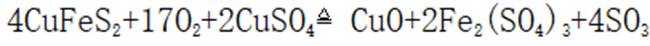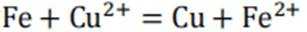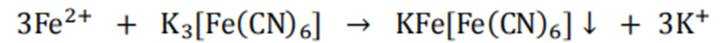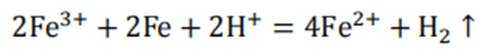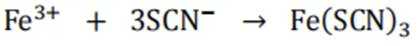- 真题试卷
- 模拟试卷
- 预测试卷
我国科研人员利用激光操控方法,从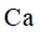
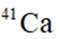
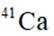
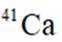
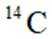
正确答案
解析
本题考查半衰期概念和化学变化定义的知识点。
A: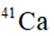
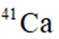
B: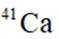
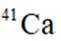
C: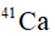
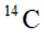
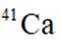
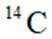
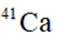
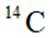
D:从Ca原子束流中直接俘获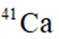
综上所述,正确答案是A。故选A
下列化学用语或图示表达不正确的是( )
正确答案
解析
本题考查各种化学表达式的知识点。
A错误,
故选A
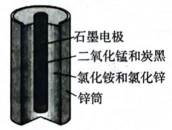
酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是( )
正确答案
解析
本题考查化学干电池原理的知识点。
A:在酸性锌锰干电池中,石墨通常作为电池的正极材料,而锌作为负极材料。因此,选项A错误。
B:在电池工作时,电子从负极流向正极,而电解质中的离子移动以维持电荷平衡。因此,阳离子会向正极移动,阴离子会向负极移动。NH时阳离子,故向正极移动,所以选项B错误
C:在电池的负极,即锌极,发生氧化反应,锌原子失去电子变成锌离子;
D:锌筒作为负极,在电池工作时发生的电极反应是锌原子失去两个电子变成锌离子,反应式为: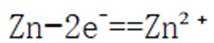
故选D
下列说法不正确的是( )
正确答案
解析
本题考查化学常识盐析、核酸大分子等的知识点。
A:葡萄糖氧化生成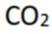
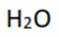
B:核酸可看作磷酸、戊糖和碱基通过一定方式结合而成的生物大分子。这是正确的,核酸(包括DNA和RNA)是由磷酸、五碳糖(脱氧核糖或核糖)和含氮碱基通过磷酸二酯键连接而成的长链分子。
C:由氨基乙酸形成的二肽中存在两个氨基和两个羧基。这是不正确的。氨基乙酸(甘氨酸)是一种氨基酸,当两个氨基乙酸通过脱水缩合形成二肽时,一个氨基乙酸的氨基与另一个氨基乙酸羧基反应,形成一个肽键,同时释放一个水分子。因此,形成的二肽中只有一个自由的氨基和一个自由的羧基,而不是两个氨基和两个羧基。
D:向饱和的NaCl溶液中加入少量鸡蛋清溶液会发生盐析。这是正确的。饱和的NaCl溶液中的高浓度盐离子会与蛋白质分子中的电荷相互作用,减少了蛋白质分子与水分子之间的相互作用,导致蛋白质的溶解度降低,从而发生沉淀,这个过程称为盐析。
故选C
下列方程式与所给事实不相符的是( )
正确答案
解析
本题考查常见化学方程式的知识点。
碳酸钠可以与硫酸钙反应生成不溶于水的碳酸钙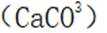
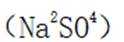
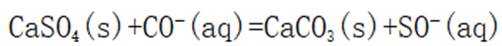
故选D
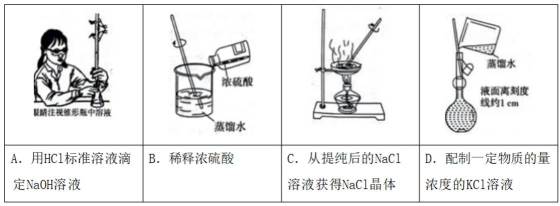
下列实验的对应操作中,不合理的是( )
正确答案
解析
本题考查常见化学实验操作的知识点。
选项D不合理,因为定容时必须让玻璃棒在刻度线以下的内壁山,否则配置溶液体积会偏大,导致实际所得溶液浓度降低。其余选项均正确。
故选D
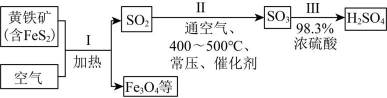
硫酸是重要化工原料,工业生产制取硫酸的原理示意图如下。
下列说法不正确的是( )
正确答案
解析
本题考查工业制取硫酸原理的知识点。
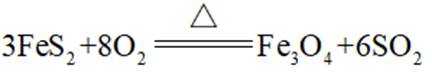
A.图片中I的化学方程式是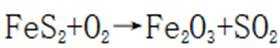
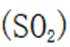
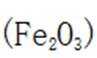
B.Ⅱ中的反应条件包括高温和催化剂。这些条件确实是为了提高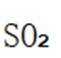

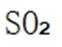
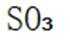
C.这个说法是正确的。因为硫黄(S)可以直接燃烧生成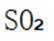
D.生产过程中产生的尾气可用碱液吸收:这个说法是正确的。在生产过程中,尾气中可能含有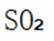
故选B
关于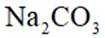
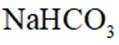
正确答案
解析
本题考查碳酸钠和碳酸氢钠性质比较的知识点。
A.碳酸钠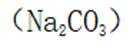
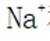
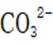
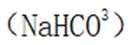
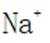
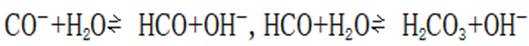
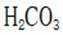
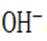
B.这个说法是正确的。碳酸氢钠与氢氧化钠反应可以生成碳酸钠和水: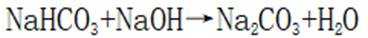
C.这个说法也是正确的。碳酸氢钠在加热时会分解成碳酸钠、水和二氧化碳: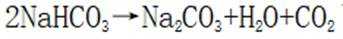
D.这个说法是不正确的。室温下,碳酸钠和碳酸氢钠饱和溶液的pH差异主要是由于它们的水解程度不同,而不是溶解度差异。碳酸钠的水解程度大于碳酸氢钠,因此碳酸钠溶液的pH值更高。选项D是不正确的。
故选D
氘代氨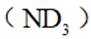
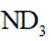
①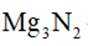
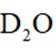
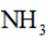
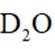
正确答案
解析
本题考察同位素化合物性质的知识点。
A.这个说法是正确的。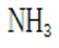
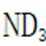
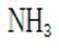
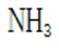
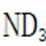
B.这个说法也是正确的。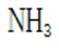
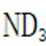
C.这个说法是正确的。方法①中,化学方程式应该是:
D.方法②得到的产品纯度比方法①的高这个说法是错误的。方法②中是通过氨的孤对电子对重水中的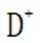
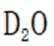
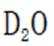
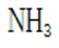
故选D
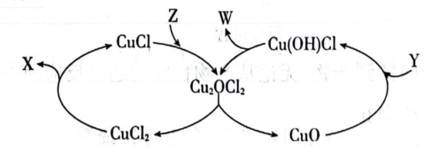
可采用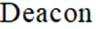
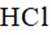
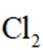
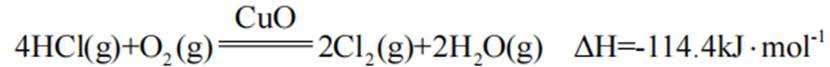
下列说法不正确的是( )
正确答案
解析
本题考查盐酸催化制取氯气的知识点。
A.这个说法是正确的。根据催化机理图,Y代表HCl,W代表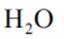
B.这个说法是不正确的。催化剂只需少量即可,不断循环利用,因此不需要这么多催化剂,删除B错误。
C.这个说法是正确的。根据勒夏特列原理,升高温度会使放热反应(ΔH<0)的平衡逆向移动,以减少热量。因此,升高反应温度会使HCl被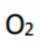
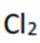
D.这个说法是正确的。在Deacon催化氧化法中,图中涉及的氧化还原反应有两个,分别为
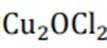
故选B
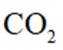
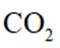
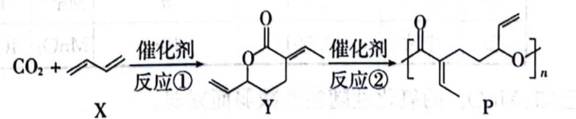
已知:反应①中无其他产物生成。
下列说法不正确的是( )
正确答案
解析
本题考查有机高分子合成的知识点。
A.根据图片中的反应①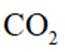
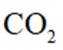
B.这个说法是不正确的。根据图片中的合成路线,P完全水解后得到的产物分子式是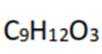
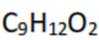
C.这个说法是正确的。P分子中含有碳碳双键,这些双键可以与其他的双键发生交联反应,形成网状结构。这种结构有助于提高聚合物的机械强度和稳定性。
D.这个说法是正确的。Y分子中含有碳碳双键,那么它们可以通过加聚反应生成高分子,但是,由于其类似苯环的结构,这意味着这种高分子难以降解。
故选B
下列依据相关数据作出的推断中,不正确的是( )
正确答案
解析
本题考查化学相关序数比较的知识点。
A.这个说法是正确的。在化学平衡中,Q(反应商)是衡量反应进行程度的一个指标,其计算方式与K(平衡常数)相同,只是Q的计算中使用的是实际浓度,而K使用的是平衡浓度。如果Q<K,则反应向右(生成物方向)进行以达到平衡;如果Q>K,则反应向左(反应物方向)进行以达到平衡。因此,选项A是正确的
B.这个说法也是正确的。一元弱酸的Ka值越大,其电离程度越高,生成的氢离子浓度越大,因此其溶液的pH值越小。所以,可以通过比较一元弱酸的Ka值来推断它们同温度同浓度稀溶液的pH大小。选项B是正确的。
C.这个说法是不正确的。第二周期主族元素(从锂Li到氖Ne)的电负性确实是依次增大的,但是它们的第一电离能并不是依次增大的。第一电离能是指从一个原子中移除一个电子所需要的能量,它受到电子排布和核电荷的影响。在第二周期中,氮(N)的第一电离能大于氧(O),这是因为氮的2p电子壳层半充满,更加稳定,所以需要更多的能量来移除电子。因此,选项C是不正确的。
D.这个说法是正确的。氢卤键的键能越大,说明键越强,因此分子越稳定。所以,可以根据FClBrI的氢化物分子中氢卤键的键能来推断它们的热稳定性强弱。选项D是正确的。
综上所述,不正确的说法是C。故选C
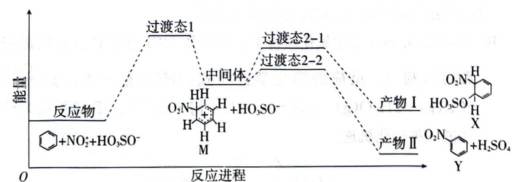
苯在浓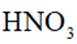
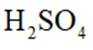
正确答案
解析
本题考查苯在强酸下的取代加成反应的知识点。
A.这个说法是正确的。根据能量变化示意图,从中间体到产物Ⅱ的能量降低,说明产物Ⅱ比中间体更稳定。同时,能量降低也意味着反应速率加快,因为反应物和中间体的能量高于产物,反应向产物方向进行。
B.这个说法是正确的。根据能量变化示意图,X是反应物苯和硝酸在浓硫酸催化下形成的加成产物,而Y是在X的基础上进一步反应形成的取代产物。
C.这个说法是不正确的。分析M,在苯分子中,大π键是由苯环上的六个碳原子共享的π电子云形成的。这些π电子是高度离域的,分布在整个苯环上,使得苯环具有高度的稳定性。硝基苯中的硝基是一个强吸电子基团,它通过σ键与苯环上的碳原子连接,并通过诱导效应和共轭效应影响苯环上的电子分布。硝基的存在会使得苯环上的电子密度降低,特别是与硝基相连的碳原子上,因为硝基的吸电子效应会拉走电子,使得这个碳原子上的电子密度降低。这种电子密度的降低会影响到大π键的离域性,使得硝基苯的大π键的能量相对于苯的大π键来说会有所增加。
D.这个说法是正确的。根据能量变化示意图,浓硫酸在硝化反应中起到催化剂的作用,加速了到Y的转化过程。
故选C
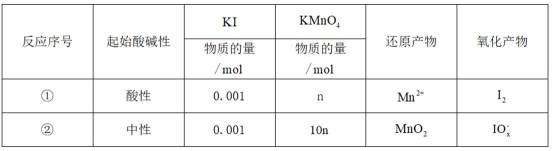
不同条件下,当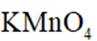
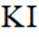
已知: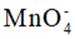
下列说法正确的是( )
正确答案
解析
本题考查
A.这个说法是不正确的。反应①中,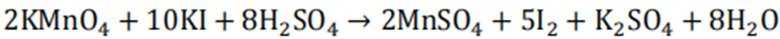

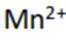
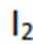
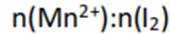
B.对比反应①和②,考察氧化还原反应电荷数守恒,②消耗高锰酸钾的量是①的10倍,KI不变。由A可知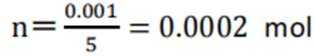
因此,x=3。B正确。
C.这个说法是不正确的。实际上,碘离子的还原性随着酸性的减弱而增强。这是因为酸性减弱会导致高锰酸根
D.这个说法是不正确的。在反应①中,随着反应的进行,高锰酸钾被还原为
故选B
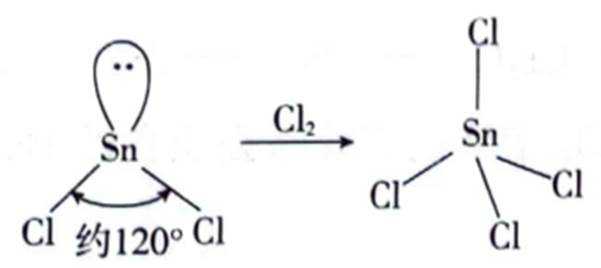
锡(Sn)是现代“五金”之一,广泛应用于合金、半导体工业等。
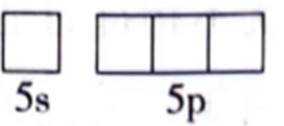
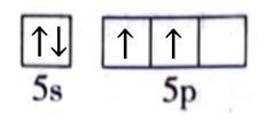
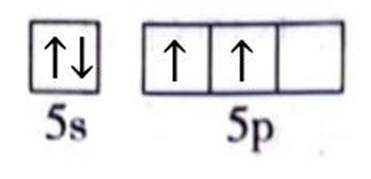
(1)Sn位于元素周期表的第5周期第IVA族。将Sn的基态原子最外层轨道表示式补充完整:
(2)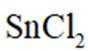
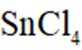
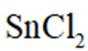
①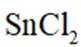
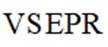
②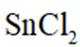
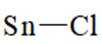
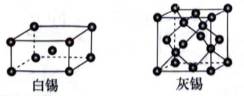
(3)白锡和灰锡是单质
①灰锡中每个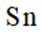
②若白锡和灰锡的晶胞体积分别为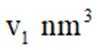
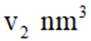
(4)单质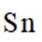
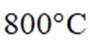
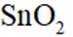
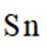
正确答案
(1)
(2)①平面三角形②sp3杂化
(3)①4②
(4)与焦炭在高温下生成CO,CO将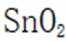
解析
考点是锡元素物理化学性质的知识点。
(1)根据元素周期表,Sn位于第5周期第IVA族,其电子排布为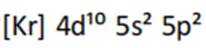
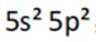
这表示Sn的最外层轨道上有2个电子位于5s轨道上,另外2个电子位于5p轨道上。
(2)①
过程:
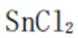
②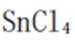
过程:在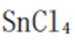
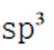
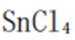
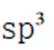
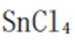
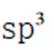
(3)①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有4个。因为灰锡具有立方金刚石结构,这种结构的特点是每个原子周围都有四个最近邻原子,形成一个正四面体结构。
②算均摊,白锡是面心立方结构,每个晶胞相当于有1+8×=2个Sn原子;灰锡是立方金刚石结构,立方体8个顶点、6个面各有一个原子,然后里面空隙有4个原子,每个晶胞相当于有4+6×+8×=8个Sn原子,故其密度比为
(4)通入空气在800摄氏度下的作用是提供氧气,以促进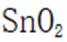
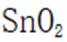

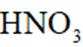
(1)方法一:早期以硝石(含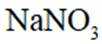
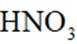
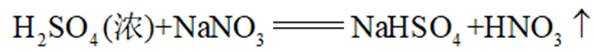
(2)方法二:以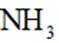
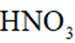
①第I步反应的化学方程式为___________________________。
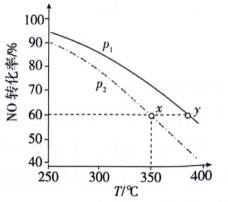
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入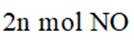
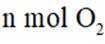
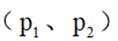
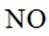
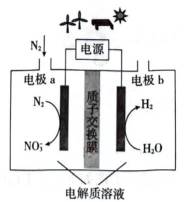
(3)方法三:研究表明可以用电解法以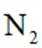
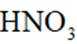
①电极a表面生成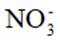
②研究发现:
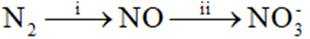
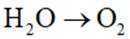
(4)人工固氮是高能耗的过程,结合
正确答案
(1)难挥发性
(2)①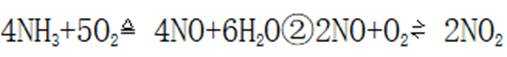
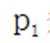
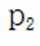
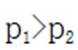
(3)①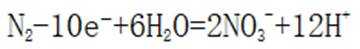
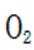
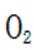
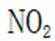
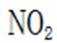
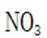
解析
考点是固氮制备硝酸的知识点。
(1)分析:浓硫酸难挥发(吸水性),而产物HNO3是气体,根据化学平衡的勒夏特列原理,特性有利于反应正向进行。
(2)①看图,即氨气与氧气反应生成NO,故方程式为:
②同理,看图,写出II对应的化学方程式,为NO和氧气生成
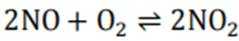

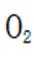


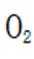
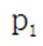
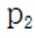

(3).①观察图,可知a为阳极,在电极a,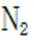
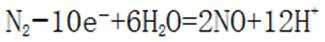

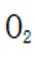
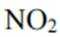

(4).氮氮三键很稳定化学能很高,所以人工固氮是高能耗过程。
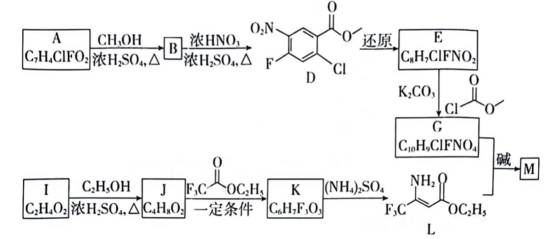
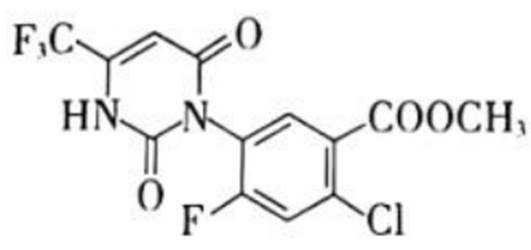
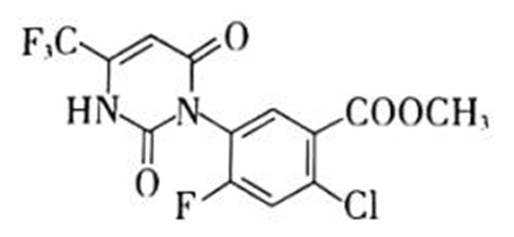
除草剂苯嘧磺草胺的中间体M合成路线如下。
(1)D中含氧官能团的名称是_________。
(2)A→B的化学方程式是___________________________________________________。
(3)I→J的制备过程中,下列说法正确的是_________(填序号)。
a.依据平衡移动原理,加入过量的乙醇或将J蒸出,都有利于提高I的转化率
b.利用饱和碳酸钠溶液可吸收蒸出的I和乙醇
c.若反应温度过高,可能生成副产物乙醚或者乙烯
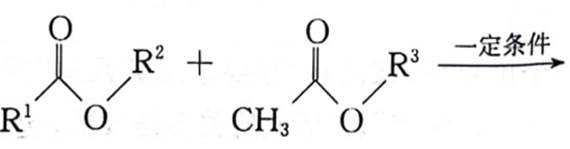
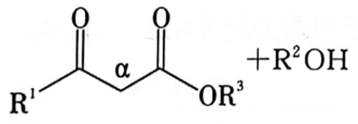
(4)已知:
①K的结构简式是_________。
②判断并解释K中氟原子对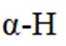
(5)M的分子式为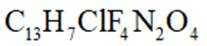

正确答案
(1)硝基、酯基
(2)
(3)abc
(4)①
②氟原子可增强α−H的活泼型,氟原子为吸电子基团,降低相邻碳原子的电子云密度,使得碳原子的正电性增加,有利于增强α−H的活泼型
(5)N−H
解析
考点是有机化学合成的知识点。
(1)D中苯环被取代了一个硝基和酯基,故直接填出。
(2)A到B为A中的羧基在浓硫酸催化下与甲醇中的羟基发生酯化反应,故应为:
(3)与(2)同理,I→J为乙酸与乙醇的酯化反应,那么根据勒夏特列(平衡移动)原理,加入过量的乙醇或将J蒸出,都有利于提高I的转化率,故a正确。
饱和碳酸钠溶液可与乙酸反应,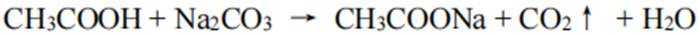
反应温度过高时,乙醇在浓硫酸做一下脱水可能形成乙醚,或者发生消去反应生成乙烯,故c正确。
(4)①观察图,利用所给信息即酯基的α−H与另一分子的酯基可以发生取代反应,所以推测出K为
②氟原子因其电负性较高,常被认为是一种强吸电子基团。当氟原子连接到有机分子中时,它会显著降低相邻碳原子的电子云密度,导致碳原子的正电性增加。这种正电性的增强有利于提高α-H的活泼性,因为α-H的活泼性与其所在碳原子的电子云密度有关。因此,氟原子的存在可以增强α-H的活泼性,使其更容易发生化学反应。
(5)由已知知,M中除苯环外还含包括被两个氮原子代替碳原子的苯环,副产物还有甲醇和乙醇,那么可推出G与L中N−H、酯基分别发生反应得到酰胺基,故断裂的化学键为N−H和C−O键,由酰胺基逆推可得M结构简式为:
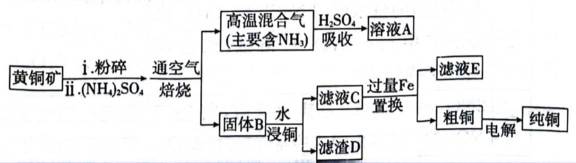
利用黄铜矿(主要成分为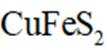

(1)矿石在焙烧前需粉碎,其作用是___________________________。
(2)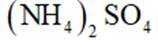
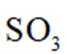
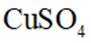
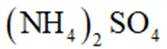
(3)矿石和过量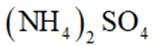
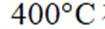
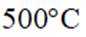
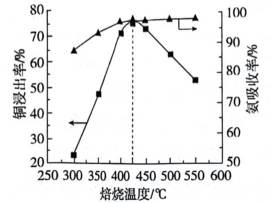
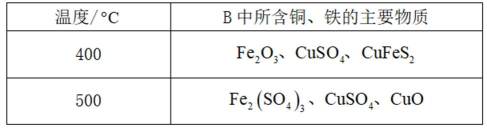
①温度低于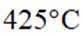
②温度高于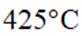
(4)用离子方程式表示置换过程中加入Fe的目的___________________________。
(5)粗铜经酸浸处理,再进行电解精炼;电解时用酸化的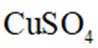
_________________________________________________________________________________。
正确答案
(1)增大接触面积,加快反应速率,使反应更充分
(2)
(3)①温度低于425℃,随焙烧温度升高,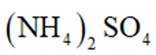
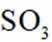
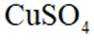
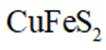
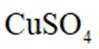
(4)
(5)粗铜若未经酸浸泡处理,其中杂志Fe会参与放电,则消耗相同电量时,会降低得到纯铜的含量
解析
考点是电解法冶炼铜的知识点。
(1)矿石在焙烧前需粉碎的作用是增大与氧气的接触面积,加快反应速率。分析:
反应速率与反应物的接触面积有关:当矿石被粉碎成更小的颗粒时,其表面积增大,与氧气(或其他反应物)的接触面积也随之增大。增大接触面积有助于提高反应物的有效碰撞频率:更多的矿石颗粒暴露在反应介质中,使得矿石与氧气之间的有效碰撞频率增加,从而加快了化学反应的速率。加快反应速率有助于提高矿石的利用率:在矿石的焙烧过程中,矿石中的有用成分(如金属氧化物)与氧气反应生成金属或其他有用的物质。通过粉碎矿石,可以提高这些有用成分的转化率,从而提高矿石的利用率。
(2)注意硫酸铵的热分解非氧化还原反应。硫酸铵在高温下会热分解,生成氨气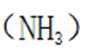
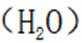
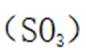
(3)仔细观察图表,在425℃之前,氨吸收率不断上升,副产物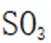
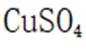
①温度低于425℃,随焙烧温度升高,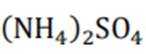

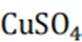
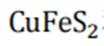
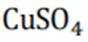
(4)注意C为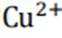
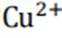
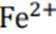
(5)加酸的目的就是为了去除粗铜中的Fe杂质,如果未经酸浸处理,那么Fe也会参与电化学反应,得到的铜样品不纯,消耗相同电量,所得纯铜的量下降。
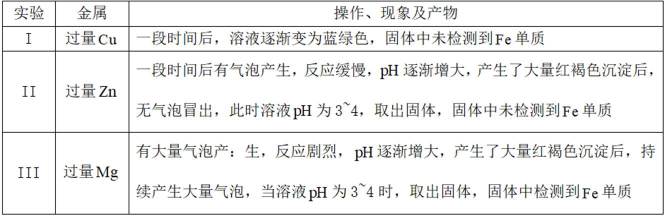
某小组同学向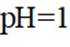
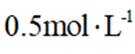
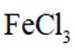
(1)理论分析
依据金属活动性顺序,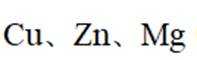
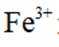
(2)实验验证
①分别取实验I、Ⅱ、Ⅲ中的少量溶液,滴加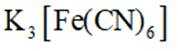
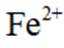
②实验Ⅱ、Ⅲ都有红褐色沉淀生成,用平衡移动原理解释原因___________________________.
③对实验Ⅱ未检测到Fe单质进行分析及探究。
i.a.甲认为实验Ⅱ中,当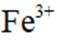
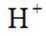
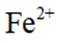
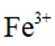
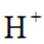
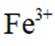
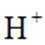
b.乙认为在pH为3~4的溶液中即便生成Fe也会被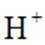
证实了此条件下可忽略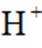
c.丙认为产生的红褐色沉淀包裹在Zn粉上,阻碍了Zn与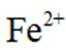
i.查阅资料: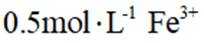
结合a、b和c,重新做实验Ⅱ,当溶液pH为3~4时,不取出固体,向固-液混合物中持续加入盐酸,控制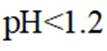
(3)对比实验Ⅱ和Ⅲ,解释实验Ⅲ的固体中检测到Fe单质的原因__________________。
正确答案
(1)Mg和Zn
(2)①产生蓝色沉淀②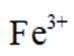
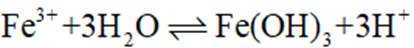
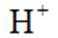
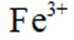
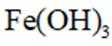
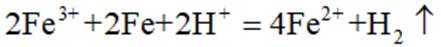
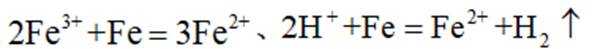
(3)加入镁粉后产生大量气泡,使镁粉不易被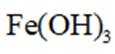
解析
考点是铁离子的滴定反应的知识点。
(1)根据金属活动性顺序表,Mg>Zn>Fe>Cu,其中Mg的活动性最强,Cu的活动性最弱。所以Cu、Zn、Mg中可以将Fe3+还原为Fe的金属是Mg和Zn。
(2)①注意滴定的颜色反应:二价铁离子
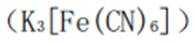
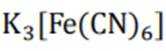
这种蓝色沉淀在化学分析中常用作检测亚铁离子的试剂。
②注意是酸性条件,Mg和Zn都会消耗氢离子,故使平衡向右移动,生成Fe(OH)3沉淀
③a根据描述直接配平离子方程式为:
b注意,若生成的Fe被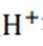
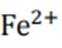
故向pH为3~4的稀盐酸中加铁粉,一段时间后取出少量溶液,滴加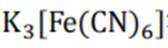
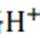
c此时加入HCl作用为破除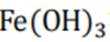
KSCN溶液与三价铁离子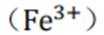
在这个反应中,铁离子与硫氰酸根离子(形成了一种红色的配合物,即硫氰酸铁(III)离子。这种配合物的形成使得溶液的颜色从无色变为红色。如此可排除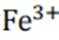
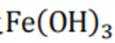
(3)总结abc的对比试验,容易得出:Mg的活泼性最强,加入镁粉后更容易产生大量气泡,使镁粉不易被