- 真题试卷
- 模拟试卷
- 预测试卷
1. 设NA为阿伏加德罗常数的值。下列说法正确的是( )
正确答案
解析
A. Na2O2与足量CO2反应为自身氧化还原反应,每个Na2O2中的-1价氧原子是一个升高1价、另一个降低1价,故0.1 mol Na2O2转移的电子数目为0.1 NA,A正确;
B.标准状况下,CCl4是液体 ,故错误;
C.缺少体积,故不能计算出Na+的数目,选项错误;
D.3.2 g O2和O3的混合物所含氧原子为0.2 mol,均为O2时才有分子数目0.1 NA,故选项错误。
考查方向
解题思路
依据物质的性质等知识点逐项筛选。
易错点
易错选C。
知识点
2. 分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是 ( )
正确答案
解析
A.酸的定义是指电离出的阳离子都是H+,而不是含有氢元素,故错误;
B.豆浆是胶体,且分散质粒子直径在1nm~100 nm之间,故正确;
C.Na和H2O的反应是离子反应,有H+离子参加,故错误;
D.氯气中也能燃烧,且燃烧是指所有的发光发热的剧烈的氧化还原反应,故错误。
考查方向
解题思路
依据性质与概念等逐项判断。
易错点
易错选A或C。
知识点
3. 相同条件下,因溶液浓度不同,化学反应方程式表达可能不同的是( )
正确答案
解析
只有选项B中Cu与硝酸的反应,因硝酸的浓、稀不同,硝酸的还原产物就不同——NO2或NO,化学方程式的表达当然也不同,故B是符合题意的选项。
考查方向
解题思路
依据物质性质的考查。
易错点
因为混淆铝和铝离子而易错选D。
知识点
4. 2 5℃时,下列各组离子在指定溶液中一定能大量共存的是( )
正确答案
解析
A.溶液中 的OH- +NH4+ = NH3·H2O, 故不能大量共存;
B.KNO3溶液提供NO3-:NO3- + H++Fe2+→NO↑+Fe3++H2O,故不能大量共存;
C.能使紫色石蕊变红的溶液为酸性溶液,H+与Ca2+、Na+、Cl-、NO3-均不反应,故能大量共存;
D.Cr2O72-不是无色的,是橙色的溶液,故错误。
考查方向
解题思路
依据离子性质及其反应规律筛选。
易错点
易错选B或D。
知识点
5. 下列叙述正确的是( )
正确答案
解析
A. CH3COONa的水解显碱性,溶液中c(OH-) >c(H+),故错误;
B. Na2CO3溶液加水稀释,越稀越水解,但是加水使溶液体积增大得多,而水解生成的OH-增大得少,故c(OH-)降低,pH减小,选项错误;
C. 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等是正确的;
D. 在Na2S溶液中加入AgCl固体,会出现沉淀的转化——AgCl转化为溶度积更小的Ag2S,溶液中c(S2-)会发生变化,故选项错误。
考查方向
解题思路
依据电离平衡、水解平衡、溶度积等原理解题。
易错点
易错选B。
知识点
7. 有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:2SO2+O2 
正确答案
解析
起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图示),反应为:2SO3 
A容器在体积增大的过程中,浓度降低,反应速率降低,故达到平衡所需时间比容器B长(选项A错误)。
均达到平衡后,向两容器中分别通入等量的氦气,恒压容器A的体积增大,导致平衡又向生成SO2+O2的方向移动,A中SO3的体积分数减少(选项D错误),恒容容器B中平衡不移动、SO3的体积分数不变。
考查方向
解题思路
依据恒温恒压、恒温恒容时平衡移动规律解题。
易错点
易错选A或D。
知识点
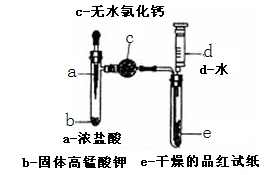
某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
8.将a中浓盐酸挤入试管中,发生反应的化学方程式为 。
9.仪器c的名称为 ,其中固体也可用 代替。
10.当试管e中充满黄绿色气体时,观
11.注射器在实验中除了可向试管e中加水,还有 的作用。
正确答案
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
解析
(1)a中是浓盐酸与高锰酸钾反应制取氯气,化学方程式是2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(2)干燥管;P2O5或硅胶一般不用无水CuSO4。
解析
(2)仪器c是球形干燥管——目的是吸收水蒸气,以获得干燥的氯气、并通过干燥的品红试纸检验氯气有无漂白性;氯气与碱性干燥剂反应,所以只要是酸性或中性干燥剂,如P2O5或硅胶也可以。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(3)没有;有;干燥的氯气不能使品红试纸褪色,氯气溶于水后,和水反应能生成HClO具有强氧化性,能使品红试纸褪色。
解析
(3)当试管e中充满黄绿色气体时,e中的品红试纸不变色,说明干燥的氯气无漂白性;再将注射水入e后,品红试纸褪色,说明是生成的HClO有漂白性。由此得出的结论是:干燥的氯气不能使品红试纸褪色,氯气溶于水后,生成具有强氧化性的HClO,能使品红试纸褪色。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(4)反应结束后,可向上拉针栓,从试管中抽出氯气,起到储存多余氯气的作用,防止氯气的污染。
解析
(4)反应结束后,可向上拉针栓,从试管中抽出氯气,起到储存多余氯气的作用,防止氯气的污染。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
易错点
(4)注射器在实验中除了可向试管e中加水,还有的作用?。
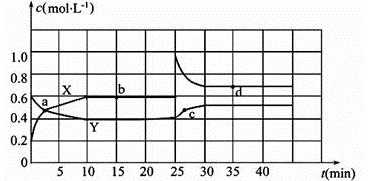
Ⅰ.在一定条件下,xA+yB 
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g) 
12.已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 移动。
13.若B、C是气体,其他条件不变时增加A的用量,
14.图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
15.①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1
②0~15 min ,反应2NO2(g) 
③25 min~35 min时,反应2NO2(g) 
16.反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是 (用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是 。
A.加入催化剂
B.缩小容器体积
C.升高温度
D.加入一定量的N2O4
正确答案
(1)逆反应方向(左) 。
解析
(1)根据可逆反应方程式,已知C是气体,且x+y=z,加压时平衡如果发生移动,则说明该反应不是气体分子数相等的反应,尽管有x+y=z,但是必定A或B有一个不是气体,因此该反应是气体体积增加的反应,故加压平衡必向逆反应方向移动。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
易错点
若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是
正确答案
(2)固体或纯液体。
解析
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,说明A没有浓度改变,则A的状态为固体或纯液体。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
易错点
若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施
正确答案
(1)X ; b和d 。
解析
根据浓度的变化程度来判断,浓度的变化量之比等于化学方程式中的化学计量数之比,浓度变化较快的为NO2,即曲线X表示NO2浓度随时间的变化。当体系中物质的量浓度不再发生变化时,即达到平衡,所以b、d点为平衡点。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
正确答案
(2)①0.04 ;②10/9;③ = 。
解析
①前10 min内,NO2 的浓度变化量为(0.6-0.2) mol/L =0.4 mol/L,用NO2表示的化学反应速率v(NO2)=0.4 mol·L-1÷10 min =0.04 mol·L-1·min-1。
②0~15 min ,反应2NO2(g)
③反应在25 min~35 min时,N2O4 浓度逐渐增大,NO2 的浓度迅速增大后又逐渐减小,所以一定是增大NO2 的浓度,没有改变温度,故反应2NO2(g)
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
正确答案
(3)增大NO2的浓度;B、D。
解析
根据图像可知25 min时X浓度突然增大,Y浓度不变,说明增大了NO2的浓度,根据方程式的特点可知,增加NO2浓度相当于增大体系压强,所以也可以采取缩小容器的体积,C项正确,增大N2O4 的浓度也相当于增大压强,平衡正向移动,D项正确;答案选B、D。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
易错点
(3)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是?。
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
17.预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)= 。
18.上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。
19.高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式:
。
20.若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数将 (填“升高”、“降低”或“不变”)。
正确答案
(1)2.0 mol·L-1。
解析
(1)已知Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)=Ksp/ c2(OH-)=1.8×10-11/(3.0×10-6)2=2 mol·L-1。
考查方向
解题思路
依据溶度积原理、无机物性质、制备流程推理判断及计算。
易错点
计算确定碱式碳酸镁的化学式。
正确答案
(2)NH4Cl。
解析
(2)因为滤液中所留下的是NH4+和Cl-的溶液,故浓缩结晶所得主要固体物质的化学式为NH4Cl。
考查方向
解题思路
依据溶度积原理、无机物性质、制备流程推理判断及计算。
易错点
计算确定碱式碳酸镁的化学式。
正确答案
(3)m(MgO)=2.00 g,m(CO2)=

解析
(3)取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,计算如下:
已知:m(MgO)=2.00 g,n(MgO)=2.00 g/40 g·mol-1=0.05 mol;
n(CO2)=0.896 L/22.4 L·mol-1=0.04 mol;m(CO2)= 0.04 mol×44 g/mol=1.76 g;
由质量守恒定律得:m(H2O)=4.66 g-2.00 g-1.76 g=0.9 g,
n(H2O)=0.9 g/18 g·mol-1=0.05 mol;
则n(MgO)∶n(CO2)∶n(H2O)= 0.05 mol∶0.04 mol∶0.05 mol =5∶4∶5。由原子守恒得出碱式碳酸镁的化学式为:Mg(OH)2·4MgCO3·4H2O。
考查方向
解题思路
依据溶度积原理、无机物性质、制备流程推理判断及计算。
易错点
计算确定碱式碳酸镁的化学式。
正确答案
(4)升高。
解析
(4)若碱式碳酸镁再混有MgCO3,则产品中镁的质量分数将 “升高”。
考查方向
解题思路
依据溶度积原理、无机物性质、制备流程推理判断及计算。
易错点
计算确定碱式碳酸镁的化学式。
加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施。下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
21.用下图所示装置进行实验。
①A装置的作用是 。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊
试纸变成 色,说明SO2与水反应生成一种酸,其化学反应方程式是 。
③D装置的作用是 ,
D中发生反应的化学方程式是 。
22.往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐 (填“变大”或“变小”), 直至恒定,原因是 (写出反应的离子方程式)。
23.SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4, 则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
24.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
正确答案
(1)①干燥二氧化硫 ;②红;SO2+H2O
③吸收二氧化硫尾气防止环境污染;SO2+2NaOH=Na2SO3+H2O。
解析
(1)如图实验流程。
①A装置中的浓硫酸起吸水剂的作用或干燥剂。
②干燥的SO2经过B装置内干燥的石蕊试纸的颜色没有发生变化,但遇到C装置内湿润的蓝色石蕊试纸变成红色,则说明SO2与水反应生成一种酸,其化学反应方程式是SO2+H2O
③D装置是典型的尾气吸收装置,故其作用是吸收多余的二氧化硫,防止环境污染;
其化学方程式是SO2+2NaOH=Na2SO3+H2O。
考查方向
解题思路
依据二氧化硫的性质、实验流程及工业污染等解题。
正确答案
(2)< ;变小;2H2SO3+O2=4H++2SO42- (或2SO2+O2+2H2O= 4H++2SO42-)。
解析
(2)往盛有水的烧杯中通入SO2气体,生成亚硫酸,故测得所得溶液的pH<7;然后每隔1h测定其pH,发现pH逐渐 “变小”, 直至恒定,原因是2H2SO3+O2=4H++2SO42- 。
考查方向
解题思路
依据二氧化硫的性质、实验流程及工业污染等解题。
易错点
(2)……发现pH逐渐 (填“变大”或“变小”), 直至恒定,原因是 ?。
正确答案
(3)催化剂 。
解析
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4, 则在此过程中的飘尘是作为 “催化剂”。
考查方向
解题思路
依据二氧化硫的性质、实验流程及工业污染等解题。
正确答案
HNO3。
解析
废气中氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因。
考查方向
解题思路
依据二氧化硫的性质、实验流程及工业污染等解题。
6. 下表是反应的离子方程式,其中评价关系不正确的是 ( )
正确答案
B
解析
B中NaHSO4与Ba(OH)2反应至中性是:2NaHSO4+Ba(OH)2以保证没有H+或OH-剩余,此时离子方程式是:2H++SO42-+Ba2++2OH- =BaSO4↓+2H2O。故选项B评价不正确。
考查方向
解题思路
依据物质性质及题给方程式去判断。
易错点
易错选D。