- 真题试卷
- 模拟试卷
- 预测试卷
1.从化学看生活,你认为下列说法不合理的是( )
正确答案
解析
A、镁铝是轻金属,而合金的硬度大特点,所以可用作高铁车厢材料,故A正确;
B、聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染,故B正确;
C、明矾无消毒、杀菌作用,但可净水,故C错误;
D、大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的一种重要因素,故D正确.
本题正确答案是C
考查方向
解题思路
A、镁铝是轻金属,而合金的硬度大特点;
B.聚乙烯塑料很难降解,聚乳酸塑料易降解;
C、明矾无消毒、杀菌作用,但可净水;
D、大量燃烧化石燃料可产生有害气体和烟尘
易错点
物质的性质和概念易混淆
知识点
4.A、B、C、D为原子序数依次增大的短周期主族元素, B2-和D3+的电子层结构相同, A-的电子层结构与氦相同,C是同周期原子半径最大的元素,下列说法错误的是( )
正确答案
解析
A、B、C、D为原子序数依次增大的短周期主族元素,A-的电子层结构与氦相同,则A为H元素,B2-和D3+的电子层结构相同,B处于第二周期、D处于第三周期,由离子电荷可知,B为O元素、D为Al,C是同周期原子半径最大的元素,原子序数大于氧、小于Al,只能处于第三周期,故C为Na.
A.O2-和Al3+的电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Al3+,故A正确;
B.非金属性C(Na)>D(Al),故碱性:氢氧化钠>氢氧化铝,故B正确;
C.A为H,属于非金属元素,C为Al,属于金属元素,C元素失去电子能力更强,故C错误;
D.H元素与O元素可形成共价化合物:H2O、H2O2,故D正确.
本题正确答案是C
考查方向
解题思路
A、B、C、D为原子序数依次增大的短周期主族元素,A-的电子层结构与氦相同,则A为H元素,B2-和D3+的电子层结构相同,B处于第二周期、D处于第三周期,由离子电荷可知,B为O元素、D为Al,C是同周期原子半径最大的元素,原子序数大于氧、小于Al,只能处于第三周期,故C为Na,据此解答
易错点
原子结构与元素周期律的应用、非金属性强弱的判断、粒子半径大小的比较
知识点
5. 常温下,下列说法正确的是( )
正确答案
解析
A.分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
B.pH=a的CH3COOH溶液加水稀释10n倍后,稀释过程中醋酸的电离程度增大,则稀释10n倍后,溶液的pH变化小于n,即稀释后溶液的pH<a+n<7,故B错误;
C.pH相等的CH3COONa、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
D.Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
本题正确答案是D
考查方向
解题思路
A.醋酸为弱酸,pH相等时醋酸的浓度较大,消耗的氢氧化钠的物质的量较大;
B.醋酸在稀释过程中电离程度增大,则稀释10n倍后,溶液的pH变化小于n;
C.氢氧化钠抑制了水的电离,醋酸钠水解促进了水的电离;
D.根据碳酸钠溶液中的质子守恒判断
易错点
弱电解质的电离及影响、离子浓度大小比较、溶液pH的计算;
知识点
6. 下列实验的现象与对应结论均正确的是( )
正确答案
解析
A.最高价氧化物的水化物的酸性越强,则元素的非金属越强,所以向饱和Na2SiO3溶液中通入二氧化碳,能比较碳与硅的非金属性强弱,故A正确;
B.常温下将Al片放入浓硝酸中,无明显变化,铝和浓硝酸发生钝化现象,发生反应生成一薄层致密的氧化物薄膜阻止反应进行,表现了强氧化性,故B错误;
C.氯气能与鲜花中的水反应和是能吃次氯酸,氯气没有漂白性,次氯酸有漂白性,故C错误;
D.BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀,是因为Qc>Ksp时而产生沉淀,不能说明Ksp(BaSO4)<Ksp(BaCO3),故D错误.
本题正确答案是A
考查方向
解题思路
A.最高价氧化物的水化物的酸性越强,则元素的非金属越强;
B.常温下浓硫酸、浓硝酸遇到铝、铁发生钝化现象,生成一薄层致密的氧化物薄膜阻止反应进行;
C.氯气没有漂白性,次氯酸有漂白性;
D.如果Qc>Ksp时就能产生沉淀
易错点
物质具有的性质和实验的现象与结论的关系;
知识点
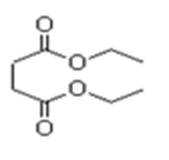
2.琥珀酸与乙醇反应生成琥珀酸二乙酯(结构如图所示),下列有关说法正确的是( )
正确答案
解析
A.1mol琥珀酸二乙酯含有2mol酯基,能与2mol的NaOH反应,故A错误;
B.琥珀酸二乙酯含有酯基,可发生取代反应,在一定条件下,羰基可发生加成,且有机物可燃烧,属于氧化反应,故B正确;
C.琥珀酸为1,4-丁二酸,分子式为C4H6O4,故C错误;
D.为链状化合物,不含环,故D错误.
本题正确答案是B
考查方向
解题思路
该有机物含有酯基,可发生取代、水解反应,结合分子的结构和官能团的性质解答该题
易错点
官能团的性质即酯的性质。
知识点
3.用NA表示阿伏伽德罗常数的值。下列叙述正确的是( )
正确答案
解析
A.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故A错误;
B.1molCl2与足量的铁反应,氯气最多得到2mol电子,则转移的电子数为2NA,故B错误;
C.标准状况下四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.0.2mol金属钠与足量的O2反应生成0.1mol过氧化钠,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,产物中总共含有0.3mol离子,含有的离子数为0.3NA,故D正确;
本题正确答案是D
考查方向
解题思路
A.苯分子中的碳碳键为介于单键和双键之间的独特键,不存在碳碳双键;
B.1mol氯气与铁完全反应最多得到2mol电子;
C.标准状况下,四氯化碳的状态不是气体;
D.0.1mol钠完全反应生成0.1mo过氧化钠,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子.
易错点
注意明确标准状况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系。
知识点
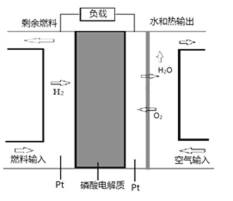
7. 某种PAFC是以磷酸为电解质、Pt为电极的燃料电池(如图所示),具有电解质稳定、构造简单等特点。浓磷酸的凝固点是42°C, PAFC的工作温度通常在150-220°C。以下说法错误的是( )
正确答案
解析
A.通入氧气的一极为正极,原电池工作时,阳离子向正极移动,故A正确;
B.浓磷酸为电解质溶液,不可能生成OH-,电极方程式为O2+4e-+4H+=2H2O,故B错误;
C.PAFC的工作温度通常在150-220°C,常温下不反应,故C正确;
D.负极发生氧化反应,甲醇被氧化生成二氧化碳气体,电极方程式为CH3OH+H2O-6e-═CO2↑+6H+,故D正确.
本题正确答案是B
考查方向
解题思路
A.原电池工作时,阳离子向正极移动;
B.浓磷酸为电解质溶液,不可能生成OH-;
C.PAFC的工作温度通常在150-220°C,常温下不反应;
D.负极发生氧化反应,甲醇被氧化生成二氧化碳气体
易错点
原电池原理、正负极的判断、电极反应式的书写;
知识点
高硫煤脱硫分为燃烧前、燃烧中及燃烧后脱硫。
11.燃烧前脱硫:可用生物脱硫法,即在酸性环境下,有些种类的细菌能利用空气将Fe2+氧化成Fe3+而获得能量,Fe3+再与煤中的FeS2(Fe为+2价)反应使硫转化为硫酸根离子而去除。写出生物脱硫法的离子方程式 、 。
12.燃烧中脱硫:通过加入石灰石,在燃烧过程中将硫元素以CaSO4的形式固定,从而降低SO2的排放。已知钙的燃烧热635kJ·mol-1,硫的燃烧热297kJ·mol-1、硫酸钙的生成焓△H=-1434kJ·mol-1(即由1molCa(s)、1molS(s)、2molO2(g)生成1molCaSO4(s)的△H值),则CaO(s)+SO2(g)+1/2O2(g)==CaSO4(s) ,△H= kJ·mol-1。
13.燃烧后脱硫:以Na2SO3溶液作为吸收液,利用钠碱循环法脱除烟气中的SO2。图一中横坐标为pH,纵坐标X(i)为各含硫微粒占所有含硫微粒的物质的量分数。
①已知某次吸收液中n(SO32-):n(HSO3-)=10:1,则溶液的pH= 。
②当吸收液的pH约为6时,需电解再生。原理如图二所示。
Ⅰ.Pt(I)电极反应式 。
Ⅱ.H2SO4浓度,a%与b%的大小关系为 。
14.取10.00g干煤在1350℃以上的空气中充分燃烧,其中硫元素转化为SO2和少量的 SO3(g),氯元素转化为HCl,产生的气体用适量的双氧水吸收,所得溶液稀释至 100.0mL,每次取10.00mL用0.1000mol·L-1NaOH溶液进行滴定,滴定后的溶液加入适量的羟基氰化汞〔Hg(OH)CN〕,[发生反应:NaCl+Hg(OH)CN==Hg(Cl)CN+NaOH]再用H2SO4滴定,平均消耗15.55mLNaOH溶液和1.25×10-5mol的H2SO4。该煤中硫的质量分数为 。
正确答案
① 4H++4Fe2++O2 == 4Fe3++2H2O
② 8H2O+FeS2+14Fe3+==15Fe2++16H++2SO42-
解析
生物脱硫法,即在酸性环境下,有些种类的细菌能利用空气将Fe2+氧化成Fe3+,其离子反应方程式为:4H++4Fe2++O2 == 4Fe3++2H2O ;Fe3+再与煤中的FeS2(Fe为+2价)反应使硫转化为硫酸根离子而去除,离子方程式为:8H2O+FeS2+14Fe3+==15Fe2++16H++2SO42- 故答案为:① 4H++4Fe2++O2 == 4Fe3++2H2O;② 8H2O+FeS2+14Fe3+==15Fe2++16H++2SO42-
考查方向
解题思路
生物脱硫法,即在酸性环境下,有些种类的细菌能利用空气将Fe2+氧化成Fe3+而获得能量,Fe3+再与煤中的FeS2(Fe为+2价)反应使硫转化为硫酸根离子而去除,根据反应物结合质量守恒定律、电荷守恒书写离子方程式;
易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
正确答案
-502
解析
已知钙的燃烧热635kJ·mol-1,硫的燃烧热297kJ·mol-1、硫酸钙的生成焓△H=-1434kJ·mol-1(即由1molCa(s)、1molS(s)、2molO2(g)生成1molCaSO4(s)的△H值);
Ca + 1/2O2 =CaO △H=--635kJ·mol-1 ①
S + O2 = SO2 △H=-297kJ·mol-1 ②
Ca + S + 2O2 ==CaSO4 △H=-1434kJ·mol-1 ③
由③-①-②和盖斯定律可得:CaO(s)+SO2(g)+1/2O2(g)==CaSO4(s) ,△H=-502 kJ·mol-1 ,故答案为:502
考查方向
解题思路
已知钙的燃烧热635kJ·mol-1,硫的燃烧热297kJ·mol-1、硫酸钙的生成焓△H=-1434kJ·mol-1(即由1molCa(s)、1molS(s)、2molO2(g)生成1molCaSO4(s)的△H值);
Ca + 1/2O2 =CaO △H=--635kJ·mol-1 ①
S + O2 = SO2 △H=-297kJ·mol-1 ②
Ca + S + 2O2 ==CaSO4 △H=-1434kJ·mol-1 ③
由③-①-②和盖斯定律可得:CaO(s)+SO2(g)+1/2O2(g)==CaSO4(s) ,△H求出。
易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
正确答案
① 8.18
②Ⅰ. 2HSO3-+2e-==SO32-+H2↑或2H++2e-==H2↑
Ⅱ. a%
解析
H2SO3


②Ⅰ。当吸收液的pH降至约为6时,Pt(I)极2H++2e-==H2,溶液中阳离子H+ ,具有氧化性,在阴极上得到电子放电发生还原反应;Ⅱ. Pt(Ⅱ)极溶液中阴离子主要为HSO3-,具有还原性,在阳极上放电发生氧化反应;HSO3--2e-+H2O=SO42-+3H+ ,c(SO42-)增大,故答案为Ⅰ. 2HSO3-+2e-==SO32-+H2↑或2H++2e-==H2↑;Ⅱ. a%
考查方向
解题思路
SO2+H2O=H2SO3,H2SO3

易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
正确答案
2.448%(2.5%、2.45%均不扣分)
解析
取10.00g干煤在1350℃以上的空气中充分燃烧,其中硫元素转化为SO2和少量的SO3(g),氯元素转化为HCl,产生的气体用适量的双氧水吸收,所得溶液稀释至 100.0mL,此溶液为H2SO4和HCl混合溶液,每次取10.00mL用0.1000mol·L-1NaOH溶液进行滴定,其原理为HCl + NaOH=NaCl+H2O和H2SO4 +2NaOH=Na2SO4 +2H2O,消耗NaOH体积为15.55ml,后的溶液加入适量的羟基氰化汞〔Hg(OH)CN〕发生NaCl+Hg(OH)CN==Hg(Cl)CN+NaOH,即使NaCl转化为NaOH后,再用H2SO4溶液滴定,耗H2SO4物质的量为1.25×10-5mol,其关系式为:2HCl~2NaCl~2NaOH~H2SO4 ;可求出混合溶液n(HCl)=2.5×10-5mol,消耗NaOH的n(NaOH)=2.5×10-5mol;与混合溶液中H2SO4反应消耗的n(NaOH)= 15.55×10-3 L×0.1mol/L -2.5×10-5 =1.53×10-2 mol; 由H2SO4~2NaOH可得,10ml混合液中n(H2SO4)=7.65×10-3 mol;即100ml混合液中n(H2SO4)=7.65×10-2 mol,根据硫元素守恒,可知10.00g干煤中m(S)=n(S)×32g/mol=7.65×10-2 mol×32g/mol=0.2448g,该煤中硫的质量分数w(s)=0.2448g/10g×100%=2.448%,故答案为2.448%。
考查方向
解题思路
取10.00g干煤在1350℃以上的空气中充分燃烧,其中硫元素转化为SO2和少量的SO3(g),氯元素转化为HCl,产生的气体用适量的双氧水吸收,所得溶液稀释至 100.0mL,此溶液为H2SO4和HCl混合溶液,每次取10.00mL用0.1000mol·L-1NaOH溶液进行滴定,其原理为HCl + NaOH=NaCl+H2O和H2SO4 +2NaOH=Na2SO4 +2H2O,消耗NaOH体积为15.55ml,后的溶液加入适量的羟基氰化汞〔Hg(OH)CN〕发生NaCl+Hg(OH)CN==Hg(Cl)CN+NaOH,即使NaCl转化为NaOH后,再用H2SO4溶液滴定,耗H2SO4物质的量为1.25×10-5mol,其关系式为:2HCl~2NaCl~2NaOH~H2SO4 ;可求出混合溶液n(HCl)=2.5×10-5mol,消耗NaOH的n(NaOH)=2.5×10-5mol;与混合溶液中H2SO4反应消耗的n(NaOH)= 15.55×10-3 L×0.1mol/L -2.5×10-5 =1.53×10-2 mol; 由H2SO4~2NaOH可得,10ml混合液中n(H2SO4)=7.65×10-3 mol;即100ml混合液中n(H2SO4)=7.65×10-2 mol,根据硫元素守恒可解答此题。
易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
实验室制备乙酸乙酯(CH3COOCH2CH3)时有如下副反应:
2CH3CH2OH
CH3CH2OH
相关有机化合物的一些性质如下表:
(CH3COOC2H5在饱和盐溶液中溶解度较小,C2H5OH能与CaCl2生成配合物)
装置如图所示(加热、支撑等装置略去)。
在三口瓶内先装入10mL95%乙醇与6mL浓硫酸混合液,并加入几粒沸石。在恒压滴液漏斗中加入15mL冰醋酸与15mL无水乙醇的混合液。加热,由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。保持反应液体温度在120—125℃,收集馏分。
8.写出实验室制取乙酸乙酯的化学方程式 。
9.①加热三口瓶,最好的方法是 (填选项)。
A.水浴
B.酒精灯
C.油浴
D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是 。
10.产物提纯的流程如图:
①操作1的名称是 ,操作5的名称是 。
②加入饱和Na2CO3溶液的目的是为了除去 。
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是 。
④加入饱和CaCl2溶液的目的是为了除去 ,加入无水MgSO4的目的是为了除去水。
⑤乙酸乙酯的产率是 。
正确答案
CH3COOH+CH3CH2OH
解析
本题是实验室制备乙酸乙酯,其反应原理是:CH3COOH+CH3CH2OH

考查方向
解题思路
本题是实验室制备乙酸乙酯,其反应原理是:CH3COOH+CH3CH2OH
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
正确答案
① C
② 反应液体温度下降过快
(或不易控制反应液体温度或乙酸和乙醇还没反应就被蒸馏出来等)
解析
①为了使温度容易控制且加热均匀的控制在120—125℃,A.水浴加热控制的温度不能超过100℃,错误;B.酒精灯和D.酒精喷灯直接加热不能控制均匀加热;所以最好的方法是油浴,故答案为C;
②恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。其目是反应物的温度能够保持恒定,反应物的转化率(或者产物产率)更高,若滴加液体速度太快,反应液体温度易快速下降。故答案反应液体温度下降过快(或不易控制反应液体温度或乙酸和乙醇还没反应就被蒸馏出来等);
考查方向
解题思路
①为了使温度容易控制且加热均匀的控制在120—125℃,最好的方法是油浴,
②由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。其目有反应物的温度能够保持恒定,反应物的转化率(或者产物产率)更高。
纯净的CH3COOCH2CH3 ,乙酸乙酯的产率=
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
正确答案
① 分液 蒸馏
② 馏分中的酸性物质(或醋酸)
③ 防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗
④ CH3CH2OH
⑤ 80%
解析
根据题设可知馏分CH3COOCH2CH3 (含有乙醇、乙酸、C2H5OC2H5、水等)加入饱和Na2CO3 溶液,作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度。操作1(分液)可得水层1和有机层,
有机层再加入饱和NaCl溶液,作用是除去残留的Na2CO3 ,防止加入CaCl2生成CaCO3沉淀,堵塞分液漏斗,分液可得水层2和有机层,有机层再加入饱和CaCl2溶液(C2H5OH能与CaCl2生成配合物),作用是除去乙醇,有机层加无水MgSO4,作用是除水,最后进行操作5(蒸馏)可得纯净的CH3COOCH2CH3 ;
故答案为① 分液 蒸馏 ;② 馏分中的酸性物质(或醋酸);;③ 防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗;④ CH3CH2OH;⑤由题设可知n(CH3CH2OH)=
n(CH3COOH)=
乙酸乙酯的产率=
考查方向
解题思路
根据题设可知馏分CH3COOCH2CH3 (含有乙醇、乙酸、C2H5OC2H5、水等)加入饱和Na2CO3 溶液,作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,后分液可得水层1和有机层,有机层再加入饱和NaCl溶液,作用是除去残留的Na2CO3 ,分液可得水层2和有机层,有机层再加入饱和CaCl2溶液(C2H5OH能与CaCl2生成配合物),作用是除去乙醇,有机层加无水MgSO4,作用是除水,最后进行蒸馏可得纯净的CH3COOCH2CH3 ,乙酸乙酯的产率=
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
下图是工业上以天然气、空气为原料合成氨的一种工艺流程:
15.脱硫反应第一步是利用Fe(OH)3除去H2S,该反应的化学方程式是 。
常温下,Fe(OH)3在水中达到溶解平衡时,c(Fe3+)= mol·L-1。(已
知:Ksp[Fe(OH)3]=2.6×10-39)
16.脱硫反应第二步是利用空气氧化回收硫,该反应中氧化剂与还原剂的物质的量之比为 。下列试剂中也适宜作此反应的氧化剂的是 。
A.Cl2
B.H2O2
C.KMnO4
D.O3
17.流程中Fe(OH)3和K2CO3可循环利用,你认为流程中还可循环利用的物质有 (填化学式)。
18.合成氨反应的化学方程式为:
原料气中V(N2):V(H2)=1:3。平衡混合物中氨的含量与温度、压强的关系如图所示。A、B、C三点对应的化学平衡常数KA、KB、KC的关系是 (用“>”、“<”或“=”表示)。A点H2的平衡转化率为 。
19.工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,原因是 。
正确答案
3H2S+2 Fe(OH)3=Fe2S3 +6 H2O 2.6×10-18
解析
根据图信息脱硫反应第一步是利用Fe(OH)3与H2S反应生成Fe2S3 和H2O即:3H2S+2 Fe(OH)3=Fe2S3 +6 H2O; 常温下已知:Ksp[Fe(OH)3]=2.6×10-39 ,Fe(OH)3在水中达到溶解平衡时,其Fe(OH)3溶解平衡为Fe(OH)3(s) 


考查方向
解题思路
根据图信息脱硫反应第一步是利用Fe(OH)3与H2S反应生成Fe2S3 和H2O即:3H2S+2 Fe(OH)3=Fe2S3 +6 H2O; 常温下已知:Ksp[Fe(OH)3]=2.6×10-39 ,Fe(OH)3在水中达到溶解平衡时,其Fe(OH)3溶解平衡为Fe(OH)3(s) 

易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
3︰2 B D
解析
据图信息脱硫反应第二步是利用空气氧化回收硫反应方程式为:2Fe2S3 +3O2 +6H2O==6S + 4Fe(OH)3 ;可求出氧化剂与还原剂的物质的量之比;另选适宜试剂作此反应的氧化剂,原则是不引入新的杂质,因此可以是B.H2O2 和 D.O3
考查方向
解题思路
据图信息脱硫反应第二步是利用空气氧化回收硫反应方程式为:2Fe2S3 +3O2 +6H2O==6S + 4Fe(OH)3 ;可求出氧化剂与还原剂的物质的量之比等于计量数之比即为n(O2):n(Fe2S3)=3:2;另选适宜试剂作此反应的氧化剂,原则是不引入新的杂质,因此可以是B.H2O2 和 D.O3 故答案为BD
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
N2 和H2
解析
合成氨气的反应为可逆反应,不能完全转化;因此可循环使用。
考查方向
解题思路
合成氨气的反应为可逆反应,不能完全转化;因此可循环使用。故答案为:3:2 ;N2和H2
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
KA>KB =KC 66.7%
解析
合成氨反应N2 +3H2 
n%=V%= 
H2的转化率=

考查方向
解题思路
合成氨反应N2 +3H2 
应为放热反应,对于此反应平衡常数只与温度有关,B、C点温度相同,即KB =KC ,A点温度更低,平衡向正向进行,即KA>KB =KC,利用化学平衡的三步分析法。可求A点时:n%=50%
H2的转化率=
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
正确答案
能提高单位时间氨产量(或提高生产效率)
解析
工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,其原因为提高单位时间内氨气的生成速率,即提高生产效率,使生产效益最高。故答案为能提高单位时间氨产量(或提高生产效率)
考查方向
解题思路
工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,其原因为提高单位时间内氨气的生成速率,即提高生产效率,使生产效益最高。
易错点
溶解平衡常数的应用及计算、化学平衡常数的影响、氧化还原反应的计算;
[化学—有机化学基础]
化合物F、I是制备香料的重要物质。
合成F路线:
合成I路线:
已知:
①核磁共振氢谱显示,A中只有一种氢,芳香族化合物G中有四种氢且个数比为
1︰2︰2︰3。
②R—CH=CH2
③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
20.A 的名称是________________,D所含的官能团是______________。
21.C的结构简式为_____________。
22.A→B的反应类型为_____________,G→H的反应类型为_____________。
23.分子式为C8H10O且与G互为同系物的同分异构体有_____________种,写出其中一种的结构简式_____________。
24.写出由H→I的第一步反应的化学方程式__________________________。
25.设计一个以甲苯为原料制备苯甲酸的合成路线_____________。
正确答案
2-氯-2-甲基丙烷 羟基(或-OH)
解析
核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



A为(CH3)3CCl,A 的名称是 2-氯-2-甲基丙烷,D为(CH3)2CHCH2OH,D所含的官能团是羟基(或-OH),故答案为:2-氯-2-甲基丙烷;羟基(或-OH);
考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
解析
根据上面的分析可知,C为

考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
消去反应 取代反应
解析
根据上面的分析可知,A→B的反应类型为 消去反应,G→H的反应类型为 取代反应,
故答案为:消去反应;取代反应;
考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
9
解析
G为


考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
解析
由H→I的第一步反应的化学方程式为



考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
解析
以甲苯为原料制备苯甲酸,可以用甲苯与氯气发生取代生成二氯甲苯,再碱性水解可得苯甲醛,苯甲醛氧化可得苯甲酸,合成路线为
,故答案为:
考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。