- 真题试卷
- 模拟试卷
- 预测试卷
14.一定条件下存在反应:H2(g)十I2(g)
正确答案
解析
A.容器甲从正反应方向开始,开始时正反应速率最大,容器乙从逆反应方向开始,开始时正反应速率最小,是0,所以A错误;
B.温度不同,平衡常数不相同,由于反应是在恒容绝热的环境中进行,当反应达到平衡时容器甲、乙中温度不等,二者的反应的平衡常数就不相同,所以B错误;
C.该反应的正反应是放热反应,随着反应的进行,反应容器的温度升高,由于升高温度,平衡向吸热的逆反应方向移动,而容器乙是从逆反应方向开始,随着反应的进行,容器内的温度逐渐降低,根据平衡移动原理:降低温度,平衡向放热的正反应方向移动,因此容器甲中的I2气体的物质的量比容器乙高,所以混合气体的颜色比容器乙中的气体颜色深,所以C正确;
D.在温度不变时反应从正反应方向开始与从逆反应方向开始,物质的转化率的和为1,由于反应恒容绝热,所以容器甲中H2的转化率比恒温时小,容器乙中HI的转化率也比恒温是小,因此二者之和小于1,所以D错误。
考查方向
解题思路
A.容器甲从正反应方向开始,开始时正反应速率最大,容器乙从逆反应方向开始,开始时正反应速率是0;
B.由于反应是在恒容绝热的环境中进行,当反应达到平衡时容器甲、乙中温度不等,二者的反应的平衡常数就不相同;
C.该反应的正反应是放热反应,随着反应的进行,反应容器甲的温度升高,由于升高温度,平衡向吸热的逆反应方向移动,而容器乙是从逆反应方向开始,随着反应的进行,容器内的温度逐渐降低,根据平衡移动原理:降低温度,平衡向放热的正反应方向移动,因此容器甲中的I2气体的物质的量比容器乙高,所以混合气体的颜色比容器乙中的气体颜色深;
D.在温度不变时反应从正反应方向开始与从逆反应方向开始,物质的转化率的和为1,由于反应恒容绝热,所以容器甲中H2的转化率比恒温时小,容器乙中HI的转化率也比恒温是小,因此二者之和小于1。
易错点
不能正确理解恒容绝热密闭容器在反应过程中对化学平衡的影响。
知识点
16.利用电导率传感器可绘制电导率曲线图,下图为用0.1 mol·L-1NaOH溶液滴定10 mL,0.1 mol·L-1盐酸过程中的电导率曲线。下列说法错误的是
正确答案
解析
HCl和NaOH反应方程式为HCl+NaOH=NaCl+H2O,根据图象知,从0﹣10mL之间,随着反应的进行,溶液中c(H+)浓度逐渐减小,溶液的电导率逐渐降低,加入溶液体积大于15mL时,溶液中氢氧根离子浓度逐渐增大,溶液的电导率增大,根据图知当恰好中和时电导率最小,所以可以电导率传感器能用于酸碱中和滴定终点的判断,故A正确;B.溶液电导性与离子浓度成正比,a点离子浓度最大,故B正确;C.电导率与离子浓度成正比,c点电导率低是因为离子浓度小,c点是二者恰好完全反应生成NaCl,NaCl是强电解质,故C错误;D.任何电解质溶液中都存在电荷守恒、物料守恒,d点NaOH与HCl的体积之比为3:2,溶液中存在的离子为:Na+、H+、OH﹣、Cl﹣,根据电荷守恒得c(Na+)+c(H+)=c(Cl﹣)+c(OH﹣),故D正确;
考查方向
解题思路
A.HCl和NaOH反应方程式为HCl+NaOH=NaCl+H2O,根据图象知,从0﹣10mL之间,随着反应的进行,溶液中c(H+)浓度逐渐减小,溶液的电导率逐渐降低,加入溶液体积大于15mL时,溶液中氢氧根离子浓度逐渐增大,溶液的电导率增大,根据图知,当恰好中和时电导率最小;
B.溶液电导性与离子浓度成正比,a点离子浓度最大;
C.溶液电导率与离子浓度成正比,c点电导率低是因为离子浓度小;
D.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒及物料守恒判断;
易错点
易错选项是D,不能熟练判断反应实质、电导率的影响因素及混合溶液中溶质。
知识点
1.化学与人类生产、生活密切相关,下列有关说法错误的是
正确答案
解析
A.“海水淡化”即利用海水脱盐生产淡水,明矾可水解生成氢氧化铝胶体,具有吸附性,可除去水中的悬浮物而净化水,但不能不但不能除去海水中的氯离子、钙、镁离子等使海水淡化,故A错误;
B.福尔马林的主要成分是甲醛;甲醛可使使细胞中的蛋白凝固,失去活性,同时甲醛溶液可杀灭微生物(2%左右的甲醛溶液就可灭活绝大部分的病毒和细菌),杜绝微生物在动物标本上的繁殖,所以可以做到长时间的保存动物标本,故B正确;
C.体积分数为75%的酒精溶液常用于灭菌消毒,此浓度杀菌力最强。在75%的酒精作用下,乙醇能渗入细胞内,使蛋白质凝固变性,从而起到杀菌的作用,低于这个浓度,其渗透脱水作用减弱,杀菌力不强;而高于此浓度,则会使细菌表面蛋白质迅速脱水,凝固成膜,妨碍乙醇透入,削弱杀菌能力,故C正确;
D.烟花中添加了含钾、钠、钙、铜等金属元素,燃烧时焰色反应发出各种颜色的光,故D正确;
考查方向
解题思路
A、向海水中加入明矾可以使海水净化,但不能除去海水中的氯离子、钙、镁离子等,
B.福尔马林的主要成分是甲醛;甲醛可使使细胞中的蛋白凝固,失去活性,同时甲醛溶液可杀灭微生物(2%左右的甲醛溶液就可灭活绝大部分的病毒和细菌),杜绝微生物在动物标本上的繁殖,所以可以做到长时间的保存动物标本。
C.体积分数为75%的酒精溶液常用于灭菌消毒,此浓度杀菌力最强。在75%的酒精作用下,乙醇能渗入细胞内,使蛋白质凝固变性,从而起到杀菌的作用,低于这个浓度,其渗透脱水作用减弱,杀菌力不强;而高于此浓度,则会使细菌表面蛋白质迅速脱水,凝固成膜,妨碍乙醇透入,削弱杀菌能力。
D.金属元素在灼烧时会产生特色的颜色,所以可以根据焰色反应原理解答
易错点
A.不了解明矾净水的原理;
B.不了解福尔马林可用于浸制标本的原理;
C.不了解医用酒精消毒的原理;
D.不了解焰色反应的原理;
知识点
15.常温下,向10 mL 0.2 mol·L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
正确答案
解析
A.草酸氢钠溶液显酸性,这说明在草酸氢钠溶液HC2O4-的电离程度大于HC2O4-的水解程度,所以A不正确;
B.V(NaOH) = 10mL时,恰好反应生成草酸氢钠,在草酸氢钠溶液HC2O4-的电离程度大于HC2O4-的水解程度,水解溶液显碱性,所以对水的电离产生抑制作用,溶液中水的电离程度比纯水小,所以B不正确;
C.V(NaOH) =15mL时,溶液中的溶质为1:1的Na2C2O4和NaHC2O4,从图中信息可知,溶液呈酸性,溶液中c(H+)>c(OH-),所以C不正确;
D..V(NaOH) =20mL时,溶液中的溶质为Na2C2O4,溶液中存在质子守恒关系:c(OH-)=c(HC2O4-)
+2c(H2C2O4)+c(H+),所以D正确。
考查方向
解题思路
A.从图中信息可知草酸氢钠溶液显酸性,即草酸氢钠溶液HC2O4-的电离程度大于HC2O4-的水解程度;
B.V(NaOH) = 10mL时,恰好反应生成草酸氢钠,在草酸氢钠溶液HC2O4-的电离程度大于HC2O4-的水解程度,水解溶液显碱性,所以对水的电离产生抑制作用;
C.V(NaOH) =15mL时,溶液中的溶质为1:1的Na2C2O4和NaHC2O4,从图中信息可知,溶液呈酸性;
D..V(NaOH) =20mL时,溶液中的溶质为Na2C2O4,溶液中存在质子守恒。
易错点
不能准确提取图中信息,同时逻辑推理能力和创新思维能力不强,不能灵活应用几种守恒关系,即电荷守恒、物料守恒以及质子守恒。
知识点
2.NA为阿伏加德罗常数的值。下列说法正确的是
正确答案
解析
A.由于氮气与氢气合成氨的反应是可逆反应。所以在密闭容器中加入0.5moLN2和1.5moLH2,充分反应后容器中的N—H键数小于3NA,错误;
B.标准状况下, SO3分子的以固态形式存在,所以无法计算2.24L三氧化硫的物质的量,错误;
C.71 g氯气的物质的量是1mol,与足量铁反应是转移的电子应该以氯气来计算,得到的电子数一定为2NA,正确;
D.电解饱和食盐水时,当阴极产生H2 22.4L时,由于气体的条件没有指出,所以不能确定气体的物质的量的多少,因此也就不能指出电路中转移的电子数,错误。
考查方向
解题思路
A.由于氮气与氢气合成氨的反应是可逆反应。所以在密闭容器中加入0.5moLN2和1.5moLH2,充分反应后容器中的氨气小于1mol;
B.标准状况下, SO3分子的不以气态形式存在;
C.71 g氯气的物质的量是1mol,与足量铁反应是转移的电子应该以氯气来计算;
D.电解饱和食盐水时,当阴极产生H2 22.4L时,由于气体的条件没有指出,所以不能确定气体的物质的量的多少。
易错点
A.不了解可逆反应进行不彻底;
B.不了解标准状况下, SO3不是气体;
C.虽然铁过量,但是氯气只有1mol;
D.没有标准状况,22.4 L 无法确定其物质的量;
知识点
3.室温下,下列各组离子在指定溶液中一定不能大量共存的是
正确答案
解析
A.H+、Na+、SO42-、Cu2+之间不发生发反应,所以可以共存,A错误;
B.Kw/c(OH-)=1 mol·L-1的溶液为酸性溶液,CO32-在酸性溶液中不能共存,B正确;
C.NaHSO4溶液为酸性溶液,NO3-在酸性条件下和Fe3+都具有氧化性,在溶液中能大量共存,故C错误;
D.能使甲基橙显黄色的溶液可能呈酸性、中性或者碱性,Ca2+、Ba2+、Br-、C1-在酸性、中性或者碱性都不发生化学反应,可以共存,所以D错误。
考查方向
解题思路
A.H+、Na+、SO42-、Cu2+之间不发生发反应;
B.Kw/c(OH-)=1 mol·L-1的溶液为酸性溶液,
C.在0.1 mol·L-1NaHSO4溶液为酸性;
D.能使甲基橙显黄色的溶液可能呈酸性、中性或者碱性;
易错点
不能有效判断习题中的隐含信息,忽略离子之间的氧化还原反应。
知识点
4.能正确表示下列反应
正确答案
解析
A.亚铁离子和碘离子都具有还原性,向FeI2溶液中滴入过量溴水,亚铁离子和碘离子按比例关系都被氧化;所以反应的离子方程式应该为:2Fe2++4I-+3Br2=2Fe3++2I2+6Br-,A错误;
B.将Na2O2放入H2O中有氧气生成,所以所以反应的离子方程式应该为:2Na2O2+2H2O==4Na++4OH-+O2↑,B错误;
C.由于滴入少量Ba(OH)2溶液,所以Ba(OH)2溶液中离子要完全参加反应,所以所以反应的离子方程式应该为:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O,C错误;
D.稀盐酸与84消毒液混合后C1-与C1O-在酸性条件下发生氧化还原反应生成了C12;D 正确;
考查方向
解题思路
A.亚铁离子和碘离子都具有还原性,向FeI2溶液中滴入过量溴水,亚铁离子和碘离子按比例关系都被氧化;
B.将Na2O2放入H2O中有氧气生成;
C.由于滴入少量Ba(OH)2溶液,所以Ba(OH)2溶液中离子要完全参加反应;
D.稀盐酸与84消毒液混合后C1-与C1O-在酸性条件下发生氧化还原反应;
易错点
A.没有理解亚铁离子和碘离子都具有还原性,同时不注意亚铁离子和碘离子的比例关系;
B.没有掌握Na2O2与H2O反应的实质;
C.没有掌握“量的多少”与离子方程式的关系;
知识点
6.W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和为10,
正确答案
解析
W、X、Y、Z四种元素是原子序数依次增大的短周期元素,四种元素的电子层数之和等于10,如果W是第一周期元素,则X、Y、Z位于第三周期,且X的原子半径最大,符合题给信息,这四种元素分属于连续的四个主族,所以W是H元素、X是Mg元素、Y是Al元素、Z是Si元素;如果W是第二周期元素,则X为第二周期、Y和Z为第三周期元素才符合四种元素的电子层数之和等于10,但原子半径最大的元素是Y元素,不符合题意,故舍去;通过以上分析知,W是H元素、X是Mg元素、Y是Al元素、Z是Si元素,
A.W是H元素、X是Mg元素,Y是Al元素、Z是Si元素,W位于第一周期、X、Y、Z位于第三周期,故A错误;
B.W是H元素,是IA元素,而IA元素的元素的原子次外层电子数均为8,不可能为18素,故B正确;
C.Mg、Al、Si最高价氧化物对应的水化物之间均不能反应,故C错误;
D.工业上获得Mg单质的方法主要是电解其熔融的氯化镁,而获得Al单质的方法主要是电解其熔融的氧化铝,故D错误;
考查方向
解题思路
W、X、Y、Z四种元素是原子序数依次增大的短周期元素,四种元素的电子层数之和等于10,如果W是第一周期元素,则X、Y、Z位于第三周期,且X的原子半径最大,符合题给信息,这四种元素分属于连续的四个主族,所以W是H元素、X是Mg元素、Y是Al元素、Z是Si元素;如果W是第二周期元素,则X为第二周期、Y和Z为第三周期元素才符合四种元素的电子层数之和等于10,但原子半径最大的元素是Y元素,不符合题意,故舍去;通过以上分析知,W是H元素、X是Mg元素、Y是Al元素、Z是Si元素,
A.H元素位于第一周期,Mg、Al、Si位于第三周期;
B.W是H元素,是第一主族元素,而第一主族元素的原子次外层电子数均为8,不可能为18素;
C.Mg、Al、Si最高价氧化物对应的水化物之间均不能反应;
D.工业上获得Mg单质的方法主要是电解其熔融的氯化镁,而获得Al单质的方法主要是电解其熔融的氧化铝;
易错点
不能准确提取有关元素结构和性质的信息,不能准确把握元素周期律以及有关元素化合物的性质。
知识点
8.将铜和氧化铁的混和物溶于足量稀盐酸中,向所得溶液中滴入2滴KSCN溶液后出现红色。下列有关说法错误的是
正确答案
解析
将铜和氧化铁的混和物溶于足量稀盐酸中先发生如下反应:Fe2O3+6H+=2Fe3++3H2O。因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生反应:2Fe3++Cu=2Fe2++Cu2+,向所得溶液中滴入2滴KSCN溶液后出现红色,说明溶液中一定含有Fe3+
A.由于容器中溶液中一定含有Fe3+,所以一定不可能有固体残渣,A错误;
B.由于容器中溶液中一定含有Fe3+,所以反应2Fe3++Cu=2Fe2++Cu2+一定发生,且Cu一定被消耗完,所得溶液中一定存在Fe2+ ,B正确;
C.随着反应进行,盐酸的量逐渐减少,生成的Fe3+、Cu2+都有发生水解反应,促进水的电离,所以水的电离程度增大,C正确;
D再加入铜后,继续发生如下反应:2Fe3++Cu=2Fe2++Cu2+,Fe3+被消耗,所以溶液红色逐渐退去 ,D正确;
考查方向
解题思路
将铜和氧化铁的混和物溶于足量稀盐酸中先发生如下反应:Fe2O3+6H+=2Fe3++3H2O。因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生反应:2Fe3++Cu=2Fe2++Cu2+,向所得溶液中滴入2滴KSCN溶液后出现红色,说明溶液中一定含有Fe3+;
A.由于容器中溶液中一定含有Fe3+,所以一定不可能有固体残渣;
B.由于容器中溶液中一定含有Fe3+,所以反应2Fe3++Cu=2Fe2++Cu2+一定发生,所得溶液中一定存在Fe2+;
C.随着反应进行,盐酸的量逐渐减少,生成的Fe3+、Cu2+都有发生水解反应,促进水的电离,所以水的电离程度增大;
D.再加入铜后,继续发生如下反应:2Fe3++Cu=2Fe2++Cu2+,Fe3+被消耗,溶液红色逐渐退去;
易错点
不了解铜和氧化铁的混和物与足量稀盐酸中发生反应的先后次序,没有掌握Fe3+与Cu2+氧化性的强弱关系。
知识点
12.关于下列四幅图中相应实验的说法错误的是
正确答案
解析
A.Cu、Zn原电池中,活泼金属为负极,则根据检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性,故A正确;
B.析氢腐蚀生成氢气,气体增多,液面下降,而吸氧腐蚀中氧气得电子,气体减少,液面上升,所以是吸氧腐蚀,故B正确;
C.中和热测定应准确测定反应放出的热量,而热量的测定要准确测定反应前后的温度变化,而用环形铜棒,由于铜具有很强的导电性,所以会影响所测中和热的数值,故C错误;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D正确;
考查方向
解题思路
A.活泼金属为负极,检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性;B.析氢腐蚀生成氢气,气体增多,吸氧腐蚀中氧气得电子,气体减少,则根据试管中液面的升降可判断铁钉发生的是析氢腐蚀还是吸氧腐蚀;
C.中和热测定应准确测定反应放出的热量,而热量的测定要准确测定反应前后的温度变化;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,
易错点
选项C为解答的易错点,不能准确把握中和热测定的实质。
知识点
5.近年,科学家发现了116号元素Lv。下列关于293Lv和294Lv的说法错误的是
正确答案
解析
A.293Lv和294Lv都为116号元素,由于原子序数=核外电子数,所以两者电子数也均为116个,A错误。
B.293Lv的质量数为293,294Lv的质量数为294,两者质量数相差1,B正确;
C.293Lv的中子数为177,294Lv的中子数为178,两者中子数相差1,C正确;
D.293Lv和294Lv质子数相同,二者中子数不同,所以是不同的核素,互为同位素,D正确;
考查方向
解题思路
A.293Lv和294Lv都为116号元素,根据原子序数与核外电子数之间的关系判断出所以两者电子数也均为116个。
B.293Lv的质量数为293,294Lv的质量数为294,两者质量数相差1;
C.293Lv的中子数为177,294Lv的中子数为178,两者中子数相差1;
D.两者具有相同的质子数,但是中子数不同,互为同位素;
易错点
不清楚同位素的判断方法,没有掌握中子数、电子数、质量数之间的关系。
知识点
7.下列现象或事实不能用同一原理解释的是
正确答案
解析
A.氯化铵晶体加热分解产生氨气与HCl气体,碳酸氢铵晶体晶体加热分解产生CO2与NH3气体,发生的都是化学变化,所以A错误;
B.漂白粉和过氧化钠都可用于漂白有色织物,漂白原理都是氧化漂白。原理相同,所以B错误;
C.臭氧处理生活用水是利用了臭氧的强氧化性,酸亚铁都可用于处理生活用水是利用了Fe2+的氧化产物Fe3+水解吸附杂质的特性;原因不同,所以C正确;
D.向牛奶和豆浆中加入食醋都会出现絮凝物都是利用的胶体聚沉的特性,所以D错误;
考查方向
解题思路
A.氯化铵晶体加热分解产生氨气与HCl气体,碳酸氢铵晶体晶体加热分解产生CO2与NH3气体,发生的都是化学变化;
B.漂白粉和双氧水都可用于漂白有色织物,漂白原理都是氧化漂白;
C.臭氧处理生活用水是利用了臭氧的强氧化性,酸亚铁都可用于处理生活用水是利用了Fe2+的氧化产物Fe3+水解吸附杂质的特性;
D.向牛奶和豆浆中加入食醋都会出现絮凝物都是利用的胶体聚沉的特性。
易错点
不能准确掌握反应现象与原理之间的关系。
知识点
9.已知甲、乙、丙三种物质均含有同种元素X,其转化关系如下:下列说法错误的是
正确答案
解析
A.若甲是CO2,A是NaOH,NaOH不足量产生乙为NaHCO3,NaHCO3与NaOH反应产生Na2CO3,则丙是Na2CO3,故A说法正确;
B.若A为硝酸,则甲为铁,乙为硝酸亚铁,丙为硝酸铁,甲与丙反应可生成乙,故B说法错误;
C.若A为氧气,丙为红棕色气体NO2,则乙为NO气体,甲就为N2,故C说法正确;
D.若乙为NaHCO3,A为氢氧化钠,则甲为二氧化碳,丙可以为碳酸钠,故D说法正确;
考查方向
解题思路
A.若甲是CO2,A是NaOH,NaOH不足量产生乙为NaHCO3,NaHCO3与NaOH反应产生Na2CO3,则丙是Na2CO3;
B.若A为硝酸,则甲为铁,乙为硝酸亚铁,丙为硝酸铁带入验证;
C.若A为氧气,丙为红棕色气体NO2,则甲可能为非金属单质N2
D.若乙为NaHCO3,A为氢氧化钠,则甲为二氧化碳,丙可以为碳酸钠,带入验证
易错点
不能有效提取见物质的性质及相互转化的关系求解,
知识点
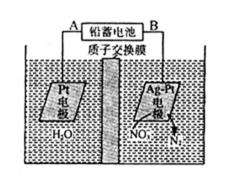
13.用电解法处理含硝(NO3-)废水的原理如图所示。下列说法错误的是
正确答案
解析
A.根据图示可知:在右边的Pt-Ag电极上NO3-得到电子被还原变为N2;所以该电极是阴极,与之连接的B是负极,A是正极。铅蓄电池的A极为正极,电极材料为PbO2,正确;B.铅蓄电池工作过程中负极发生反应:Pb-2e-+SO42-=PbSO4↓,所以负极质量增加,正确;C.该电解池的阴极反应为:2NO3-+ 6H2O + 10eˉ =N2↑ + 12OHˉ,正确;D.在阳极发生反应:2H2O-4e-=4H++O2↑;若电解过程中转移2moL电子,会消耗1mol的水,产生的2mol的H+进入阴极室,阳极质量减轻18g,在阴极室发生反应:2NO3-+ 6H2O + 10eˉ =N2↑ + 12OHˉ,若转移2mol的电子,会产生0.2mol的N2从溶液中逸出,同时有由2mol的H+进入该室,则阴极室实际减轻的质量是0.2mol×28g/mol-2g=3.6g,则两侧电解液的质量变化差(Δm右-Δm左)为18g-3.6g=14.4g,错误。
考查方向
解题思路
A.该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,连接阳极的电极为正极;B.铅蓄电池工作过程中负极为Pb失电子生成硫酸铅;C.阴极上硝酸根离子得电子发生还原反应;D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室;
易错点
易错点为D选项,注意氢离子还进入阴极室,若往只考虑析出的气体会导致错误,
知识点
某位同学在查阅资料时发现含氮化合物有以下性质:
①常温下NO2和N2O4混合存在,在低于0℃的过冷水中只有无色的N2O4液体或晶体存在;
②浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成。该同学在验证了“性质①”后又设计了如下装置验证“性质②”,同时测定某电器元件中铜银合金材料的含铜量。实验步骤如下:第一步 检验装置的气密性后加入相关药品;第二步 打开K1,通入氮气一段
回答下列问题:
26.实验前、后都需要打开K1,通入氮气一段时间。“第二步”中通入氮气是为了___________________________;“第四步”中通入氮气是为了____
27.“第三步”的目的是验证“性质②”并确保有害气体被完全吸收,请补全实验步骤并写出能证实“性质②”的预期现象:A中反应结束后,__________
28.实验结束后,通过测量确定装置A烧瓶中溶液的体积为100 mL,装置C增重3.22 g,装置E增重0.54 g(E中N元素均以NO3-的形式存在),不考虑硝酸的挥发与分解以及空气对试剂的影响,则实验所用铜银合金中铜的质量分数为_______(结果保留3位有效数字),实验后装置A烧瓶内溶液中硝酸的物质的量浓度为_______mol·L-1。
29.已知存在可逆反应:Ag+FeCl3

正确答案
排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置C或E吸收
解析
由于第二步要制取NO,而NO容易被氧气氧化;所以通入氮气的目的是为了排尽装置中的空气,防止生成的NO被氧化;反应结束后要使反应所产生的气体完全被吸收,所以在“第四步”中通入氮气是为了保证反应产生的气体完全被装置C或E吸收。故答案为:排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置C或E吸收。
考查方向
解题思路
由于第二步要制取NO,而NO容易被氧气氧化;所以通入氮气的目的是为了排尽装置中的空气,防止生成的NO被氧化;反应结束后要使反应所产生的气体完全被吸收,所以在“第四步”中通入氮气是为了保证反应产生的气体完全被装置C或E吸收。故答案为:排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置C或E吸收。
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
正确答案
打开K2,持续通入氧气,D中出现红棕色气体
解析
“第三步”的目的是验证浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成,并确保有害气体被完全吸收,要验证还有少量NO,就要让NO与O2反应,同时要吸收NO,必须让NO转变为NO2气体才能被碱液吸收,所以实验步骤为打开K2,持续通入氧气,D中出现红棕色气体。故答案为:打开K2,持续通入氧气,D中出现红棕色气体。
考查方向
解题思路
“第三步”的目的是验证浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成,并确保有害气体被完全吸收,要验证还有少量NO,就要让NO与O2反应,同时要吸收NO,必须让NO转变为NO2气体才能被碱液吸收,所以实验步骤为打开K2,持续通入氧气,D中出现红棕色气体。故答案为:打开K2,持续通入氧气,D中出现红棕色气体。
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
正确答案
22.9%;11.7
解析
【解析】装置C增重3.22 g,说明反应生成的N2O4质量为3.22 g,转移的电子为(3.22/92)×2=0.07mol,装置E中NO3-0.54 g,说明浓硝酸与铜、银还生成了NO,而且增加的质量根据反应关系4NO~O2可以知道反应生成了(0.54/38)mol NO,所以转移的电子为(0.54/38)×3=0.042mol,根据电子守恒可以得出如下关系:n(Cu)×2+n(Ag)×1=0.07+0.042。 再根据n(Cu)×64+n(Ag)×108=7,联立方程组求解得出铜银合金中铜的质量分数为22.9%,根据原子守恒,反应结束后实验后装置A烧瓶内溶液中剩余的硝酸为13.5×0.1-n(Cu)×2+n(Ag)×1-0.07+0.042=1.17mol,所以硝酸的物质的量浓度为1.17mol/(0.1L)=11.7mol·L-1。
故答案为:22.9%;11.7。
考查方向
解题思路
装置C增重3.22 g,说明反应生成的N2O4质量为3.22 g,转移的电子为(3.22/92)×2=0.07mol,装置E中NO3-0.54 g,说明浓硝酸与铜、银还生成了NO,而且增加的质量根据反应关系4NO~O2可以知道反应生成了(0.54/38)mol NO,所以转移的电子为(0.54/38)×3=0.042mol,根据电子守恒可以得出如下关系:n(Cu)×2+n(Ag)×1=0.07+0.042。 再根据n(Cu)×64+n(Ag)×108=7,联立方程组求解得出铜银合金中铜的质量分数为22.9%,根据原子守恒,反应结束后实验后装置A烧瓶内溶液中剩余的硝酸为13.5×0.1-n(Cu)×2+n(Ag)×1-0.07+0.042=1.17mol,所以硝酸的物质的量浓度为1.17mol/(0.1L)=11.7mol·L-1。
故答案为:22.9%;11.7。
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
正确答案
反应中产生沉淀的质量
解析
根据反应Ag+FeCl3
考查方向
解题思路
根据反应Ag+FeCl3
易错点
不能全面、正确理解实验目的,对实验基本操作把握准确。
17.分类法是研究物质的一种重要方法。现有以下4种物质:①氯气、②氢氧化钠、③氯化铝、④氧化钙,其中属于电解质的是_______(填序号,下同),属于离子化合物的是_________,溶于水的过程中能与水发生化学反应的是__________。
正确答案
②③④;②④;①③④
解析
①氯气是单质不是电解质,溶于水发生如下反应Cl2+H2O=HCl+HClO:不是离子化合物;
②熔融的氢氧化钠存在自由离子,是电解质能导电;溶于水只发生电离,不发生化学反应,是离子化合物;
③氯化铝溶于水发生电离不发生化学反应,有能够导电的离子,是电解质,是离子化合物;
④熔的氧化钙存在融自由离子,是电解质能导电,溶于水发生如下反应CaO+H2O=Ca(OH)2;是离子化合物,
综上所述:属于电解质的是②③④;属于离子化合物的是②④;溶于水的过程中能与水发生化学反应的是①③④
故答案为:②③④;②④;①③④。
考查方向
解题思路
电解质是水溶液中或熔融状态下导电的化合物;离子化合物由阳离子和阴离子构成的化合物。
易错点
不能准确把握电解质、离子化合物的概念以及实质。
知识点
二氧化氯是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂。回答下列问题:
18.二氧化氯可溶于水,但常温下难以与水反应,加热时会发生反应生成等物质的量的次氯酸和氯气,同时放出氧气,该反应的化学方程式为_____________________________,产物之一次氯酸的电子式为_____________。二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,该反应的离子方程式为________________________________。
19.工业上可利用电解法制备二氧化氯,如图为以石墨作电极制备二氧化氯的过程,写出产生二氧化氯气体的电极反应式:____________________。可利用滴定法测定电解过程中产生的二氧化氯,其过程如下:在锥形瓶中加入足量用硫酸酸化的碘化钾溶液,将生成的二氧化氯通入锥形瓶中至完全吸收,再向锥形瓶中滴加几滴淀粉溶液,用0.1 mo1·L1硫代硫酸钠标准液进行滴定(I2+2S2O32-==2I-+S4O62-),共用去100.00 mL标准液。则电解过程中产生的气体折算为标准状况下的体积为________mL
正确答案
12ClO2 + 2H2O 

解析
根据二氧化氯与水反应生成次氯酸和氯气,同时放出氧气,可以先写出相应的反应物和生产物,然后根据化合价升降总数相等完成配平的第一步骤:ClO2每生成1mol的HClO 和Cl2,化合价总共降低11,而每生成一个氧气,化合价升高4,所以最小公倍数为44,再用观察法配平H2O的系数为2,所以该反应的化学方程式为12ClO2 + 2H2O 



考查方向
解题思路
根据二氧化氯与水反应生成次氯酸和氯气,同时放出氧气,可以先写出相应的反应物和生产物,然后根据化合价升降总数相等完成配平,再用观察法配平H2O的系数为2。产物次氯酸中氧元素为中心原子,根据化合价升降守恒的原则,生成1mol氯酸钠,化合价升了1,所以也要降低1,故应该生成+3价的亚氯酸。
易错点
不能有效提取相关信息书写陌生的方程式,不能通过电子守恒法进行氧化还原滴定的计算,最后在计算电解过程中产生的气体折算为标准状况下的体积时容易忽略H2的体积。
正确答案
Cl- + 2H2O – 5e- = ClO2↑+ 4H+;156.8
解析
以石墨作电极制备二氧化氯的过程就是将Cl-氧化为ClO2的过程,所以电极反应式为:Cl- + 2H2O – 5e- = ClO2↑+ 4H+。ClO2 有较强氧化性,把I- 氧化为I2 ,根据反应过程中电子得失可以得出三者关系:2ClO2 ~5I2~10S2O32-n(ClO2)=0.2n(S2O32-)=0.2×0.01=0.002mol。根据电解过程中的电子守恒可以知道,再阳极每生成1molClO2,同时在阴极要生成2.5molH2。则电解过程中产生的气体折算为标准状况下的体积为(0.002+0.005)×22400=156.8 mL故答案为:Cl- + 2H2O – 5e- = ClO2↑+ 4H+;156.8。
考查方向
解题思路
以石墨作电极制备二氧化氯的过程就是将Cl-氧化为ClO2的过程;ClO2 有较强氧化性,把I- 氧化为I2 ,根据反应过程中电子得失可以得出三者关系:再根据电解过程中的电子守恒确定阴极产生的H2。电解过程中产生的气体折算为标准状况下的体积ClO2与H2的总和。
易错点
不能有效提取相关信息书写陌生的方程式,不能通过电子守恒法进行氧化还原滴定的计算,最后在计算电解过程中产生的气体折算为标准状况下的体积时容易忽略H2的体积。
盐酸、醋酸和氨水是中学化学中常见的三种物质。某校实验小组利用浓盐酸、冰醋酸和浓氨水分别配制了浓度均为0.1 mol·L-1的三种溶液各100 mL并进行相关实验。
据此回答下列问题:
20.配制上述三种溶液的过程中会用到的玻璃仪器有量筒、烧杯、玻璃棒,以及_______________。
21.25℃时,利用pH试纸测得0.1 mol·L-l醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10 mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中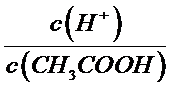
22.将浓度均为0.1 mo1·L-1的盐酸和氨水等体积混合,所得混合溶液中所有离子的物质的量浓度由大到小的顺序为:________;25℃时,用pH计测得此混合溶液的pH为a,则混合溶液中c(NH4+)=____mo1·L-1(用含a的代数式表示,混合过程中溶液体积的微小变化忽略不计)。
正确答案
胶头滴管、10
解析
用浓配制稀溶液溶液的过程中会用到的玻璃仪器可以通过实验步骤确定,所以还需要的玻璃仪器有胶头滴管、10

考查方向
解题思路
用浓配制稀溶液溶液的过程中会用到的玻璃仪器可以通过实验步骤确定。
易错点
没有近似处理意识,不能确定电离后溶液中的溶液中醋酸溶液的浓度仍然为0.1 mol·L-l;醋酸溶液的浓度增大,虽然电离平衡要正向移动,但是醋酸的电离程度要减小。
正确答案
胶头滴管、10
解析

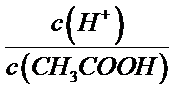
考查方向
解题思路
0.1 mol·L-l醋酸溶液的pH约为3,即溶液中氢离子和醋酸根离子的浓度都为0.001mo1·L-1,由于电离的醋酸程度很小,所以可以认为电离以后溶液中醋酸溶液的浓度仍然为0.1 mol·L-l,再根据离常数K=[c(H+)×c(CH3COO-)]/c(CH3COOH)求解;向10 mL此溶液中加入少量冰醋酸,相当于增大了醋酸溶液的浓度,醋酸的电离程度减小。
易错点
没有近似处理意识,不能确定电离后溶液中的溶液中醋酸溶液的浓度仍然为0.1 mol·L-l;醋酸溶液的浓度增大,虽然电离平衡要正向移动,但是醋酸的电离程度要减小。
正确答案
c(Cl-)> c(NH4+)> c(H+)> c(OH-);0.05+10a-14-10-a
解析
将浓度均为0.1 mo1·L-1的盐酸和氨水等体积混合,盐酸和氨水恰好完全反应,所得混合溶液中的溶质为NH4Cl,溶液因为NH4+水解呈酸性,所以离子的物质的量浓度由大到小的顺序为c(Cl-)> c(NH4+)> c(H+)> c(OH-);此混合溶液的pH为a,则混合溶液中c(H+)=10-a ,c(OH-)10a-14。根据电荷守恒: c(NH4+)+ c(H+)= c(OH-)+c(Cl-),所以c(NH4+)=c(Cl-)+c(OH-)+c(H+),由于盐酸和氨水等体积混合,所以溶液中c(Cl-)为混合前的1/2, 即为0.05 mo1·L-1。所以混合溶液中c(NH4+)=0.05+10a-14-10-amo1·L-1。
故答案为:c(Cl-)> c(NH4+)> c(H+)> c(OH-);0.05+10a-14-10-a
考查方向
解题思路
将浓度均为0.1 mo1·L-1的盐酸和氨水等体积混合所得混合溶液中的溶质为NH4Cl,溶液呈酸性;混合溶液的pH为a,则混合溶液中c(H+)=10-a ,c(OH-)10a-14。根据电荷守恒求解。
易错点
没有近似处理意识,不能确定电离后溶液中的溶液中醋酸溶液的浓度仍然为0.1 mol·L-l;醋酸溶液的浓度增大,虽然电离平衡要正向移动,但是醋酸的电离程度要减小。
氨是化肥工业和基本有机化工的主要原料,合成氨工业因此成为基本无机化工之一。回答下列问题:
23.如何获得廉价的氢气是合成氨工业中的重要课题,目前常用戊烷跟水蒸气反应的方法 获得氢气: C5H12(g)+5H2O(g) 
24.合成氨的反应原理为: 3H2(g)+N2(g) 
现有甲、乙、丙3个固定容积为2 L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表所示: 
①下列描述不能说明该反应已达到平衡状态的是_______.(填序号);容器内混合气体的密度保持不变 b.3v正(N2)==v逆(H2)c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20 min后达到平衡,这段时间内NH3的平均反应速率v(NH3)= _____mol·L-1·min-1,该温度下,反应的平衡常数K=_

25.在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是________。
正确答案
c-5a-11b
解析
根据能量变化图可以得出:
C5H12(g)+8O2(g) ==5CO2(g)+6H2O(g) △H= ckJ·mol-1
①H2O(g) ===1/2O2(g)+H2(g) △H= -bkJ·mol-1
②CO2(g) ===1/2O2(g)+CO(g) △H= -akJ·mol-1
③根据盖斯定律,①+②×11+③×5得出 C5H12(g)+5H2O(g) 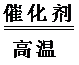
考查方向
解题思路
根据能量变化图可以得出:相关的热方程式,然后根据盖斯定律求解;
易错点
无
正确答案
①a ②0.05;5.33 ③ac
解析
①a 气体的体积不变,质量守恒,所以密度始终不变,不能根密度不再变化来判断平衡状态,故a错误; b.当3v正(N2)==v逆(H2)时,说明单位时间内消耗的N2与单位时间内生成的N2量相等,故达到了平衡状态,b正确;c.该反应是一个反应前后气体物质的量发生变化的化学反应,由于反应前后质量守恒,所以容器内混合气体的平均相对分子质量保持不变,就达到了平衡状态。故答案为a。
②乙容器中的反应在20 min后达到平衡时,消耗的N2为4-2×1.5=1mol,所以这段时间内N2的平均反应速率v(N2)= [1mol/(2L) ]/(20min)=1/40 mol·L-1·min-1,所以v(NH3)=2v(N2) =0.05_mol·L-1·min-1,平衡时c(N2)=1.5 mol·L-1 ,c(H2)=0.5 mol·L-1,c(NH3)=1 mol·L-1,所以该温度下,反应的平衡常数K=c2(NH3)/[c(N2) × c3(H2)]=5.33L2·mol-2,所以答案为:0.05;5.33
③a由等效平衡可知,若丙中2molNH3完全转化为N2和H2,则有1molN2和3molH2,由于甲中只有2molN2,所以反应达到平衡时消耗的N2更少,所以cl>c3,所以a正确;b.甲与乙为恒压条件下的等效平衡,此时两个容器中N2的体积分数相等,当在衡容条件下,相当于给容器乙加压,所以乙中平衡正向移动,故w2<w1 所以b错误; c.容器体积相同,乙中含有4molN2和4molH2,质量最大,丙中含有2molNH3,质量最小,密度大小关系为: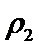
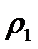
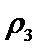
故答案:ac。
考查方向
解题思路
①a 气体的体积不变,质量守恒,所以密度始终不发生变化变;b.当3v正(N2)==v逆(H2)时,说明单位时间内消耗的N2与单位时间内生成的N2量相等;c.该反应是一个反应前后气体物质的量发生变化的化学反应,由于反应前后质量守恒,所以容器内混合气体的平均相对分子质量保持不变,就达到了平衡状态。
②根据乙容器中的反应在20 min后达到平衡时N2的浓度变化量求解出平均反应速率v(N2),再根据v(NH3)=2v(N2) 求解;根据平衡时c(N2)、c(H2)、c(NH3)求解该温度下反应的平衡常数K=c2(NH3)/[c(N2) × c3(H2)] ; ③a由等效平衡进行判断;b.甲与乙为恒压条件下的等效平衡,然后将容器乙加压,根据乙中平衡移动判断;c.容器体积相同,根据容器中气体质量判断密度大小。
易错点
(2)中等效平衡的实质理解不透导致解题错误。
正确答案
将产物混合气中的氨冷却分离后,剩余气体循环使用
解析
(3)在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要可以通过将产物混合气中的氨冷却分离后以减小生成物的浓度,使得平衡正向移动,提高反应物的利用率,同时通过剩余气体循环使用提高反应物的利用率,故答案为将产物混合气中的氨冷却分离后,剩余气体循环使用。
考查方向
解题思路
为了提高反应物的利用率,除考虑温度、压强和使用催化剂外,还要可以通过将产物混合气中的氨冷却分离后以减小生成物的浓度,使得平衡正向移动,提高反应物的利用率,同时通过剩余气体循环使用提高反应物的利用率。
易错点
无
10.利用表中提供的仪器和药品,能达到相应实验目的的是
正确答案
D
解析
A、氢氧化铁胶体的制备需要将饱和氯化铁溶液加入沸水中;所以需要酒精灯加热,所以A错误;
B、干燥的二氧化碳气体在水中溶解度较小,不能形成喷泉,所以B错误;
C、氢氧化钠溶液浓度的测定过程中要量取氢氧化钠溶液的体积,终点的判断需要指示剂,缺少指示剂和碱式滴定管,所以C错误;
D、蒸发溶液得到氯化钠晶体要在蒸发皿中进行,要用蒸发皿,蒸发皿可以直接加热,不需要垫石棉网,所以D正确。
考查方向
解题思路
A、氢氧化铁胶体的制备需要将饱和氯化铁溶液加入沸水中;
B、干燥的二氧化碳气体在水中溶解度较小,不能形成喷泉;
C、氢氧化钠溶液浓度的测定过程中要量取氢氧化钠溶液的体积,终点的判断需要指示剂,缺少指示剂和锥形瓶、碱式滴定管,不能作滴定实验,错误;
D、蒸发溶液得到氯化钠晶体要在蒸发皿中进行,要用蒸发皿,蒸发皿可以直接加热,不需要垫石棉网,
易错点
选项C为易错点,注意操作的可行性、评价性分析。
知识点
11.根据下列实验操作和现象所得出的结论错误的是
正确答案
B
解析
A.将浓硫酸滴到蔗糖表面,固体变黑膨胀,浓硫酸具有脱水性使蔗糖脱水生成碳变黑,碳和浓硫酸反应生成二氧化碳和二氧化硫气体表现浓硫酸的氧化性,故A正确;
B.试管里出现凝胶,说明生成硅酸,根据强酸制备弱酸的原理可知酸性:盐酸>硅酸,但是要根据最高价氧化物对应的水化物的酸性强弱才能判断非金属性的强弱。所以盐酸>硅酸不能判断出非金属性氯>硅,所以B错误;
C.向盛有浓硝酸试管中加入铜片,试管产生大量红棕色,说明发生了氧化还原反应,体现了小时的酸性,同时又硝酸铜产生,体现了硝酸的酸性,故C正确;
D.物质越难溶,反应产生沉淀所需要的离子的浓度就越小,就越先反应得到沉淀。Br-+Ag+=AgBr↓;AgBr是淡黄色沉淀,I-+Ag+=AgI↓,AgI是黄色沉淀。向等浓度的KBr、KI混合液中滴加AgNO3溶液,先出现黄色沉淀说明先发生反应I-+Ag+=AgI↓。因此Ksp(AgBr)>Ksp(AgI),故D正确。
考查方向
解题思路
A.将浓硫酸滴到蔗糖表面,固体变黑膨胀,浓硫酸具有脱水性使蔗糖脱水生成碳变黑,碳和浓硫酸反应生成二氧化碳和二氧化硫气体表现浓硫酸的氧化性;
B.试管里出现凝胶,说明生成硅酸,根据强酸制备弱酸的原理可知酸性:盐酸>硅酸,但是要根据最高价氧化物对应的水化物的酸性强弱才能判断非金属性的强弱;
C.向盛有浓硝酸试管中加入铜片,试管产生大量红棕色,说明发生了氧化还原反应,体现了小时的酸性,同时又硝酸铜产生,体现了硝酸的酸性;
D.物质越难溶,反应产生沉淀所需要的离子的浓度就越小,就越先反应得到沉淀。Br-+Ag+=AgBr↓;AgBr是淡黄色沉淀,I-+Ag+=AgI↓,AgI是黄色沉淀。向等浓度的KBr、KI混合液中滴加AgNO3溶液,先出现黄色沉淀说明先发生反应I-+Ag+=AgI↓。因此Ksp(AgBr)>Ksp(AgI)。
易错点
B选项易错,注意要根据最高价氧化物对应的水化物的酸性强弱才能判断非金属性的强弱。