- 真题试卷
- 模拟试卷
- 预测试卷
1.生活是化学的源泉,下列有关叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
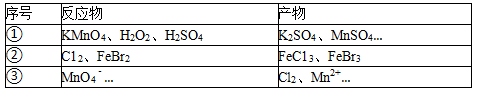
3.根据表中信息判断,下列选项正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.组成和结构可用
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.将BaO2放入密闭真空容器中,反应2BaO2(s)═2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.两个学习小组用图装置探究乙二酸(HOOC﹣COOH)受热分解的部分产物.
(1)甲组:①按接口顺序:a﹣b﹣c﹣d﹣e﹣f﹣g﹣h连接装置进行实验.B中溶液变浑浊,证明分解产物有__________;装置C的作用是_________;E中溶液变浑浊,D中的现象是 _________,证明分解产物有_________.
②乙二酸受热分解的化学方程式为_________
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为__________.
②从A﹣F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应.最简单的装置接口连接顺序是_________;实验后用F中的固体进行验证的方法是_____________________(可另选试剂).
正确答案
(1)CO2;充分除去CO2;溶液褪色或变浅; CO;
②乙二酸受热分解的化学方程式为:HOOC﹣COOH

(2)①2Na2O2+2CO2=2Na2CO3+O2;
②a﹣d﹣e﹣j;取F中的固体,滴加稀硫酸,将生成的气体通入澄清石灰水中,若变浑浊,则发生了反应;若不变浑浊,则未发生变化.
解析
解析已在路上飞奔,马上就到!
知识点
10.开发氢能是实现社会可持续发展的需要.硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2.
请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为 __________.
(2)该循环工艺过程的总反应方程式为 _____________.
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 _________________________.
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池.电池充放电时的总反应为:NiO(OH)+MH
①电池放电时,负极的电极反应式为 _______________.
②充电完成时,Ni(OH)2全部转化为NiO(OH).若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为 ______________.
正确答案
(1)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=﹣3408 kJ•mol﹣1;
(2)SO2+2H2O=H2SO4+H2;
(3)有利于平衡向右移动,有利于碘和氢气的生成;
(4)①MH﹣e﹣+OH﹣=H2O+M;
②O2+2H2O+4e﹣=4OH﹣.
解析
解析已在路上飞奔,马上就到!
知识点
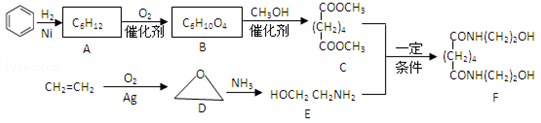
11.有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
(1)B的结构简式是__________;E中含有的官能团名称是___________.
(2)由C和E合成F的化学方程式是__________
(3)同时满足下列条件的苯的同分异构体的结构简式是__________.
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰 ③不存在甲基
(4)乙烯在实验室可由_______ (填有机物名称)通过______(填反应类型)制备
(5)下列说法正确的是________.
a.A属于饱和烃 b.D与乙醛的分子式相同 c.E不能与盐酸反应 d.F可以发生酯化反应
正确答案
(1)HOOC(CH2)4COOH,羟基和氨基;
(2)CH3OOC(CH2)4COOCH3+2HOCH2CH2NH2
(3)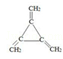
(4)乙烯在实验室可由乙醇通过消去反应制取,故答案为:乙醇,消去反应;
(5)abd.
解析
解析已在路上飞奔,马上就到!
知识点
9.环己酮是一种重要的化工原料,实验室常用下列方法制备
环己醇、环己酮和水的部分物理性质见下表:

(1)酸性Na2Cr2O7溶液氧化环己醇反应的△ H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55﹣60℃进行反应.反应完成后,加入适量水,蒸馏,收集95﹣100℃的馏分,得到主要的含环己酮和水的混合物.
①酸性Na2Cr2O7溶液的加料方式为_______.
②蒸馏不能分离环己酮和水的原因是__________.
(2)环己酮的提纯需要经过以下一系列的操作:a蒸馏,收集151﹣156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静
①上述操作的正确顺序是_______(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_________.
③在上述操作c中,加入NaCl固体的作用是___________.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有________种不同化学环境的氢原子.
正确答案
(1)
①缓慢滴加
②环已酮和水形成具有固定组成的混合物一起蒸出;
(2)
①c d b a
②漏斗、分液漏斗
③增加水层的密度,有利于分层;
(3)3
解析
解析已在路上飞奔,马上就到!