- 真题试卷
- 模拟试卷
- 预测试卷
8.某羧酸酯的分子式为C57H104O6,1mol该酯完全水解可得到1mol甘油
[HOCH2CH(OH)CH2OH]和3mol羧酸。该羧酸的分子式为
正确答案
解析
有机化学的化学式及化学方程式无法复制黏贴上去,要一个一个上传,能否直接粘贴上去
考查方向
考查有机物的合成与推断、官能团的结构与性质、有机反应类型、限制条件同分异构体书写
解题思路
(1)由D的结构简式可知,含有的含氧官能团为羧基、醚键;对比B、C结构可知,B与对甲基苯酚发生酯化反应,属于取代反应,甲基间位的C-H键断裂与碳碳双键发生加成反应形成六元环;
(2)由信息可知,对比苯甲醛与乙醛反应得到A为
(3)苯甲醛与银氨溶液反应氧化反应得到苯甲酸铵、Ag、氨气与水,反应方程式为

(4)B的一种同分异构体满足下列条件:①能使溴的CCl4溶液褪色,说明含有不饱和键,可以是碳碳
易错点
有机化学的化学式及化学方程式无法复制黏贴上去,要一个一个上传,能否直接粘贴上去
教师点评
有机化学的化学式及化学方程式无法复制黏贴上去,要一个一个上传,能否直接粘贴上去
知识点
11.下列实验操作、现象和结论均正确的是
正确答案
解析
A,蔗糖脱水,表现出浓硫酸的脱水性,而不是吸水性;
B,K+通过焰色反应检验,必须透过蓝色钴玻璃观察是否有紫色;
C,实验现象只能证明酸性:盐酸大于硅酸,但其中的氯元素并不是最高价,所以不能得出,氯的非金属性大于硅;
D,组成形式的沉淀物转化证明变成了更难溶的,能说明它的溶度积常数更小。
考查方向
浓硫酸的性质;焰色反应的具体操作;非金属性的比较;溶度积常数的理解。
解题思路
浓硫酸的吸水性表现为物理变化,而农硫酸的脱水性表现为化学变化。
Na+可以直接肉眼观察焰色现象,但是钾离子,必须透过蓝色钴玻璃。
非金属性,如果通过酸性来比较的话,必须是各元素的最高价氧化物,对应水化物,
易错点
浓硫酸的吸水性与脱水性;最高价氧化物对应水化物的酸性或碱性比较,往往会忽略掉最高价。
教师点评
本题整体难度不大,注意双基的练习。
知识点
9.能正确表示下列反应离子方程式的是:
正确答案
解析
A、Fe3O4中铁显+2与+3价,得到产物中还有FeCl2。B、HCO3-不能拆成H+与CO32-的形式。C、Al(OH)3不会溶于碳酸中,正确。D、"84"消毒液主要成份为NaClO,错误。
考查方向
离子反应方程式的书写
解题思路
离子方程式的正误判断,(1)先判断反应是否符合客观事实(2)分析电解质拆成离子的结果是否正确(3)检查是否原子守恒、电荷守恒、得失电子守恒(4)注意一些与量有关的离子反应方程式。
易错点
A项中忽略了Fe的二种价态,D项中84消毒液主要成份为NaClO
教师点评
解题时逐项分析,利用所学的离子方程式书写内容判断,从客观事实、拆解电解质、守恒、是否过量等多角度分析。
知识点
13.已知:2C(s)+O2(g)=2CO(g) ΔH=-217kJ·mol-1C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,则b为
正确答案
解析
①2C(s)+O2(g)=2CO(g) ΔH1=-217kJ·mol-1
②C(s)+H2O(g)=CO(g)+H2(g) ΔH2=b kJ·mol-1
H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,
由②×2 - ①得:
③2H2O(g)=2H2(g)+O2(g) ΔH3=2ΔH2-ΔH1=(2b+217)kJ·mol-1
由【微观角度ΔH=E反应物总键能 - E生成物总键能】可知:
ΔH3=2b+217=4×462-(2×436+495),不难求出b值。
考查方向
热化学方程式的应用,盖斯定律的理解。
解题思路
又已知热化学方程式,推导出待求的热化学方程式,由给出的焓变,通过盖斯定律可以推导出来。ΔH有两种算法:
(1)宏观角度ΔH=E生成物 - E反应物;
(2)微观角度ΔH=E反应物总键能 - E生成物总键能。
易错点
微观角度求焓变时,反应物与生成物键能弄反了,或者化学键的个数计算错误。
教师点评
ΔH=E反应物总键能 - E生成物总键能有同学记不住这个公式。
知识点
10.五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
正确答案
解析
A选项,非金属性N元素大于C元素,所以该项错误;B选项,磷化氢稳定性弱于硫化氢,该选项错误;C选项,光导纤维的主要成分是二氧化硅,而Z是铝元素,所以该选项错误;D选项,硝酸的酸性大于碳酸,该选项是正确的。
考查方向
元素周期律和元素周期表
解题思路
根据题意分析可知元素X、Y、Z、M、R分别为C、N、Al、P、S,再结合元素周期律解决四个选项即可。
易错点
本题容易出现元素周期律的记忆错误。
知识点
7.化学
正确答案
知识点
12.下列有关电解质溶液的说法正确的是
正确答案
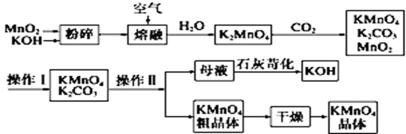
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
请回答下列问题:
14.该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 。
15.KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是
(填字母).a.75%酒精 b.双氧水 c.苯酚 d. 84消毒液(NaClO溶液)
16.写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式: 。
17.上述流程中可以循环使用的物质有 、 (写化学式).
18.测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点。写出该反应的离子方程式: 。
19.已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2)= ___________________。
20.操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在溶解性上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.
正确答案
(1) CaCO3+2HCl = CaCl2 + CO2 ↑+H2O
解析
制二氧化碳,实验室常用碳酸钙与稀盐酸反应
考查方向
常见气体的制备原理
解题思路
熟练掌握中学化学中几种常见气体的制备
易错点
容易写成碳酸钙与稀硫酸的反应,应生成的硫酸钙是微溶性物质
教师点评
本空较简单,只要掌握几种重要气体的制备原理,便可轻松做答。
正确答案
(2)b d
易错点
②滴定法测定原理。
正确答案
(3)2MnO2+4KOH+O2=2K2MnO4+2H2O
正确答案
(4)KOH、MnO2
正确答案
(5)2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
正确答案
(6)2.0×10-15mol/L
易错点
6、结晶与重结晶的实验操作
正确答案
(7)过滤,溶解后蒸发浓缩
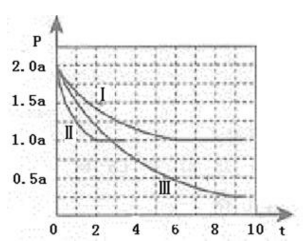
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。Ⅰ、一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)⇌CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
21.Ⅱ和Ⅰ相比,改变的反应条件是 .
22.反应Ⅰ在6min时达到平衡,在此
23.反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)= .
24.比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是 .Ⅱ、甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
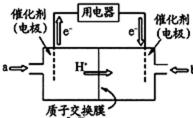
25.甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:通入a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
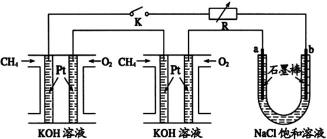
26.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。
正确答案
(1)加入催化剂
正确答案
(2)0.125mol/(L· min)
正确答案
(3)12
正确答案
(4)>、 Ⅰ和Ⅲ相比,Ⅲ平衡时的体系压强更低,说明平衡向正反应方向,△H<0,只有降低温度才能达到要求,故Ⅲ时温度更低。
正确答案
(5)负、CH3OH – 6e- + H2O = CO2 + 6H+
正确答案
(6)1.544×104C 、13.3
己二酸 
可能用到的有关数据如下:
实验步骤如下;I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。V、粗产品经提纯后称重为5.7g。请回答下列问题:
27.仪器b的名称为__________。
28.向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:_________________________________________________________________。
29.已知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_____________________________、________________________________。
30.为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
31.粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
正确答案
(1)球形冷凝管(或冷凝管)
解析
看清字母标注的是什么仪器,直接做答。
考查方向
化学常见仪器的识别
解题思路
熟悉中学化学实验中常见的仪器,对仪器的名称、用途、使用注意事项都要烂熟于胸。
易错点
难度不大,但易写错字
教师点评
本小问较易,学生看清标,对仪器名称正确书写
正确答案
(2)反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中。
解析
由题干信息可知,反应过程会放出大量的热,引起反应液暴沸引起事故,再由化学方程式得知反应过程中会生成有毒的NO2气体,反应过快不利于碱液对尾气的吸收。
考查方向
实验操作及评价
解题思路
由题干信息及反应产物可知,反应过程会放出大量的热,引起反应液暴沸引起事故,再是反应会生成有毒的NO2气体,反应过快不利于碱液的吸收。
易错点
题干信息把握不准或回答不完整。
正确答案
(3) 2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
解析
由已知的二个反应得知,NO2与碱反应时充当氧化剂与还原剂,一部分价态升高,一部分价态降低,因此NO2与碳酸钠反应得到硝酸钠与亚硝酸钠,利用得失电子守恒与质量守恒进行配平,书写正确的化学方程式。
考查方向
化学反应方程式的书写
解题思路
根据已知的二个反应得知,NO2与碱反应时充当氧化剂与还原剂,一部分价态升高,一部分价态降低,因此NO2与碳酸反应也是如此。
易错点
不知掌握NO2与碱反应的实质,不明白NO2在反应中既作氧化剂又做还原剂。
正确答案
(4) 苯
正确答案
(5)重结晶 75%