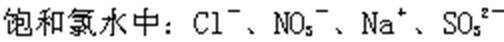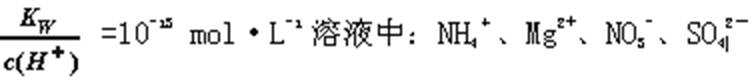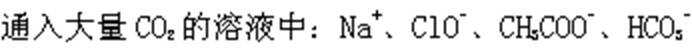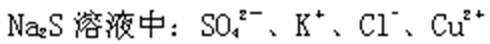- 真题试卷
- 模拟试卷
- 预测试卷
3.下列离子反应方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.室温条件下进行下列各组实验,其中的观察要点不能说明醋酸是弱电解质的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.下列与金属腐蚀有关的说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.NA 为阿伏加德罗常数,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4. 室温下,下列各组离子在指定溶液中能大量共存的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列四个常用电化学装置的叙述中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
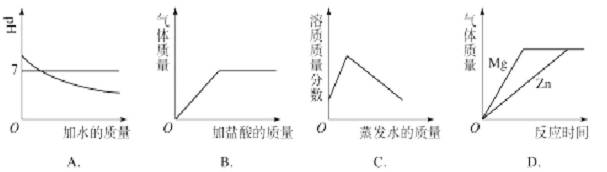
7.下列所示的图像能反映相对应实验的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.某小组在研究前1 8 号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成图①所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P 点代表氢元素。
(1)K 元素在常规周期表中的位置__________(填周期和族)。
(2)写出M 与Z 两种元素形成的化合物的电子式_________。
(3)下列说法正确的是________。
a.Y 元素对应的氢化物比K 元素对应的氢化物更稳定
b.虚线相连的元素处于同一族
c.K、L、X 三种元素的离子半径大小顺序是X3->L+>K2-
d.由K、L 两种元素组成化合物中可能含有非极性共价键
(4)图②装置可以模拟钢铁的腐蚀碳棒一极的电极反应式是_______。若在
图②溶液中滴加少量酚酞溶液并进行电解,发现Fe 电极附近溶液变红,清写出
碳棒一极的电极反应式________。牺牲阳极的阴极保护法利用
的原理是_______(填“电解池”或“原电池”)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
选做题:从3道化学题中任选一道作答。
11.【化学——选修2:化学与技术】
煤是一种重要的化石能源。请回答:
(1)煤的加工包括干馏、_________和液化,煤的液化技术又分为_________和_________。
(2)干熄焦技术是将炼焦炉推出的约l000
(3)某工厂每天要烧掉含硫1.6%的烟煤200吨,排放出大量的SO2,如果将这些SO2回收利用,那么理论上每年(按365天计)可生产98%的浓硫酸_________吨。
(4)石膏法脱硫是烟气脱硫技术中最成熟的一种方法,工艺如右图,
(5)煤燃烧产生的CO2在光能和光催化剂存在的条件下可与H2O(g)转化为CH4和O2,反应的化学;方程式为_________。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(I、Ⅱ)作用下,CH4产量随光照时间的变化如右图所示,
12.【化学---选修3:物质结构与性质】
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G 外,其他五种元素都是短周期元素。X、Y、E 三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分。取F 的化合物做焰色反应实验,其焰色呈黄色,G 的单质是生活中常见的一种金属,GE 是黑色固体。G2E 是红色固体。请回答下列问题:
(1)写出基态G 原子电子排布式:_________;Y、Z、E、F、G 的第一电离能由小到大的顺序为_________ (用元素符号表示)。
(2)X、Y、Z 形成3 原子分子M,每个原子价层电子均达到稳定结构。M 分子的结构式为_________。1molM 含
(3)根据价层电子对互斥理论(VESPR)推测:ZE2—的立体构型为________,YE32—的中心原子杂化类型为__________。
(4)Y、E、Z 分别与X 形成的简单化合物沸点由高到底的顺序为_________(用化学式表示)。 (5)G 晶胞结构如图所示。
13.【化学---选修5:有机化学基础】
几种有机物的转化关系如图所示。
信息1:烯烃的复分解反应机理可视为双键断裂,换位连接,如:
信息2:A 分子的所有碳原子一定共面且有顺反异构体,B 没有同分异构体。信息3:三元醇F 的分子式为C3H6O3,在核磁共振氢谱图中峰值比为4:2:1:1。
请回答下列问题:
(1)F 的结构简式为______,J 的名称是________。
(2)反应②和⑤的反应类型是________,反应⑧的条件是_______。
(3)A 的所有烯烃同分异构体(不包括A),通过烯烃复分解反应后,可形成( )种烯烃(不包括A 及其同分异构体)。
(4)反应①的化学方程式为______;反应⑥的化学方程式为________。
(5)有机物W 的分子式比1 分子多2 个“CH2”,能发生水解反应、银镜反应,W的结构简式可能是:______________ 。
正确答案
11.
12.
13.
解析
解析已在路上飞奔,马上就到!
知识点
10.氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要
的地位、工业制硝酸的主要反应之一是:
(1)如果将4mol NH3 和5mol O2 放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3 的转化率为_______。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO 的浓度与时间关系如图所示,则NO 的a、b、c 三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是__________。
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
①第2min 到第4min,反应速率v(O2)= _________;
②第2min 时改变了条件,改变的条件可能是 ______________(从所给选项中选择);
A.降低温度 B.增加了生成物
C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应___________(填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2 可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2 三者等物质的量反应的化学方程式为_________ 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9. SiO2、SO2 和CO2 都是酸性氧化物,它们的化学性质具有一定的相似性;Mg 和Na 的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg 与SO2 反应的实验。
(1)选择制取SO2 的合适试剂_______(填编号)。
(2)上述装置还可优化,优化的方法是____________,装置C 中NaOH 溶液的作用是_____。
(3)甲同学推测Mg 与









根据上述实验探究,能证明甲同学推测正确的操作和预期现象是________ 。
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用_______ (选填10 mL、25 mL、50 mL 或100 mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为_______mL。
9.SiO2、SO2 和CO2 都是酸性氧化物,它们的化学性质具有一定的相似性;Mg 和Na 的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg 与SO2 反应的实验。
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是 。(4)上述实验需要100mL,2mol/L 的HCl,配制时选用 (选填10 mL、25 mL、
50 mL 或100 mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为 mL。