- 真题试卷
- 模拟试卷
- 预测试卷
2.下列说法正确的是( )。
正确答案
解析
丁烷有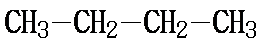

考查方向
解题思路
掌握同分异构体书写的方法、理解同系物的概念、活用判断反应自发性。
易错点
同分异构体的书写及自由能判据的运用。
知识点
5.下列叙述正确的是( )。
正确答案
解析
氯化铵是强酸弱碱盐,其水溶液显酸性,溶液呈中性一定是氨水稍过量,A错误。醋酸溶液中不断加水稀释,醋酸的电离程度增大,但是c(H+)在减小,PH在增大,B错误。因为是饱和石灰水,加入少量CaO后,c(OH-)没有改变,故PH也不变,C正确。胶体是电中性,D错误。
考查方向
解题思路
弱碱与强酸形成的盐,不能忽略其水解。
易错点
弱电解质的电离度与PH值之间的关系
知识点
1.下列说法不正确的是( )。
正确答案
解析
铝是一种活泼性很强的金属,其表面会形成致密的氧化物,起到了保护作用,A错误。乙醇与乙酸乙酯由于其价键的结构不同,利用红外光谱可以加以区分,B正确。金属的冶炼是将金属从其化合物中还原出来,因金属的活泼性不同冶炼的原理也不同,但多数金属是利用还原性物质在高温下将其从化合还原得到,C正确。塑料、合成橡胶和合成纤维是通常所说的三大合成材料,D正确。所以选A。
考查方向
解题思路
加强对一些化学基本概念的识记,学会用排除法选择正确答案。
易错点
基本概念模糊不能正确分辨
知识点
3.下列有关实验操作的说法正确的是( )。
正确答案
解析
KMnO4溶液具有强氧化性,应当用酸式滴定管量取,A错误。测PH时,试纸不能润试,否则会将所测的溶液稀释,引起误差,B错误。将钠研成粉末后与水反应更加剧烈,会引起事故,C错误。蒸馏时,液体不能过多,也不能太少,D正确。
考查方向
解题思路
学习过程中加强对化学常用仪器的操作使用注意事项的复习。
易错点
化学仪器的使用注意事项
知识点
4.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示。已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )。
正确答案
解析
由X的最低负价与Y的最高正价代数和为零,不妨设Y的最外层电子数为a,则X的最外层电子数为a+4,a+=0得到a=2,则推导出X(O)、Y(Mg)、Z(Si)、W(P)。MgO为离子晶体,而SiO2为中只含共价键,A错误。非金属性P>Si,所以应当是磷酸的酸性大于硅酸的酸性,B错误。非金属性O>P,非金属性越强,氢化物也越稳定,C错误。Mg处第三周期第ⅡA族,D正确。
考查方向
解题思路
先由元素在周期表中的位置和化合价的关系,将涉及元素进行推断。再对选项逐一分析,对涉及的内容找到相对应的判据,如比较最高价的含氧酸的酸性是根据非金属性的强弱。
易错点
氢化物的稳定性是由非金属性的强弱决定的
知识点
6.恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g)

正确答案
解析
考查方向
解题思路
反应速率的计算是用浓度的改变与时间的比值。利用平衡常数的大小变化,推断升高温度时,平衡是朝正向还是逆向移动,从而得到反应是吸热还是放热的结论。解等效平衡问题要学会用建模的方法去处理,这一部分内容难度比较大,复习过程中要重视。
易错点
等效平衡在解题中的运用
知识点
甲醇是一种重要的可再生能源。
25.还可通过下列反应制甲醇:CO(g)+2H2(g) 
26.在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______(填字母)。A.H2的消耗速率等于CH3OH的生成速率的2倍B.H2的体积分数不再改变C.体系中H2的转化率和CO的转化率相等D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入
27.以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池负极反应式_________
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
28.已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ•mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH =b kJ•mol-1
试写出由CH4和O2制取甲醇的热化学方程式 _____________________
正确答案
0.15mol·L-1·min-1
解析
(2)由反应方程式:CO(g)+2H2(g) 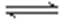
υ(CO)=,υ(H2)=
考查方向
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
正确答案
①BD ②< ③4L
解析
①反应的任意时刻υ(H2)正:υ(CH3OH)正=2:1,A错误。H2的体积分数不再改变,反应达平衡状态,B正确。由于初始投入的H2 、CO二者的量之比为2:1,而反应过程中消耗的H2 与CO也是按2:1进行,所以二者在任意时间转化率均相等,C错误。,该反应生成物与反应物均为气体,所以m是定值,但反应进行过程中,n值会不断变化,当M不变反应达到平衡状态,D正确。
②在温度相同的情况下,本反应的压强越大CO的转化率越大,故PA<PB 。③
考查方向
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
正确答案
①CH3OH+8OH- -6e- =CO32-+6H2O
②c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
解析
①燃料电池的负极通入的为甲醇,发生氧化反应,原本应当形成CO2但是溶液是以KOH为电解质,故最终反应变为CO32-,反应式为:CH3OH+8OH- -6e- =CO32-+6H2O
②由信息设反应方程式为:0.8KOH+0.5CO2=xK2CO3+yKHCO3+zH2O,则x+y=0.5 2x+y=0.8联解求得x=0.3 y=0.2
即0.3molK2CO3 0.2molKHCO3,因此离子浓度大小关系为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
考查方向
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
正确答案
2CH4(g)+O2(g)=2CH3OH(g)ΔH=(a+2b)kJ·mol-1
解析
将① 2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ·mol-1
② CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ·mol-1
将①+2②得到2CH4(g)+O2(g)=2CH3OH(g)ΔH=(a+2b)kJ·mol-1
考查方向
化学反应中的能量变化、化学平衡、电化学、离子浓度大小比较等综合知识
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
请回答下列问题:
7.写出E元素在周期表中的位置 。
8.B与D可形成三原子分子X,X的电子式为 。
9.E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
10.G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
11.由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 
12.盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
写出石墨(I)电极上发生的电极反应式 
13.用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO 4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
正确答案
(1)第三周期第IA族
解析
(1)E在周期表中的第一纵行,第三横行即第三周期第IA族。
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
正确答案
(2)
解析
(2)B为碳,D为氧二者形成的三原子分子为CO2,C与O之间共用二对共用电子对。
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
正确答案
(3)r(S 2-) > r(Na +) > r(Al 3+)
解析
(3)离子半径大小比较先看电子层数,S2-的核外电子层数最多半径最大,再就是看质子数,质子数越大,半径越小所以r(S 2-) > r(Na +) > r(Al 3+)。
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
正确答案
(4)SiO 2 +2C高温 Si+2CO↑
解析
(4)G的氧化物为SiO2,B为C,二者在高温一发生氧化还原反应,SiO 2 +2C高温 Si+2CO↑
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
正确答案
(5)NH4+ + H2O
解析
(5)A、C、D形成的强电解质有HNO3 、NH4NO3等。能促进水解,且水溶液显酸性的应当是NH4+的水解所致,离子反应式为NH4+ + H2O
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
正确答案
(6)H2 +CO32- -2e - =H2O+CO2
解析
(6)B、D、E形成的熔融盐为Na2CO3,两极通入的气体为H2、O2 ,通氢气的一极为原电池的负极发生氧化反应,失电子后生成的H+与CO32-反应生成CO2,电极反应为:H2 +CO32- -2e - =H2O+CO2
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
正确答案
(7)0.4 mol
解析
(7)电解CuSO 4溶液的反应方程式为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4 ,当硫酸铜不足时,则断续电解水。电解一段时间后,补充的Cu(OH)2与H2SO4反应生成回硫酸铜与水,氢氧化铜0.1mol,得到硫酸铜0.1mol和水0.2mol,意味着电解过程中先是0.1molCuSO4和0.1molH2O放电,后是继续电解了
考查方向
解题思路
这种综合性题考查的内容相当广,解题时先审清题,逐一分析,对提出的问题能联想到所涉及到的知识点,做出正确的解答。
易错点
不同电解质环境下燃料电池正负极反应方程式的书写、电解过程中电子转移数目的相关计算
高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:
Ⅰ.R

Ⅱ.
14.①的反应类型是 。
15.②的化学方程式为 。
16.PMMA单体的官能团名称是 、 。
17.F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为 。
18.G的结构简式为 。
19.下列说法正确的是 (填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.1 mol 
20.J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是 。
21.写出由PET单体制备PET聚酯并生成B的化学方程式 。
正确答案
(1)加成反应
解析
(1)乙烯与溴的四氯化碳溶液反应得到
考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(2)
解析
(2)A为
考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(3)碳碳双键 酯基
解析
(3)PMMA的单体为:
考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(3)碳碳双键 酯基
解析
(3)PMMA的单体为:
考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(4)
解析
(4)E的分子式为C3H8O,且能发生催化氧化,由此可推知E为醇,有二种结构:



考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(6)a
解析
(6)⑦为


考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(7)
解析
(7)J为

考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
正确答案
(8)
解析
(8)PET单体为:

考查方向
解题思路
快速审题把握好已知信息,推断过程中结合所给的反应条件及分子式的变化,判断出反应的类型及有机物的结构。
易错点
聚合反应方程式的书写、对已知信息处理不当,无法正确推断。
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
22.实验室中可将FeCl3溶液 、 、过滤、洗涤干燥得FeCl3·6H2O;再 ,得到无水FeCl3。
23.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol·L-1(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
24.利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是
;检验萃取、分液后所得水层中是否含有Fe3+的方法是

③所得
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
正确答案
(1)蒸发(浓缩);冷却(结晶);
将FeCl3·6H2O在HCl的气氛中加热脱水
解析
(1)将三氯化铁溶液蒸发浓缩,冷却结晶可到了氯化铁的结晶水合物。如要得到无水氯化铁,为防其水解,需在HCl气流中加热脱水。
考查方向
解题思路
充分把握题干信息,逐项分析、见招拆招。对每小题涉及到的问题,联想到相对应的知识点,找到正确的突破方向。如氯化铁能被异丙醚萃取,解释原因,自然联想到分离提纯中萃取的相关知识,萃取是利用同种溶质在不同溶剂中的溶解度不同进行分离提纯,说明氯化铁在异丙醚中溶解比水更容易。
易错点
物质分离提纯的方法,中和滴定过程中误差分析。
正确答案
(2)1.1×10-6
解析
(2)由信息得知:PH=4,则c(OH-)= ,c(Fe3+)c3(OH-)= Ksp[Fe(OH)3], c(Fe3+)==。
考查方向
解题思路
充分把握题干信息,逐项分析、见招拆招。对每小题涉及到的问题,联想到相对应的知识点,找到正确的突破方向。如氯化铁能被异丙醚萃取,解释原因,自然联想到分离提纯中萃取的相关知识,萃取是利用同种溶质在不同溶剂中的溶解度不同进行分离提纯,说明氯化铁在异丙醚中溶解比水更容易。
易错点
物质分离提纯的方法,中和滴定过程中误差分析。
正确答案
(3)①(浓)盐酸
②FeCl3在异丙醚中的溶解度大于其在水中的溶解度;取少溶液,向其中滴加少量KSCN溶液,若溶液变红,
③除去杂质、减少草酸铁晶体的溶解损耗
④甲; c
解析
(3)①FeCl3+3H2O 
考查方向
解题思路
充分把握题干信息,逐项分析、见招拆招。对每小题涉及到的问题,联想到相对应的知识点,找到正确的突破方向。如氯化铁能被异丙醚萃取,解释原因,自然联想到分离提纯中萃取的相关知识,萃取是利用同种溶质在不同溶剂中的溶解度不同进行分离提纯,说明氯化铁在异丙醚中溶解比水更容易。
易错点
物质分离提纯的方法,中和滴定过程中误差分析。














