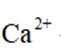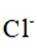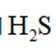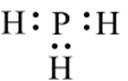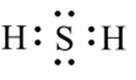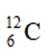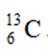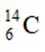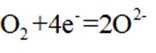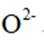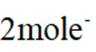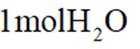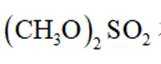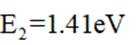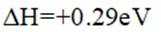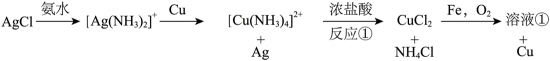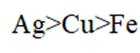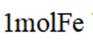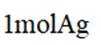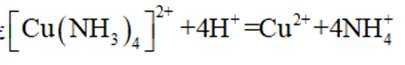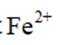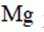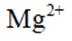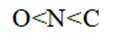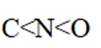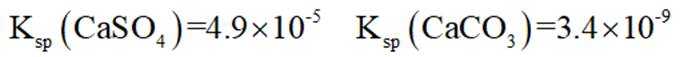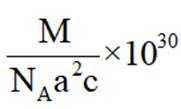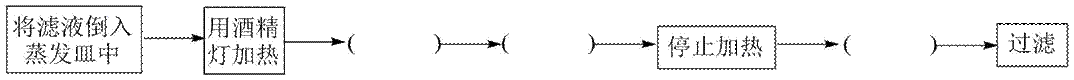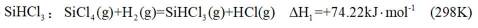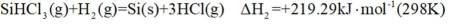- 真题试卷
- 模拟试卷
- 预测试卷
下列成语涉及金属材料的是
正确答案
解析
本题考查了成语中涉及的金属材料。
“金戈铁马”中的“金戈”指的是金属制作的武器,“铁马”则是指铁制的铠甲或战马,均与金属材料相关。而“洛阳纸贵”是指书籍因畅销而使纸张价格上涨,比喻作品广受欢迎;“聚沙成塔”比喻积少成多,量变引起质变;“甘之若饴”则是形容甘愿承受痛苦,像吃甘饴一样心甘情愿。这些成语与金属材料并无关联。成语的字面意思及其引申义,只有“金戈铁马”明确涉及到金属材料,因此选择C。
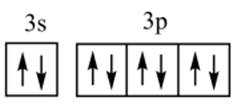
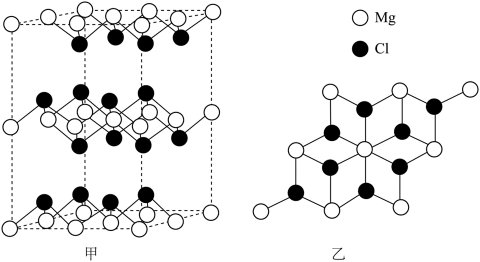
下列化学用语表述错误的是
正确答案
解析
本题考查了化学用语的正确表述。
Na和Cl的电子式分别为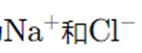
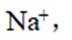
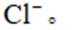

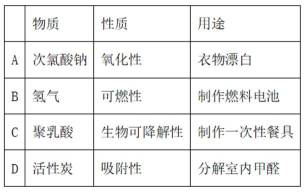
化学与生活息息相关,下列对应关系错误的是
正确答案
解析
本题考查了物质性能及用途的对应关系。
活性炭具有良好的吸附性能,常用于去除空气中的有害物质和异味,而不是直接分解甲醛。次氯酸钠(A)是一种强氧化剂,常用于衣物漂白,通过其氧化作用去除污渍;氢气(B)具有可燃性,常用于燃料电池,其清洁燃烧特性使其成为绿色能源的代表;聚乳酸(C)是一种生物可降解塑料,常用于制作一次性餐具和其他一次性用品。活性炭主要通过物理吸附方式去除室内甲醛,而不是分解甲醛。
下列措施能降低化学反应速率的是
正确答案
解析
本题考查了影响化学反应速率的因素。
反应速率通常受反应物浓度、温度、催化剂等因素影响。锌粉和盐酸反应时加水稀释,会降低反应物的浓度,从而降低反应速率。加入催化剂(A)可以通过降低反应的活化能提高反应速率;在中和滴定过程中边滴边摇锥形瓶(B)可以加速反应物的均匀混合,从而提高反应速率;在石墨合成金刚石的过程中增大压强(D)可以促进反应向生成金刚石的方向进行,从而提高反应速率。加水稀释反应物浓度使得反应速率减慢,这是降低反应速率的常见方法。
X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子核外有两个单电子,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄色。下列说法错误的是
正确答案
解析
本题考查了元素及其化合物的性质。
题目给出的X、Y、Z、W、Q分别是Na、Mg、Al、Si、P。根据题意,W(Na)的焰色试验呈黄色;Y(Mg)原子核外有两个单电子;Z(Al)和Q(P)同族,且Z的原子序数是Q的一半。由此,X、Y组成的化合物(如MgO)有可燃性,Mg与O反应生成氧化镁释放大量热;X、Q组成的化合物(如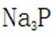
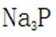
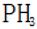
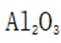
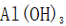
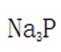
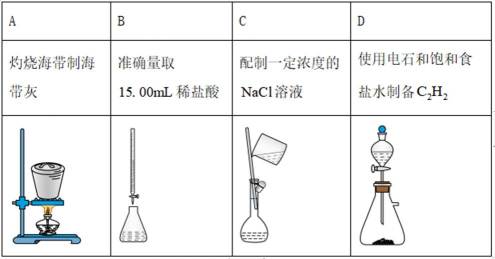
下列实验操作对应的装置不正确的是
正确答案
解析
本题考查了化学实验操作与装置的对应关系。
灼烧海带制海带灰需要高温加热装置,而图中A选项的装置并不适合这一操作。图中装置A是用于气体吸收的,B选项是准确量取稀盐酸的装置,包括滴定管和锥形瓶,C选项是配置一定浓度溶液的装置,D选项是制备乙炔气体的装置。因此,A选项的装置不适用于灼烧海带制海带灰的操作,故答案为A。
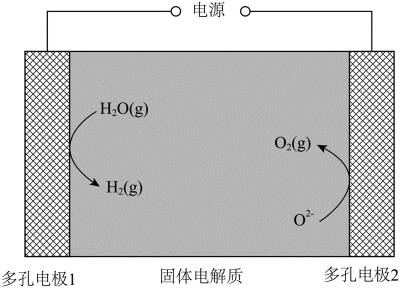
某固体电解池工作原理如图所示,下列说法错误的是
正确答案
解析
本题考查了固体电解池的工作原理。
在固体电解池中,电极2是阴极,发生的是还原反应,而不是氧化反应。电极1的多孔结构能增大与水蒸气的接触面积,提高反应效率;电极2是阴极,发生还原反应。在电解过程中,阳极反应生成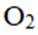
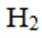
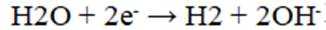
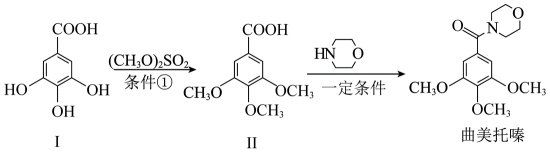
曲美托嗪是一种抗焦虑药,合成路线如下所示,下列说法错误的是
正确答案
解析
本题考查了有机化合物的合成路线。
化合物I和II不互为同系物。同系物是指结构相似,化学性质相近的化合物,而I和II结构差异较大,无法归为同系物。B选项描述苯酚和甲醇在特定条件下反应得到苯甲醚,这个反应是合理的;C选项描述化合物II能与溶液反应,说明其具备一定的化学活性;D选项描述曲美托嗪分子中含有酰胺基团,这个化学基团在曲美托嗪中确实存在。因此,只有A选项的描述不正确。
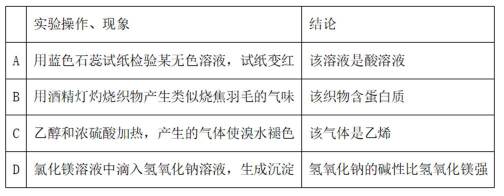
下列实验操作、现象和结论相对应的是
正确答案
解析
本题考查了化学实验现象与结论的对应关系。
用酒精灯灼烧织物产生类似烧焦羽毛的气味,说明该织物含有动物纤维,含有蛋白质,B项符合题意;A选项描述用蓝色石蕊试纸检验酸溶液变红不一定是酸溶液,错误;C选项描述乙醇和浓硫酸加热产生的气体使溴水褪色,其中的产物二氧化硫也能使溴水褪色,该气体是乙烯错误;D选项描述氯化镁溶液中滴入氢氧化钠溶液生成沉淀,与氢氧化钠和氢氧化镁的碱性无关,不能由此得出氢氧化钠的碱性比氢氧化镁强,D错误。
故选B。
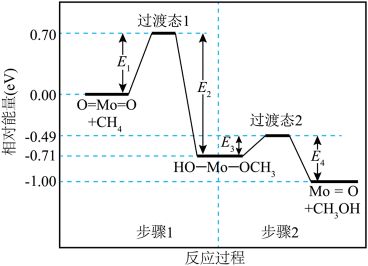
甲烷在某含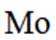
正确答案
解析
本题考查了化学反应速率的影响因素。
反应速率不仅仅取决于反应的活化能,还受温度、催化剂等多种因素的影响。步骤1中,甲烷与氧气反应生成中间产物,其活化能较低,反应较快,但这并不意味着其反应速率一定快于步骤2。步骤2的反应速率可能受其他条件的限制,无法简单根据能量变化图得出反应速率的快慢。因此,C选项中“步骤1的反应比步骤2快”的说法是不正确的。
兴趣小组设计了从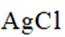
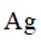
正确答案
解析
本题考查了化学反应方程式的书写及判断。
根据实验方案,反应①的离子方程式是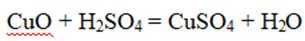
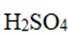
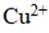
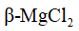
正确答案
解析
本题考查了晶体结构中的配位数。
离子的配位数是指一个离子周围最近邻离子的数目。在晶体结构中,离子的配位数取决于离子半径和晶体的空间排列方式。题干中所示晶体结构中,离子的配位数应通过具体的晶胞结构进行分析,D选项描述配位数为3不正确。A选项描述电负性正确;B选项描述单质是金属晶体正确;C选项描述晶体中存在范德华力正确。因此,D选项的描述错误。
温室气体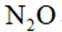
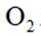
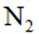
第一小题 下列说法错误的是
A.原子半径:
B. 第一电离能:
C. 在水中的溶解度:苯<苯酚
D. 苯和苯酚中C的杂化方式相同
第二小题 下列说法错误的是
A. 相同条件下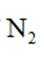
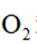
B. 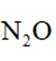
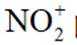
C. 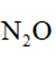
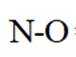
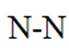
D. 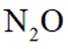
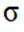
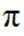
正确答案
第一题正确答案
B
第二小题正确答案
D
解析
第一小题:本题考查了元素的化学性质及规律。第一电离能是指从气态原子中移除一个电子所需的能量。一般来说,元素周期表中,随着原子序数的增加,第一电离能会逐渐增加。然而,由于氧原子的电子排布特殊性(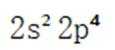
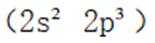
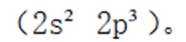
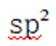
第二小题:本题考查了分子结构与化学键的数量关系。在同一分子结构中,中键(sigma键)和大键(pi键)的数目是特定的,不能随意改变。因此,中键和大键的数目应相等。A选项描述在相同条件下,氮气(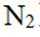
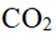
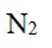
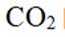
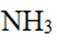
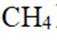
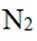
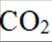
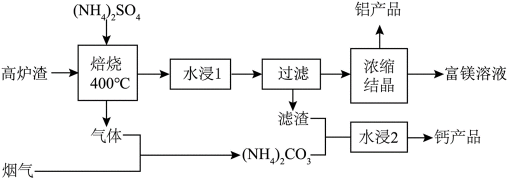
我国科研人员以高炉渣(主要成分为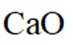
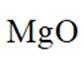
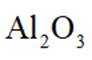
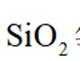
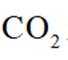
已知:
(1)高炉渣与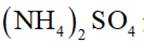
(2)“滤渣”的主要成分是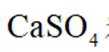
(3)“水浸2”时主要反应的化学方程式为_______,该反应能进行的原因是_______。
(4)铝产品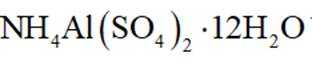
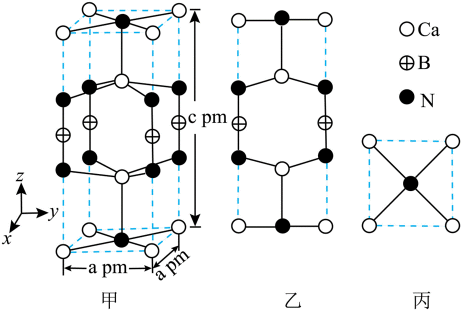
(5)某含钙化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数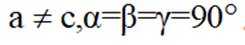
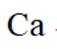
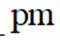
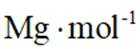
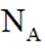
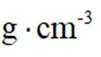
正确答案
(1)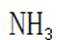
(3) ①. 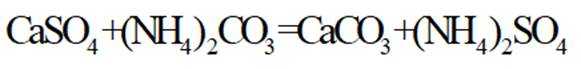
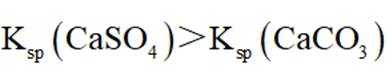
(4)净水 (5) ①. 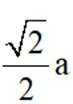
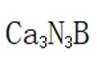
解析
本题考查了高炉渣处理和晶体结构计算。
(1)高炉渣主要成分为
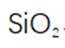
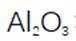
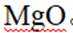
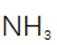
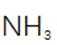
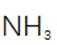
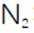
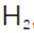
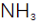
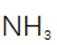
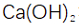
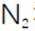
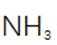
(2)滤渣的主要成分为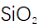
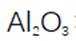
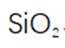

(3)水浸2的主要反应方程式为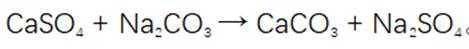
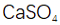
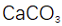
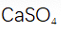

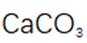
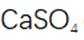
(4)铝产品可用于净水。铝的化合物,如明矾
(5)某含钙化合物的晶胞结构中,Ca与N的距离为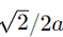
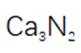
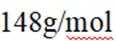
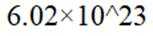
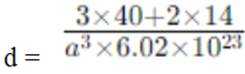
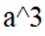
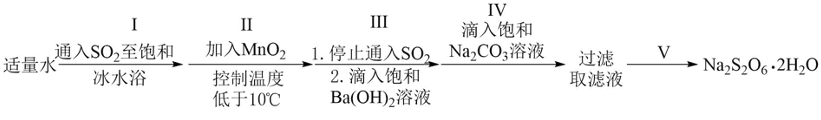
某兴趣小组设计了利用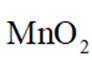
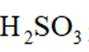
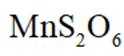
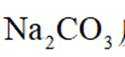
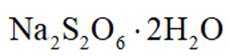
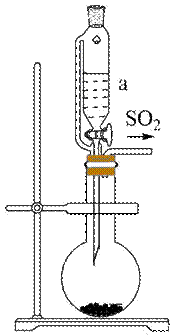
(1)采用下图所示装置制备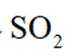
(2)步骤Ⅱ应分数次加入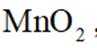
(3)步骤Ⅲ滴加饱和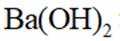
(4)步骤Ⅳ生成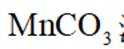
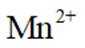
(5)将步骤Ⅴ中正确操作或现象的标号填入相应括号中_______。
A.蒸发皿中出现少量晶体
B.使用漏斗趁热过滤
C.利用蒸发皿余热使溶液蒸干
D.用玻璃棒不断搅拌
E.等待蒸发皿冷却
正确答案
(1) ①. 恒压滴液漏斗 ②. 增大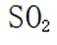
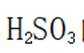
(2)防止过多的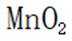
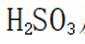
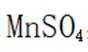
(3)除去过量的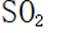
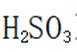
(4)静置,向上层清液中继续滴加几滴饱和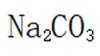
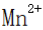
(5)D、A、E
解析
本题考查了气体制备、溶解度、反应控制及沉淀反应的实验设计和操作。 (1)采用图中所示装置制备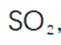
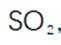
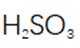
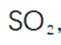
(2)步骤Ⅱ应分数次加入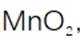
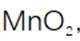
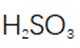

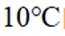
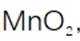
(3)步骤II滴加饱和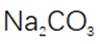
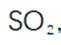
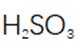
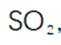
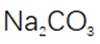
(4)判断沉淀完全的方法是静置,向上层清液中继续滴加几滴饱和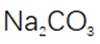
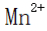
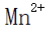
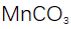
(5)步骤V中正确的操作或现象包括:D(用玻璃棒不断搅拌),A(蒸发皿中出现少量晶体),E(等待蒸发皿冷却)。这些操作有助于控制反应进程,确保实验结果的准确性和重复性。
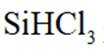
(1)由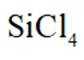
已知
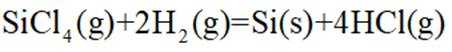
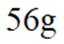
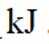
(2)在催化剂作用下由粗硅制备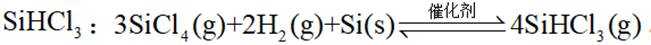
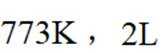
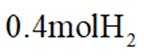
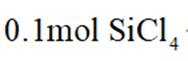
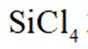
①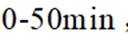

②当反应达平衡时,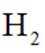
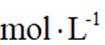
③增大容器体积,反应平衡向_______移动。
正确答案
(1) ①. 吸 ②. 587.02 ③. 该反应为吸热反应,升高温度,反应正向移动,有利于制备硅
(2)①. 甲 ②. 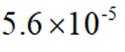
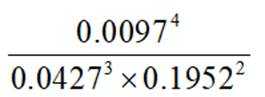
解析
本题涉及半导体材料硅的制备过程及反应平衡的计算。 (1)

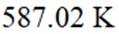
(2)在催化剂作用下,由粗硅制备


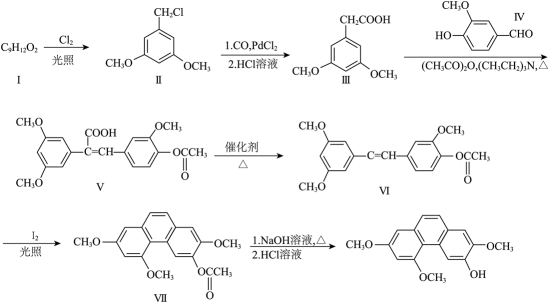
山药素-1是从山药根茎中提取的具有抗菌消炎活性的物质,它的一种合成方法如下图:
(1)
化合物I的结构简式为_______。由化合物I制备化合物Ⅱ的反应与以下反应_______的反应类型相同。
A.
B.
C.
D.
(2)化合物Ⅲ的同分异构体中,同时满足下列条件的有_______种。
①含有苯环且苯环上的一溴代物只有一种;
②能与新制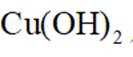
③核磁共振氢谱显示有4组峰,峰面积之比为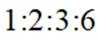
(3)化合物IV的含氧官能团名称为_______。
(4)由化合物V制备VI时,生成的气体是_______。
(5)从官能团转化的角度解释化合物Ⅷ转化为山药素-1的过程中,先加碱后加酸的原因_______。
正确答案
(1) ①. 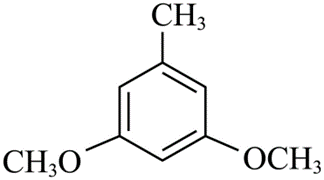
(3)酚羟基、醚键、醛基
(4)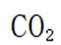
解析
本题考查有机合成路线及相关的化学反应类型和官能团分析。 (1)化合物I的结构简式为
(2)化合物III的同分异构体中,同时满足下列条件的有5种。苯环上的一溴代物只有一种,表明苯环上只有一种取代基位置;能与新制的
(3)化合物IV的含氧官能团名称为酚羟基、醚键和醛基。酚羟基是苯环上的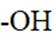
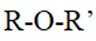
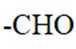
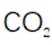
(4)由化合物V制备VI时,生成的气体是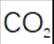
(5)化合物Ⅷ转化为山药素-1的过程中,先加碱后加酸的原因是提高化合物Ⅷ的转化率。碱性条件下,酯基水解生成羧酸盐,然后在酸性条件下,羧酸盐转化为游离羧酸。通过控制反应的pH值,可以提高转化率,确保最终产物的纯度和收率。这道题目涉及有机合成中的多个关键步骤和反应机制的理解,考查学生对有机化学反应的掌握和应用能力。