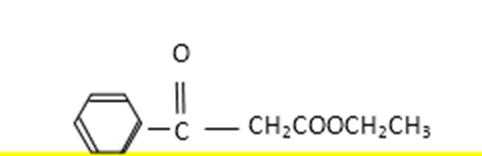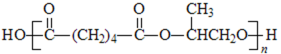- 真题试卷
- 模拟试卷
- 预测试卷
2.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一。如图是其中一种的结构。
下列说法中不正确的是 ( )
正确答案
解析
该有机物分子中含有苯环,能与氢气发生还原反应,故A项正确。B项它能与氧气燃烧发生氧化反应,该项正确。该有机物分子有二个对称轴,
因此只存在一种等效氢,所以它的一溴取代物只有一种,C选项正确。因为苯是平面分子,最多时二个苯环上的原子都处于同一平面上,故D选项错误。
考查方向
解题思路
对有机物的结构与性质的关系要熟悉,掌握甲烷、乙烯、乙炔、苯等常见有机物的分子空间构型
易错点
有机物结构与性质关系把握不当,分子空间结构不清。
知识点
5.X、Y、Z、W属于短周期主族元素。X元素的原子半径最大,Y元素的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子核外电子数之比为2:1。下列说法中错误的是( )
正确答案
解析
X元素的原子半径最大所以为钠,Z元素的原子L层电子排满,则m+n=8,Y次外层为n个,所以n=2,再计算求得m=6,由此可以推出Y元素为氧,Z元素为硅,W元素为碳,R元素为硫。A中氧化钠和过氧化钠阴阳离子个数比为1:2,正确。B中O与Si、C、S可以形成二氧化硅、一氧化碳、二氧化碳、二氧化硫、三氧化硫五种,正确。C中水比硫化氢稳定,熔沸点也比硫化氢高,错误。Z、W、R的最高价氧化物对应水化物分别为H2SiO3 、H2CO3 、H2SO4酸性强弱顺序D正确。
考查方向
解题思路
由核外电子排布推数出m、n的大小,再确定各元素的各类,再依据酸性强弱判断依据、氢化物熔沸点判断依据分析。
易错点
核外电子排布不清、氢化物稳定性与熔沸点判断依据不清。
知识点
7.室温下,0.2 mol·L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是 ( )
正确答案
解析
BOH与HCl等体积、等浓度混合,二者完全反应,产物为BCl与H2O。溶液中存在的微粒可能有,H+ 、OH- 、Cl- 、B+ 、BOH、 H2O从图中我们可以看出X、Y、Z均不相等,所以,BOH一定为弱碱,在溶液中所含的离子中Cl- 的浓度最大,其次为B+,所以则X为H+,Y为BOH,Z为OH-,所以溶液一定显酸性,A错误。升高温度,有利于B+水解,c(X)、 c(Y)都增大,B选项正确。溶液中的B原子与Cl原子相等,利用原子守恒得出, C项正确。稀释溶液,水解程度增大,但是c(X)减小,D错误。
考查方向
解题思路
先由强酸与碱完全反应,再对碱是强碱与弱碱作假设,去伪存真。再运用三大守恒对选项分析。
易错点
对反应后存在的离子判断不清,电解质溶液中的三大守恒不能灵活运用。
知识点
1.化学与生产、生活、社会密切相关。下列说法中正确的是( )
正确答案
解析
A项漂白粉因为与空中的二氧化碳和水结合生成次氯酸,然后次氯酸光照分解,与氧气氧化无关。不锈钢中含有铬提高了耐腐蚀性,B项正确。在气缸工作时,吸入的氮气和氧气生成部分氮氧化物,并非是由于汽油中含有氮元素,故C项错误。D项苯的同系物是主要由煤的干馏产生的,故错误。
考查方向
解题思路
密切关注化学在生产、生活中的运用,运用化学知识分析相关的原理。
易错点
对汽油的成份不清楚,石油的分馏与煤的干馏产物判断不清。
知识点
3.设NA为阿伏加德罗常数的值。下列说法正确的是( )
正确答案
解析
Na2S中的阴离子为S2-,Na2O2中的阴离子为O22-,都是一个离子中含有18个电子,又由于Na2S和Na2O2的摩尔质量相同,7.8g混合物的物质的量为0.1mol,故A项正确。B项二氯甲烷在标准状况下是液体,11.2L并非0.5mol。乙烯与丙烯的最简式相同为CH2 ,28 g该混合气体含有的碳原子数目为2NA。D项因不知道溶液的具体体积,无法计算,故错误。
考查方向
解题思路
认真审题,掌握有关阿佛加德罗常数在各种不同条件下的计算。
易错点
过氧化钠中阴离子为O22-,错将溶液体积当成1L计算。
知识点
4. 如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是 ( )
正确答案
解析
由图甲O2生成H2O 发生了还原反应,可知N为正极,M为负极,H十应移向正极,由左向右移动,A项正确。乙装置为电解池,电镀铜时,镀层金属Cu应当作为阳极,故应当与电源正极相连,B项正确。C项,尿素失电子生成CO2和N2,碳元素化合价没有变化,1 mol尿素失去6mol电子,正确。N电极发生的反应为:O2+4e-+4H+=2H2O,每消耗0.25 mol氧气时,转移1 mol,Cu2++2e-=Cu根据电子守恒,则铁电极析出0. 5 mol铜,质量应为32g。故 D项错误。
考查方向
解题思路
先分清二装置哪为电解池,哪为原电池。再根据电极通入的物质,与电极自身的属性分清正负极、与阴阳极。
易错点
电极反应方程式书写不当、原电池与电解池不能区分
知识点
6.下列实验操作、现象与结论对应关系正确的是( )
正确答案
解析
A项酸性条件下NO3—被Fe2+还原为NO,B项含有酚酞的Na2CO3溶液,因碳酸根离子水解显碱性溶液变红,加入少量BaC12固体,水解平衡逆向移动,则溶液颜色变浅,证明Na2CO3溶液中存在水解平衡,故B正确;C项由于起始时,HX、HY等体积等PH值,HX放出的氢气多且反应速率快,说明HX浓度比HY大, 即HX酸性比HY弱,该选项错误。D.等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大,可比较亚硫酸与碳酸的酸性,因亚硫酸不是最高价含氧酸,则不能比较非金属性的强弱,故D错误
考查方向
解题思路
对操作与实现合理分析,每一结论与现象是否吻合。
易错点
等体积,等PH的两酸,是越弱反应速度越快。
知识点
氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。
8.实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:

10.装置C中干燥管中所盛试剂的名称是: ,作用是:
11.装置C中酒精灯的作用是:
12.为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol·L-1酸性KMnO4标准溶液滴定至终点。(已知还原性Fe2+>Cl-)滴定结果如下表所示:
①写出滴定过程中所发生的2个离子方程式: 、
②样品中氯化亚铁的质量分数为
正确答案
关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
解析
装置气密性的检验,长颈漏斗检验使用注水法
考查方向
解题思路
认真审题,明白实验的目的是做什么,再有针对性地去分析每一装置的具体作用。中和滴定中有关实验数据的分析与处理要掌握,有关化学方程的计算胆大心细。
易错点
离子方程式的书写 依据方程式进行定理计算
正确答案
b c e f d
解析
装置A产生H2,H2在与氯化铁反应前必须通入B装置干燥,尾气再以装置C净化。故连接的顺序为a b c e f d
考查方向
解题思路
认真审题,明白实验的目的是做什么,再有针对性地去分析每一装置的具体作用。中和滴定中有关实验数据的分析与处理要掌握,有关化学方程的计算胆大心细。
易错点
离子方程式的书写 依据方程式进行定理计算
正确答案
碱石灰或生石灰 除去HCl、并防止空气中水的进入
解析
先制备氢气,但有杂质水,选择除杂试剂(干燥)在通过已知氢气还原氯化铁生成FeCl2和HCl,制备FeCl2,而氯化铁遇水剧烈水解,应注意前后都要防水进入,后考虑有尾气,进行尾气处理,尾气两种未反应完全的氢气与HCl,故C中干燥管应盛放碱石灰作用除去HCl、并防止空气中水的进入。装置C中酒精灯的作用为燃烧H2,防止污染空气
考查方向
解题思路
认真审题,明白实验的目的是做什么,再有针对性地去分析每一装置的具体作用。中和滴定中有关实验数据的分析与处理要掌握,有关化学方程的计算胆大心细。
易错点
离子方程式的书写 依据方程式进行定理计算
正确答案
燃烧H2,防止污染空气
解析
出来的尾气中含有氢气,用酒精灯燃烧,防止环境污染。
考查方向
解题思路
认真审题,明白实验的目的是做什么,再有针对性地去分析每一装置的具体作用。中和滴定中有关实验数据的分析与处理要掌握,有关化学方程的计算胆大心细。
易错点
离子方程式的书写 依据方程式进行定理计算
正确答案
①MnO4- +5Fe2++8H+==Mn2++5Fe3++4H2O ;2MnO4- +16H+ + 10Cl-=2Mn2++5Cl2↑+8H2O ②70.1﹪
解析
三次滴定


设FeCl3与FeCl2物质的量分别为x、y,
MnO4- +5Fe2++8H+==Mn2++5Fe3++4H2O 2MnO4- +16H+ + 10Cl-=2Mn2++5Cl2↑+8H2O
1 5 2 10
y/5 y (3x+2y)/5 3x+2y
y/5 + (3x+2y) = 1mol.L-1
解得x=0.01 y=0.03,则氯化亚铁的质量为3.81g ,氯化亚铁的质量分数为:
考查方向
解题思路
认真审题,明白实验的目的是做什么,再有针对性地去分析每一装置的具体作用。中和滴定中有关实验数据的分析与处理要掌握,有关化学方程的计算胆大心细。
易错点
离子方程式的书写 依据方程式进行定理计算
锂离子电池是一种二次电池,它主要依靠锂离子在正极和负极之间移动来工作。某锂离子电池正极材料有钴酸锂(LiCoO2)、铝箔和有机物导电剂等。现利用以下流程回收正极材料中的某些资源.
请回答下列问题:
13.用硫酸和过氧化氢酸浸时,一般在90℃下进行,写出该步骤中发生的主要氧化还原反应的化学反应方程式 。当有1mol LiCoO2参加反应时,得到氧化产物的质量为 。
14. 常温条件下调pH时,若使Al3+完全沉淀所需最小的pH为 (保留整数)。(已知:离子浓度等于或小于1.×10-6时,认为其完全沉淀;Al(OH)3的Ksp=1.13×10-33)
15. 操作1的名称是 。
16.从平衡角度进行解释生成CoCO3固体的原因 。
17.钴元素与铁元素都属于第VIII族,它们的化合物有相似的性质。Co(OH)2在空气中加热时,钴元素在固体残留物中的百分含量有如下图所示的变化。已知钴的氢氧化物加热至290℃时已完全脱水,则A点时,剩余固体的成分为___________(填化学式);在550-600℃范围内,剩余固体的成分为 (填化学式)。
正确答案
2LiCoO2+3H2SO4+H2O2= Li2SO4+2CoSO4+O2↑+4H2O、
2Al +3H2SO4 =Al2(SO4)3 +3H2↑;16g
解析
根据工艺流程中酸浸的过程中发生氧化还原反应有2LiCoO2+3 H2SO4+H2O2=Li2SO4+2 CoSO4+O2↑+4H2O;有Al(OH)3固体和题干中的铝箔,易推知有铝与H2SO4溶液反应。所以离子方程式为: 2Al +6H+ =2Al3+ +3H2↑;因为反应是温度80℃,还会发生双氧水制氧气的反应:2H2O =O2↑+2H2O;LiCoO2与 H2SO4的反应中O2作为氧化产物,由方程式可知,1mol LiCoO2参于反应得到0.5molO2。
考查方向
解题思路
认真审题,在解题过程中对工业流程进行再认识。平时加强对化学核心知识的复习与练习,培养良好的解题心理素质。
易错点
溶度积的计算、氧化还原方程式的书写与计算
正确答案
5
解析
离子浓度等于或小于1.0×10-6时,认为其沉淀完全;c(OH-)3=Ksp/1.0×10-6=
考查方向
解题思路
认真审题,在解题过程中对工业流程进行再认识。平时加强对化学核心知识的复习与练习,培养良好的解题心理素质。
易错点
溶度积的计算、氧化还原方程式的书写与计算
正确答案
萃取分液
解析
滤液经操作1后得到Li2SO4溶液与有机相,因此操作1是加入有机试剂,进行萃取、分液。
考查方向
解题思路
认真审题,在解题过程中对工业流程进行再认识。平时加强对化学核心知识的复习与练习,培养良好的解题心理素质。
易错点
溶度积的计算、氧化还原方程式的书写与计算
正确答案
HCO3- 
解析
(4)平衡移动原理,溶液中HCO3- 
考查方向
解题思路
认真审题,在解题过程中对工业流程进行再认识。平时加强对化学核心知识的复习与练习,培养良好的解题心理素质。
易错点
溶度积的计算、氧化还原方程式的书写与计算
正确答案
Co2O3;CoO、Co3O4
解析
联想Fe的氧化物,可能为Co 2 O 3(166) 、CoO(75)、Co 3 O 4 (241)。118/166×100%=71.1%,即为A点;59×3/241×100%=73.4% ,即B点;59/75×100%=78.7% 。在550-600℃范围内,剩余固体的成分为Co3 O 4和 Co 2 O 3 。
考查方向
解题思路
认真审题,在解题过程中对工业流程进行再认识。平时加强对化学核心知识的复习与练习,培养良好的解题心理素质。
易错点
溶度积的计算、氧化还原方程式的书写与计算
对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) 
已知2NO(g)+ O2(g)=2 NO2(g) ΔH=b kJ·mol-1;CO的燃烧热ΔH=c kJ·mol-1。
18.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式 。
19.一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:

前2s内的平均反应速率υ(N2) = mol/(L·s)(保留两位小数,下同);此温度下,该反应的平衡常数为 。
采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,
①常温条件下,此溶液的PH=5,则
NH3·H2O的Kb=1.7×10-5)
②向此溶液中再加入少量 (NH4)2SO4固体
设计如下图1装置模拟传感器测定CO与 NO反应原理。
①铂电极为________________(填“正极”或“负极”)。
②负极电极反应式为_________ _____
20.如下图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙。此时若去掉活塞1,不引起活塞2的移动。
则x= , V甲︰V乙= 。
正确答案
2NO2(g)+ 4CO(g)= N2(g) + 4CO2(g) ΔH= a-b+2c kJ·mol-1;
解析
考查热化反应方程式的书写及盖斯定律的应用
①2NO(g)+2CO(g) 
②2NO(g)+ O2(g)=2 NO2(g) ΔH=b kJ·mol-1;
③CO(g) + 0.5O2(g) = CO2(g) ΔH=c kJ·mol-1由三式联合得
2NO2(g)+ 4CO(g)= N2(g) + 4CO2(g) ΔH= a-b+2c kJ·mol-1
考查方向
解题思路
这是化学反应原理的综合题,涉及的知识点很多,需对各章节的知识体系都能很好把握,解题时按顺序先逐一解答,通过审题,再通过相关知识解答。
易错点
等效平衡的运用 电极方程式的书写
正确答案
(1)AD (2)0.09 0.03 mol·L-1; (3) ① 1.7×104 ; ②变大
(4)① 正极 ② CO+O2—-2e-=CO2
解析
(1)恒容密闭容器中由于反应物产物均为气态,故反应前后气体的总质量不变,而气体的总物质的量在不断减小,由M=





考查方向
解题思路
这是化学反应原理的综合题,涉及的知识点很多,需对各章节的知识体系都能很好把握,解题时按顺序先逐一解答,通过审题,再通过相关知识解答。
易错点
等效平衡的运用 电极方程式的书写
正确答案
1.5;3:1
解析
如图2 所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)=N2(g)+2CO2(g)只要转化到以便成比例即等效,所以有:
若去掉活塞,不引起活塞2的移动,说明心平衡宇原平衡等效。则3-2X=0解得x=1.5
甲相当等于3.6molCO 和3molNO刚好是乙的3倍,所以V甲:V乙=3:1
考查方向
解题思路
这是化学反应原理的综合题,涉及的知识点很多,需对各章节的知识体系都能很好把握,解题时按顺序先逐一解答,通过审题,再通过相关知识解答。
易错点
等效平衡的运用 电极方程式的书写
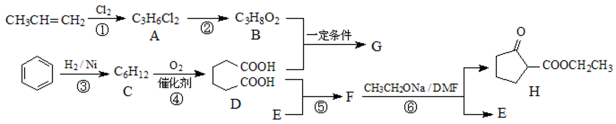
聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带;耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
已知:
21.A的名称(系统命名): ,H的分子式为 。
22.写出下列反应的反应类型:反应①是 ,反应④ 是 。
23.G的结构简式为 。
24.写出反应②的化学方程式:② 。
25.C存在多种同分异构体,写出核磁共振氢谱只有两种峰的同分异构体的结构简式: 。
26.利用以上合成路线的信息,以甲苯和乙醇为原料合成下面有机物(无机试剂任选)。
正确答案
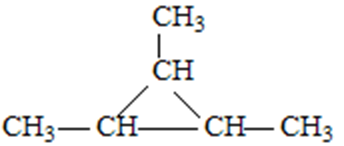
1, 2-二氯丙烷 C8H12O3
解析
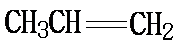
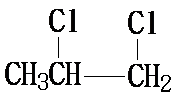
考查方向
解题思路
有机合成综合题考查知识比较全面,涉及到是内容常有命名、反应类型的判断、反应条件产物的判断、典型化学反应方程式的书写,平常加强重点内容的复习与整理。有机物合成常采用逆合成法进行推断。
易错点
方程式写书不完整、缩聚反应产物的书写、题设信息把握不准。
正确答案
(2)加成反应 氧化反应
解析
(2)反应①为烯烃与Cl2的加成反应,反应④为环己烷的催化氧化反应。
考查方向
解题思路
有机合成综合题考查知识比较全面,涉及到是内容常有命名、反应类型的判断、反应条件产物的判断、典型化学反应方程式的书写,平常加强重点内容的复习与整理。有机物合成常采用逆合成法进行推断。
易错点
方程式写书不完整、缩聚反应产物的书写、题设信息把握不准。
正确答案
解析
反应①为烯烃与Cl2的加成反应,反应④为环己烷的催化氧化反应。 (3) G由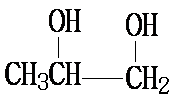
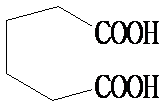
考查方向
解题思路
有机合成综合题考查知识比较全面,涉及到是内容常有命名、反应类型的判断、反应条件产物的判断、典型化学反应方程式的书写,平常加强重点内容的复习与整理。有机物合成常采用逆合成法进行推断。
易错点
方程式写书不完整、缩聚反应产物的书写、题设信息把握不准。
正确答案
②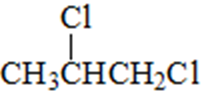
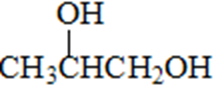
解析
反应②为氯代烃的水解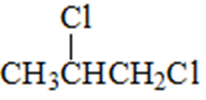
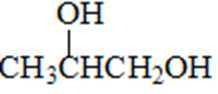
考查方向
解题思路
有机合成综合题考查知识比较全面,涉及到是内容常有命名、反应类型的判断、反应条件产物的判断、典型化学反应方程式的书写,平常加强重点内容的复习与整理。有机物合成常采用逆合成法进行推断。
易错点
方程式写书不完整、缩聚反应产物的书写、题设信息把握不准。
正确答案
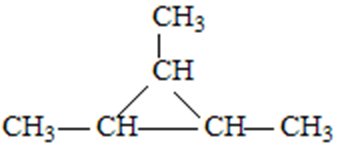
解析
同分异构体书写方法
考查方向
解题思路
有机合成综合题考查知识比较全面,涉及到是内容常有命名、反应类型的判断、反应条件产物的判断、典型化学反应方程式的书写,平常加强重点内容的复习与整理。有机物合成常采用逆合成法进行推断。
易错点
方程式写书不完整、缩聚反应产物的书写、题设信息把握不准。
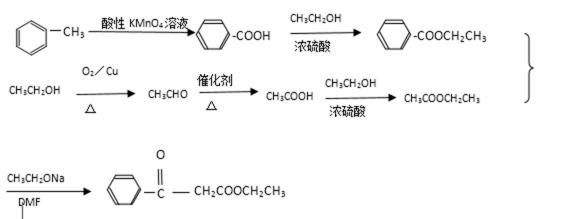
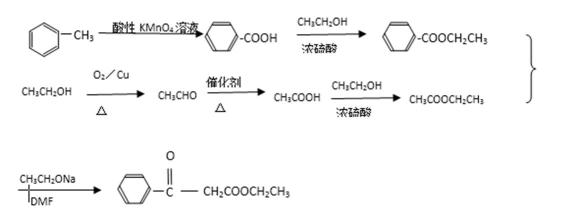
正确答案
解析
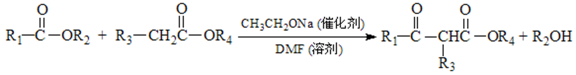
采用逆推法,由已知信息合成:需2种酯的缩合,成键在羰基C与亚甲基C上,因此在此位置上断键让其变回成二分的酯,得到CH3COOCH2CH3与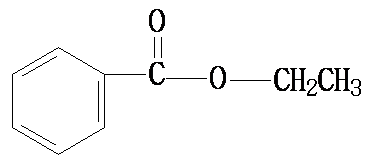
考查方向
解题思路
有机合成综合题考查知识比较全面,涉及到是内容常有命名、反应类型的判断、反应条件产物的判断、典型化学反应方程式的书写,平常加强重点内容的复习与整理。有机物合成常采用逆合成法进行推断。
易错点
方程式写书不完整、缩聚反应产物的书写、题设信息把握不准。