- 真题试卷
- 模拟试卷
- 预测试卷
1.下列表述符合化学事实的是()
正确答案
解析
A.任何物质都由化学物质组成,没有不含任何化学物质的物质,A错误;
B.“洁厕灵”与“漂白精”不能混用,因为二者混合后能产生一种有毒的气体,其反应的化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,B错误;
C.根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%,即生成物质全部是目标产物,C正确;
D.新核素可能只是原子核内中子数的变化,质子数不变,不意味着新元素的合成,D错误。
故选C。
考查方向
解题思路
A.任何物质都由化学物质组成,没有不含任何化学物质的物质;
B.“洁厕灵”与“漂白精”不能混用,因为二者混合后能产生一种有毒的气体;
C.根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;
D.新核素可能只是原子核内中子数的变化,质子数不变。
易错点
解题的易错点是D中新核素不一定就是新元素,质子数不同元素种类不同。
知识点
6. 苹果酸(HOOCCHOHCH2COOH)是重要的食品添加剂,有多种同分异构体,其中与苹果酸的官能团相同,官能团的个数也相同的有(不考虑立体异构)()
正确答案
解析
苹果酸(HOOCCHOHCH2COOH)是重要的食品添加剂,有多种同分异构体,其中与苹果酸的官能团相同,官能团的个数也相同的有(不考虑立体异构):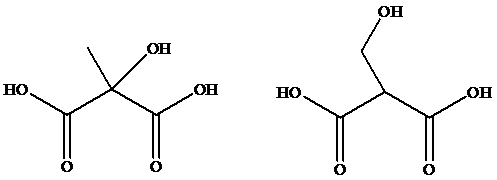
故选A。
考查方向
解题思路
与苹果酸(HOOCCHOHCH2COOH)的官能团相同,官能团的个数也相同的有(不考虑立体异构):
易错点
本题考查同分异构体的书写,难度中等,注意结构的重复。
知识点
7.对下列装置图或图像描述正确的是()
正确答案
解析
A.作为测量中和反应反应热的装置图,从玻璃仪器的角度看,图1中还缺少环形玻璃搅拌棒搅拌,A正确;
B.检验图2装置的气密性时,夹上弹簧夹,向漏斗中加水若出现长颈漏斗内外液面不一样高,即可以证明该装置气密性良好,B错误;
C.图3是利用原电池检验空气中Cl2含量的装置,Ag电极失去电子被氧化作负极,C错误;
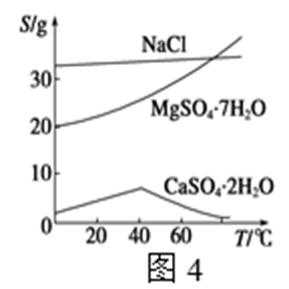
D.根据图4的溶解度变化可知,NaCl、CaSO4·2H2O的溶解度随着温度的变化而变化不大,在较低温度下容易分离MgSO4·7H2O,D错误。
故选A。
考查方向
解题思路
A.作为测量中和反应反应热的装置图,从玻璃仪器的角度看,图1中还缺少环形玻璃搅拌棒搅拌;
B.检验图2装置的气密性时,夹上弹簧夹,向漏斗中加水若出现长颈漏斗内外液面不一样高,即可以证明该装置气密性良好;
C.图3是利用原电池检验空气中Cl2含量的装置,Ag电极失去电子被氧化作负极;
D.根据图4的溶解度变化可知,NaCl、CaSO4·2H2O的溶解度随着温度的变化而变化不大,在较低温度下容易分离MgSO4·7H2O。
易错点
本题考查学生阅读题目获取信息能力、对物质分离提纯与条件控制、气密性检查、中和热的测定和原电池原理等,综合性较强,题目难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力。
知识点
2.下列表示物质变化的式子错误的是()
正确答案
解析
A.氯气通入水中反应的离子方程式为:Cl2+H2O 
B.甲烷的完全燃烧是放热反应,CH4(g)+2O2(g) 
C.冰醋酸是弱酸,加入水中电离的方程式为:CH3COOH+H2O 
D.铁与水蒸气反应生成四氧化三铁和氢气, 3Fe+4H2O
故选D。
考查方向
解题思路
A.氯气通入水中反应的离子方程式为:Cl2+H2O 
B.甲烷的完全燃烧是放热反应;
C.冰醋酸是弱酸,加入水中电离的方程式为:CH3COOH+H2O 
D.铁与水蒸气反应生成四氧化三铁和氢气。
易错点
本题考查离子反应、热化学方程式、化学方程式的书写,明确发生的化学反应是解答本题的关键,题目难度中等。
知识点
3.青蒿素对治疗疟疾有很好的效果,下列说法正确的是()
正确答案
解析
A.青蒿素含有酯基,几乎不易溶于水,可溶解于乙醇,易溶于氯仿、丙酮、乙酸乙酯和苯,A错误;
B.青蒿素分子中共含有5个环,其中有3个六元环(1个六碳环、1个五碳一氧环、1个三碳三氧环)和2个七元环(1个六碳一氧环、1个五碳二氧环),B错误;
C.青蒿素中含过氧键,过氧键属于非极性共价键,C正确;
D.高分子化合物,是指那些由众多原子或原子团主要以共价键结合而成的相对分子量在一万以上的化合物。纤维素属于高分子化合物,青蒿素不是高分子化合物,D错误。
故选C。
考查方向
解题思路
A.青蒿素含有酯基,几乎不易溶于水,可溶解于乙醇,易溶于氯仿、丙酮、乙酸乙酯和苯;
B.青蒿素分子中共含有5个环,其中有3个六元环(1个六碳环、1个五碳一氧环、1个三碳三氧环)和2个七元环(1个六碳一氧环、1个五碳二氧环);
C.青蒿素中含过氧键,过氧键属于非极性共价键;
D.高分子化合物,是指那些由众多原子或原子团主要以共价键结合而成的相对分子量在一万以上的化合物。纤维素属于高分子化合物。
易错点
本题考查学生对相关有机官能团的理解及有机化合物结构的掌握与应用的能力。
知识点
4.设NA表示阿伏加德罗常数的值,下列说法正确的是()
正确答案
解析
A.电解精炼铜时,阳极粗铜中含有活泼性较强的铁、锌等杂质,电解时铁、锌杂质先放电,且铁摩尔质量小于铜的64g/mol,锌的摩尔质量大于铜的摩尔质量,所以阳极减少6.4g,转移的电子的物质的量不一定为0.2mol,A错误;
B.6.0克SiO2晶体物质的量为0.1mol,一个二氧化硅含有4个Si-O键,0.1molSiO2中含有0.4NA 个Si-O键,B错误;
C.NA个CH4的物质的量为1mol,在标准状况下的体积约为22.4L,C正确;
D.苯与液溴发生取代反应,生成1mol
故选C。
考查方向
解题思路
A.电解精炼铜时,阳极粗铜中含有活泼性较强的铁、锌等杂质,电解时铁、锌杂质先放电,且铁摩尔质量小于铜的64g/mol,锌的摩尔质量大于铜的摩尔质量,所以阳极减少6.4g,转移的电子的物质的量不一定为0.2mol;
B.6.0克SiO2晶体物质的量为0.1mol,一个二氧化硅含有4个Si-O键,0.1molSiO2中含有0.4NA 个Si-O键;
C.NA个CH4的物质的量为1mol,在标准状况下的体积约为22.4L;
D.苯与液溴发生取代反应,生成1mol
易错点
本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析,微粒结构分析判断,掌握基础是关键,题目难度中等。
知识点
5.a、b、c、d四种元素在周期表中的位置如下图,则下列说法正确的是()
正确答案
解析
A.若b的最高价氧化物对应水化物为H2bO4,b为+6价,a显负价时为-3价,则a的氢化物的化学式为aH3,A正确;
B.若b的单质可作半导体材料,若b为硅,则c的单质为锗,可能为半导体材料,B错误;
C.非金属性越强,与氢气越易结合,若b的单质与H2易化合,则c的单质与H2不易化合,C错误;
D.a与b之间电负性较接近,不容易形成离子化合物,D错误。
故选A。
考查方向
解题思路
A.若b的最高价氧化物对应水化物为H2bO4,b为+6价,a显负价时为-3价,则a的氢化物的化学式为aH3;
B.若b的单质可作半导体材料,若b为硅,则c的单质为锗,可能为半导体材料;
C.非金属性越强,与氢气越易结合,若b的单质与H2易化合,则c的单质与H2不易化合;
D.a与b之间电负性较接近,不容易形成离子化合物。
易错点
本题考查学生元素周期律的应用知识,难度不大,注意掌握元素的最高正价+|最低负价|=8,根据化学式计算元素化合价。
知识点
10.近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关。与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象。臭氧浓度升高是光化学烟雾形成的标志。请回答下列相关问题:
(1).以下可能引起细颗粒物指标变高的是 (填序号)。
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2).下图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值。 随后NO2约于10:00 达峰值,其主要反应的方程式可能为 。 8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应: 产生的。O3又使10:00前NO2的含量急剧增加,其化学方程式为 。你认为该地光化学烟雾较严重的时间最可能为 (填序号)。
a.8:00 b.10:00 c.15:00 d.20:00
(3).若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为 ,N2O4的分解率(即转化率)为 。(计算结果均保留三位有效数字)。
(4).NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题。NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq) 
据表知,将溶液稀释至原体积的2倍,反应速度将变为原来的 。
正确答案
(1) abdef
(2) 2NO+O2=2NO2 NO2=NO+O O3+NO=NO2+O2 c
(3) 77.9g/mol 18.1%
(4) 升温、增大反应物浓度 1/4
解析
(1)燃煤取暖、大型交通设备、火山喷发、局部战争、采矿业可能引起细颗粒物指标变高,故选abdef。
(2) NO和氧气反应生成的NO2约于10:00 达峰值,其主要反应的方程式可能为2NO+O2=2NO2。
8:00起,O3开始积累,并于13:00达峰值,NO2明显减少,O3积累与NO2有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应NO2=NO+O产生的。
O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2。
臭氧浓度升高是光化学烟雾形成的标志,该地光化学烟雾较严重的时间最可能为15:00,故选c。
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为3.18 g/L×24.5L/mol=77.9g/mol;
假设N2O4的物质的量为1mol,N2O4的分解率(即转化率)为x
N2O4 = 2NO2
1mol 0
(1-x) mol 2x mol
92g/((1-x) mol+2x mol)=77.9g/mol x=18.1%,N2O4的分解率(即转化率)为18.1%。
(4)将相关实验数据带入ν =k·c(NH4+)x·c(NO2-)y,可得x=1,y=1,k=2.7×10-4,将溶液稀释至原体积的2倍,c(NH4+)和c(NO2-)变为原来的1/2,反应速度将变为原来的1/4。
考查方向
解题思路
(1)燃煤取暖、大型交通设备、火山喷发、局部战争、采矿业可能引起细颗粒物指标变高。
(2)NO和氧气反应生成的NO2约于10:00 达峰值,其主要反应的方程式可能为2NO+O2=2NO2。
8:00起,O3开始积累,并于13:00达峰值,NO2明显减少,O3积累与NO2有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应NO2=NO+O产生的。
O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2。
臭氧浓度升高是光化学烟雾形成的标志,该地光化学烟雾较严重的时间最可能为15:00。
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为3.18 g/L×24.5L/mol=77.9g/mol;
假设N2O4的物质的量为1mol,N2O4的分解率(即转化率)为x
N2O4 = 2NO2
1mol 0
(1-x) mol 2x mol
92g/((1-x) mol+2x mol)=77.9g/mol x=18.1%,N2O4的分解率(即转化率)为18.1%。
(4)将相关实验数据带入ν =k·c(NH4+)x·c(NO2-)y,可得x=1,y=1,k=2.7×10-4,将溶液稀释至原体积的2倍,c(NH4+)和c(NO2-)变为原来的1/2,反应速度将变为原来的1/4。
易错点
本题解题的关键是第(4)题,通过计算先求出相关未知数的值。
知识点
8.一定条件下,向可变容积的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g)
(1)该条件下,反应的平衡常数表达式K = ,若降低温度,K值将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将___(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将 (填“增大”“减小”或“不变”),理由是___________________________。
(3)达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将_______(填“增大”、“减小”或“不变”)。
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图。下列说法正确的是 (填序号)。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2
(5)常压下,把H2和用He稀释的N2分别通入一个570℃的电解池装置(下图),H2和N2便可在电极上合成氨,装置中的电解质(图中黑细点处)能传导H+,则阴极的电极反应式为___________。
正确答案
(1)c2(NH3)/c(N2)·c3(H2) 增大
(2)正 不变 K只与温度有关
(3)减小
(4)b
(5)N2+6e-+6H+=2NH3
解析
(1)该条件下,反应的平衡常数等于生成物浓度的幂之积和反应物浓度的幂之积的比值,表达式K =c2(NH3)/c(N2)·c3(H2),该反应是放热反应,若降低温度,反应向正方向进行,K值将增大。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,压强增大,平衡将体积缩小的方向进行,即向正反应方向移动,平衡常数K只随着温度的变化而变化,平衡常数将不变。
(3)达到平衡后,在恒压条件下,向容器中通入氦气(He),气体体积增大,反应逆向进行,氮气的转化率将减小。
(4)a.图Ⅰ如果是不同压强对反应的影响,P2>P1,P2时氨的体积分数ω大,不合题意,a错误;
b.催化剂可以加快化学反应速率,不能改变平衡转化率,催化剂1更能加快化学反应速率,催化性能1>2,b正确;
c.图Ⅲ可能是不同温度对反应的影响,该反应是放热反应,温度升高,平衡向逆反应方向进行,T2>T1,c错误。
故选b。
(5)由图可知,氮气放电生成氨气,在电解池中,阴极发生得电子的还原反应,阴极的电极反应式为N2+6e-+6H+=2NH3。
考查方向
解题思路
(1)该条件下,反应的平衡常数等于生成物浓度的幂之积和反应物浓度的幂之积的比值,表达式K =c2(NH3)/c(N2)·c3(H2),该反应是放热反应,若降低温度,反应向正方向进行,K值将增大。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,压强增大,平衡将体积缩小的方向进行,即向正反应方向移动,平衡常数K只随着温度的变化而变化,平衡常数将不变。
(3)达到平衡后,在恒压条件下,向容器中通入氦气(He),气体体积增大,反应逆向进行,氮气的转化率将减小。
(4)a.图Ⅰ如果是不同压强对反应的影响,P2>P1,P2时氨的体积分数ω大;
b.催化剂可以加快化学反应速率,不能改变平衡转化率,催化剂1更能加快化学反应速率,催化性能1>2;
c.图Ⅲ可能是不同温度对反应的影响,该反应是放热反应,温度升高,平衡向逆反应方向进行,T2>T1。
故选b。
(5)由图可知,氮气放电生成氨气,在电解池中,阴极发生得电子的还原反应,阴极的电极反应式为N2+6e-+6H+=2NH3。
易错点
本题考查化学反应速率、化学平衡及原电池原理等,题目难度中等,明确影响反应速率及平衡的外界因素即可解答,该题是高考中的常见题型,在注重对学生基础知识训练和检验的同时,侧重对学生答题能力的培养和方法与技巧的指导和训练。
知识点
9.纳米ZnO在催化、医药及橡胶等新材料方面有广阔的应用前景,下面是制备纳米ZnO的相关工艺流程,试回答有关问题:
已知:Ksp[Zn(OH)2]=4.5×10-17,且Zn(OH)2具有两性。
(1)试剂A是_____,试剂B是______,步骤I生成BaSO4的离子方程式是 。
(2)步骤II中,pH应调节至 (填序号)。
a.3~5 b.5 c.8~9 d.12~14
(3)步骤II中“回流”时必须用到下列仪器中的 (填序号)。
a.分液漏斗 b.温度计 c.空气冷凝管 d.球形冷凝管
(4)已知,在实验室中用200 mL 0.25 mol/L ZnSO4溶液与50 mL 8mol/L的试剂A
反应,则加入固体试剂B的质量为 (计算结果保留小数点后一位)。
(5)步骤II在加热回流的同时,要蒸出 (填物质名称),该物质可循环使用。
(6)纳米ZnO也可以用以下流程制备(其中反应②生成了两种碳的化合物)。

正确答案
(1)氨水 Ba(OH)2 Ba2++SO42-=BaSO4↓
(2)c
(3)d
(4)8.6g
(5)氨气
(6)H2C2O4+ZnCl2+2H2O=ZnC2O4·2H2O+2HCl ZnC2O4·2H2O=ZnO+CO↑+CO2↑+2H2O
解析
ZnSO4加入氨水后,生成四氨合锌络离子,加入Ba(OH)2,反应生成硫酸钡白色沉淀,搅拌、减压过滤,调节滤液pH,回流、加热,得氢氧化锌沉淀,煅烧、干燥、洗涤得氧化锌。据此答题:
(1)试剂A是氨水,试剂B是氢氧化钡,步骤I生成BaSO4的离子方程式是Ba2++SO42-=BaSO4↓;
(2)Ksp[Zn(OH)2]=4.5×10-17,(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全),OH-浓度为
(3)球形冷凝管一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底。
(4)在实验室中用200 mL 0.25 mol/L ZnSO4溶液与50 mL 8mol/L的试剂氨水反应,加入固体试剂氢氧化钡除去硫酸根离子,加入氢氧化钡的质量为200 mL×0.25 mol/L×171g/mol=8.6g 。
(5)步骤II在加热回流的同时,要蒸出氨气,该物质可循环使用。
(6)①H2C2O4和ZnCl2反应生成ZnC2O4·2H2O;
② ZnC2O4·2H2O受热分解生成ZnO和两种碳的化合物CO和CO2。
考查方向
解题思路
ZnSO4加入氨水后,生成四氨合锌络离子,加入Ba(OH)2,反应生成硫酸钡白色沉淀,搅拌、减压过滤,调节滤液pH,回流、加热,得氢氧化锌沉淀,煅烧、干燥、洗涤得氧化锌。据此答题:
(1)试剂A是氨水,试剂B是氢氧化钡,步骤I生成BaSO4的离子方程式是Ba2++SO42-=BaSO4↓;
(2)Ksp[Zn(OH)2]=4.5×10-17,(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全),OH-浓度为
(3)球形冷凝管一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底。
(4)在实验室中用200 mL 0.25 mol/L ZnSO4溶液与50 mL 8mol/L的试剂氨水反应,加入固体试剂氢氧化钡除去硫酸根离子,加入氢氧化钡的质量为200 mL×0.25 mol/L×171g/mol=8.6g 。
(5)步骤II在加热回流的同时,要蒸出氨气,该物质可循环使用。
(6)①H2C2O4和ZnCl2反应生成ZnC2O4·2H2O;
② ZnC2O4·2H2O受热分解生成ZnO和两种碳的化合物CO和CO2。
易错点
本题属于信息习题,学生应注重习题信息和所学知识相结合来解答本题,并注意质量守恒定律、化学方程式等来解答。
知识点
11.[化学——选修2:化学与技术]
软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为_______________。
(2)现代冶炼金属锰的一种工艺流程如下图所示:
下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4 = 12MnSO4+6CO2↑+18H2O
①该反应中,还原剂为_______。写出一种能提高还原浸出速率的措施:_______。
②滤液1的pH_______(填“大于”、“小于”或“等于”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)。
(3)由MnSO4制取MnCO3:往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为____________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)
正确答案
(1)8Al + 3Mn3O4
(2)①C6H12O6 升高反应温度(或将软锰矿研细等其他合理答案)
②> (2’)
③Ca2+
(3)Mn2++2HCO3-=MnCO3↓+ H2O + CO2↑ 100
解析
(1)高温下,Al和Mn3O4发生铝热反应生成Mn,根据反应物、生成物及反应条件书写方程式为8Al + 3Mn3O4
(2)软锰矿还原浸出得到硫酸锰溶液,说明浸取液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的PKsp为37.4与其它离子相比最大,调节pH可以将 Fe(OH)3沉淀下来,向滤液中加入硫化铵,CuS的pKsp为35.2,可以将铜离子形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后对得到的含有锰离子的盐电解,可以得到金属锰,
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O,该反应中,Mn元素化合价由+4价变为+2价、C元素化合价由0价变为+4价,失电子化合价升高的反应物是还原剂,所以C6H12O6为还原剂;反应物接触面积越大、温度越高反应速率越快,所以能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等;
②软锰矿还原浸出的反应为:12MnO2+ C6H12O6+12H2SO4=12MnSO4+CO2↑+18H2O,溶液呈强酸性,还原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此时未形成沉淀, pKsp=-1gKsp,pKsp越大,沉淀溶解平衡常数越小,滤液1为形成Fe(OH)3沉淀,pKsp=-1gKsp=37.4,Ksp=10-37.4,Ksp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,所以滤液1的pH大于MnSO4浸出液的pH才能形成氢氧化铁沉淀,故答案为:>;
③CaF2难溶于水,滤液2中含有Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的是形成CaF2沉淀,除去Ca2+;
(3)锰离子和碳酸氢根离子反应生成碳酸锰沉淀、水和二氧化碳气体,离子方程式为
Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;
由MnCO3(s) + 2OH-(aq)
K=


考查方向
解题思路
(1)高温下,Al和Mn3O4发生铝热反应生成Mn,根据反应物、生成物及反应条件书写方程式为8Al + 3Mn3O4
(2)软锰矿还原浸出得到硫酸锰溶液,说明浸取液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的PKsp为37.4与其它离子相比最大,调节pH可以将 Fe(OH)3沉淀下来,向滤液中加入硫化铵,CuS的pKsp为35.2,可以将铜离子形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后对得到的含有锰离子的盐电解,可以得到金属锰,
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O,该反应中,Mn元素化合价由+4价变为+2价、C元素化合价由0价变为+4价,失电子化合价升高的反应物是还原剂,所以C6H12O6为还原剂;反应物接触面积越大、温度越高反应速率越快,所以能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等;
②软锰矿还原浸出的反应为:12MnO2+ C6H12O6+12H2SO4=12MnSO4+CO2↑+18H2O,溶液呈强酸性,还原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此时未形成沉淀, pKsp=-1gKsp,pKsp越大,沉淀溶解平衡常数越小,滤液1为形成Fe(OH)3沉淀,pKsp=-1gKsp=37.4,Ksp=10-37.4,Ksp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,所以滤液1的pH大于MnSO4浸出液的pH才能形成氢氧化铁沉淀;
③CaF2难溶于水,滤液2中含有Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的是形成CaF2沉淀,除去Ca2+;
(3)锰离子和碳酸氢根离子反应生成碳酸锰沉淀、水和二氧化碳气体,离子方程式为
Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;
由MnCO3(s) + 2OH-(aq)
K=


易错点
本题是一道实验方案设计的工艺流程题目,考查学生各方面的综合知识能力,难度大。