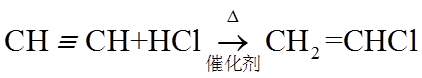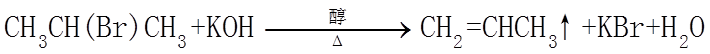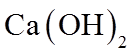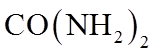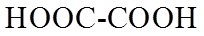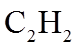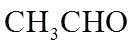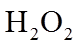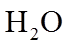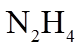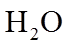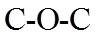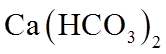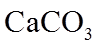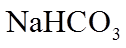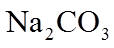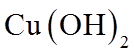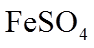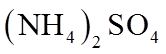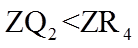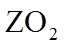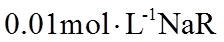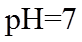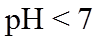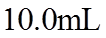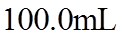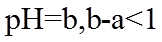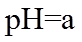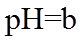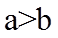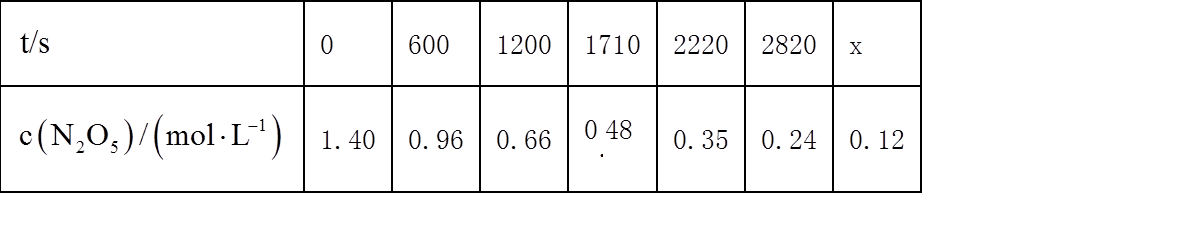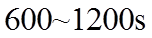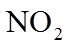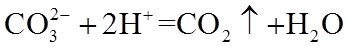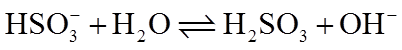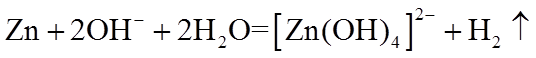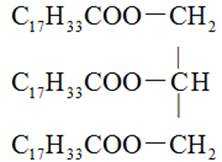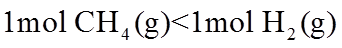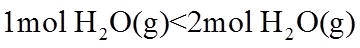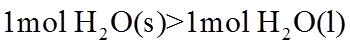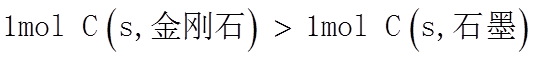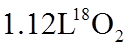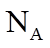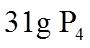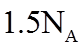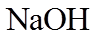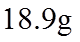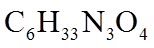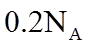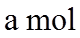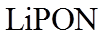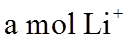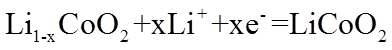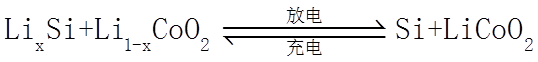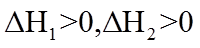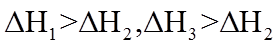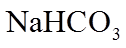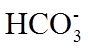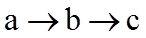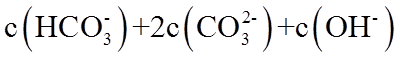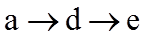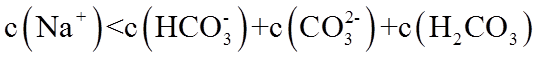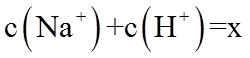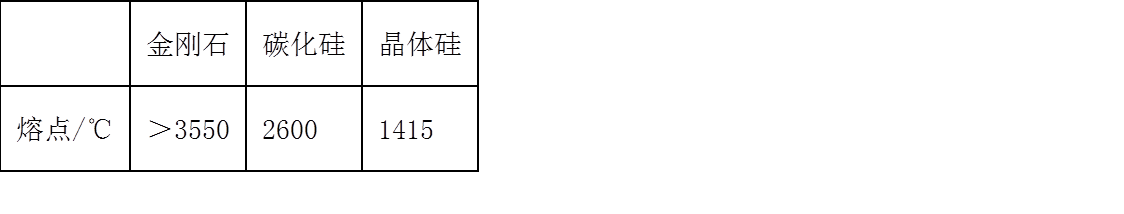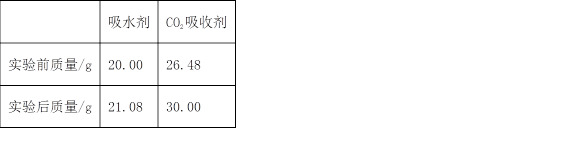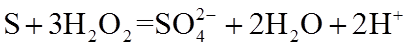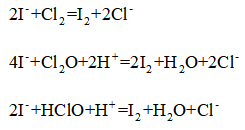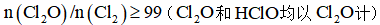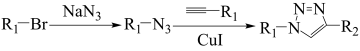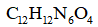- 真题试卷
- 模拟试卷
- 预测试卷
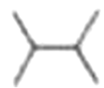
1. 下列物质属于纯净物的是
正确答案
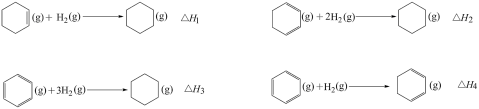
7. 关于有机反应类型,下列判断不正确的是
正确答案
9. 下列说法不正确的是
正确答案
10. 下列说法不正确的是
正确答案
2. 下列物质属于弱电解质的是
正确答案
3. 下列物质的化学成分不正确的是
正确答案
5. 下列表示不正确的是
正确答案
4. 下列图示表示灼烧操作的是
正确答案
6. 下列说法正确的是
正确答案
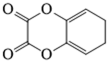
8. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是
正确答案
12. 下列“类比”结果不正确
正确答案
11. 下列说法正确的是
正确答案
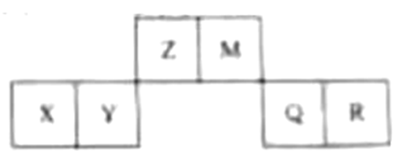
15. 已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是
正确答案
19. 某同学拟用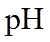
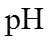
正确答案
20. 一定温度下:在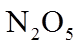
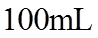
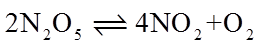


下列说法正确的是
正确答案
13. 不能正确表示下列变化的离子方程式是
正确答案
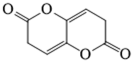
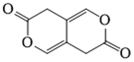
14. 关于油脂,下列说法不正确的是
正确答案
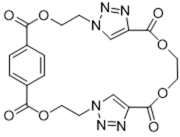
16. 关于化合物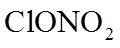
正确答案
17. 相同温度和压强下,关于物质熵的大小比较,合理的是
正确答案
18. 设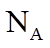
正确答案
22. 某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时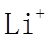
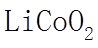
正确答案
25. 下列方案设计、现象和结论都正确的是
正确答案
21. 相同温度和压强下,关于反应的
正确答案
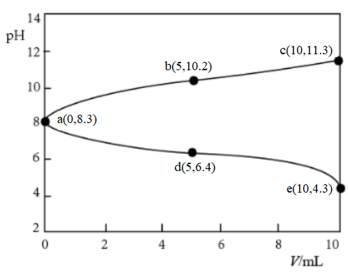
23. 取两份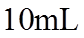
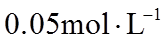
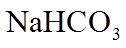
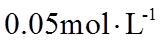
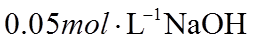
下列说法不正确的是
正确答案
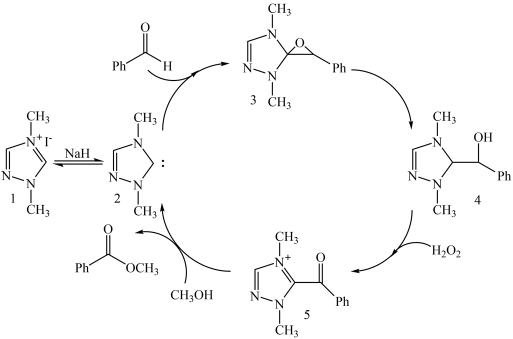
24. 制备苯甲酸甲酯的一种反应机理如图(其中Ph-代表苯基)。下列说法不正确的是
正确答案
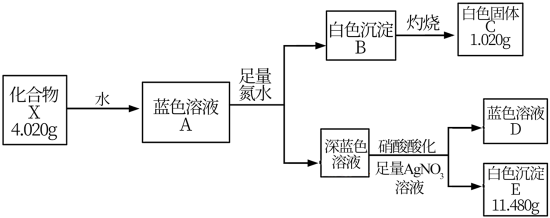
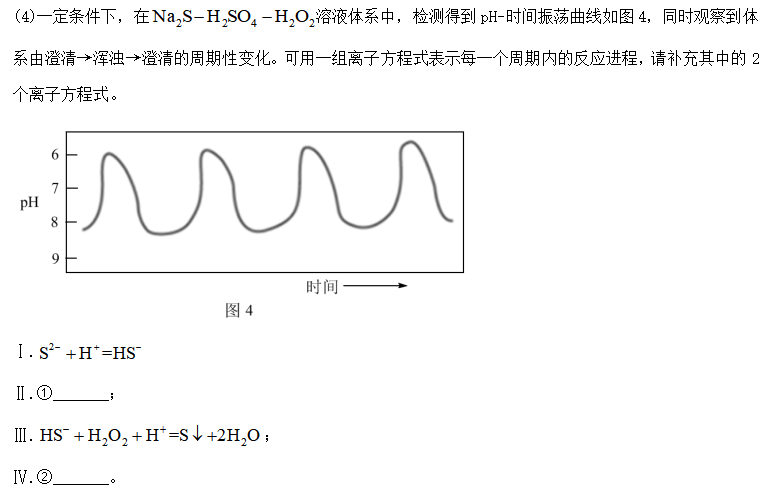
28. 固体化合物X由3种元素组成,某学习小组开展如下探究实验。
其中,白色沉淀B能溶于NaOH溶液。请回答:
(1)白色固体C的化学式是_______,蓝色溶液D中含有的溶质是_______(用化学式表示)。
(2)化合物X的化学式是_______;化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式_______。
(3)蓝色溶液A与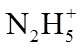
①写出该反应的离子方程式_______。
②设计实验验证该白色沉淀的组成元素_______。
正确答案
(1). 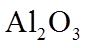

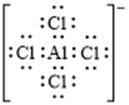
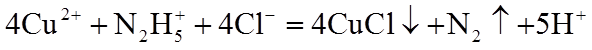
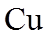
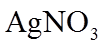
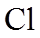
26. (1)已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是_______。
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_______。
正确答案
(1). 原子半径C<Si(或键长C-C<Si-Si),键能C-C>Si-Si (2). 当调节溶液pH至甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小
27. 将3.00g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:
请回答:
(1)燃烧产物中水的物质的量为_______mol。
(2)该有机物的分子式为_______(写出计算过程)。
正确答案
(1). 0.0600 (2). C4H6O6
29. 含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量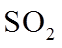
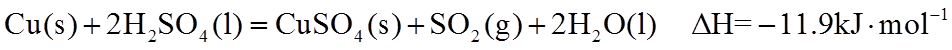
(2)已知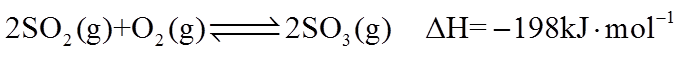
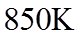
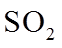
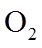

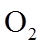


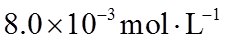
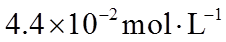
①该温度下反应的平衡常数为_______。
②平衡时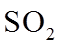
(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法正确的是_______。
正确答案
(1). 不同温度下都能自发,是因为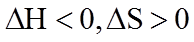
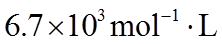
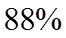
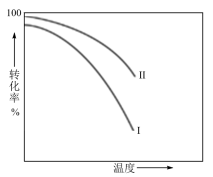
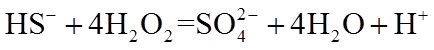
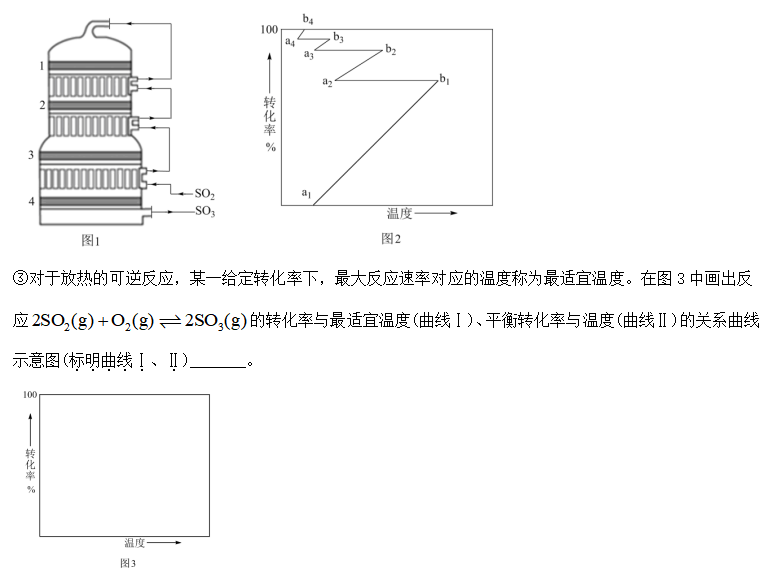
30. 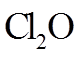
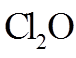
①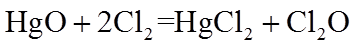
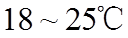
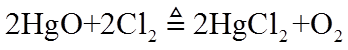
②常压下,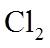
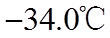
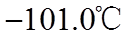
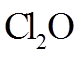

③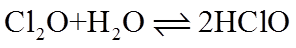
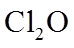
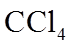
请回答:
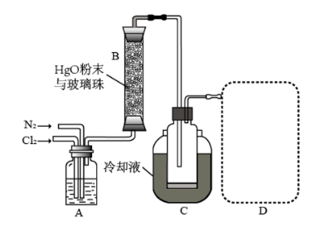
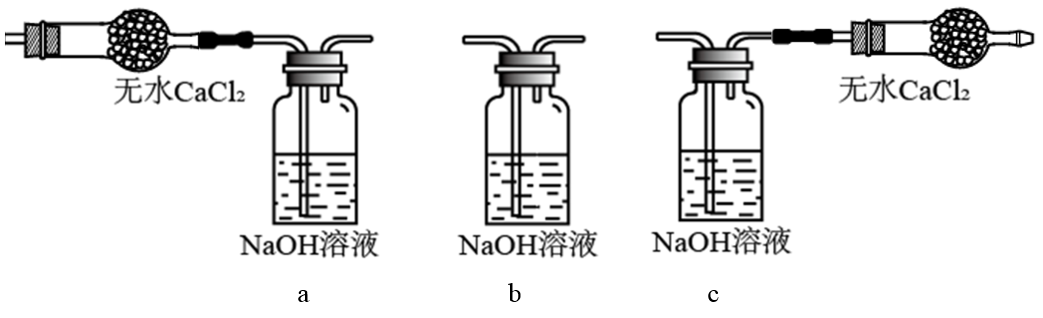
(1)①装置A的作用是去除原料气中的少量水分,可用的试剂是_______。
②将上图中装置组装完整,虚框D中应选用_______。
(2)有关反应柱B,须进行的操作是_______。
A.将HgO粉末热处理除水分、增加表面积后填入反应柱
B.调控进入反应柱的混合气中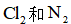
C.调控混合气从下口进入反应柱的流速
D.将加热带缠绕于反应柱并加热
(3)装置C,冷却液的温度通常控制在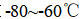
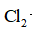
(4)将纯化后的
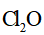
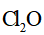
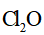
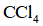
针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→_______→_______→e→d→f→_______。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和
c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
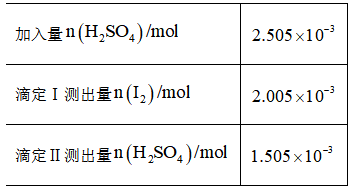
(5)产品分析:取一定量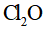
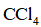
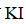
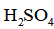
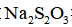

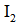
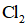
实验数据如下表:
①用标准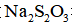
②高纯度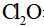
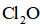
正确答案
(1). 浓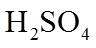
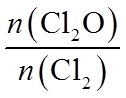
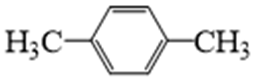
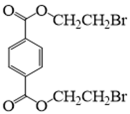
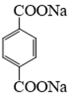
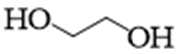
31. 某课题组研制了一种具有较高玻璃化转变温度的聚合物P,合成路线如下:
已知:
请回答:
(1)化合物A的结构简式是_______;化合物E的结构简式是_______。
(2)下列说法不正确的是_______。
A.化合物B分子中所有的碳原子共平面
B.化合物D的分子式为
C.化合物D和F发生缩聚反应生成P
D.聚合物P属于聚酯类物质
(3)化合物C与过量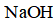
(4)在制备聚合物P的过程中还生成了一种分子式为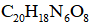
(5)写出3种同时满足下列条件的化合物F的同分异构体的结构简式(不考虑立体异构体):_______。
①谱显示只有2种不同化学环境的氢原子
②只含有六元环
③含有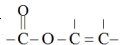
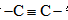
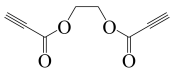
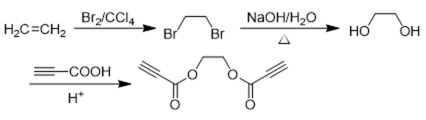
(6)以乙烯和丙炔酸为原料,设计如下化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)_______。
正确答案
(1).