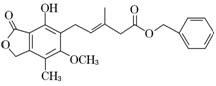- 真题试卷
- 模拟试卷
- 预测试卷
1.光电池(Solar cell)可用作计算器、人造卫星的动力,如图所示。下列分析正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.下列化学用语的表述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.下列说法中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列各选项中所述的两个量,前者一定大于后者的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.有关下图所示化合物的说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列化学反应的离子方程式正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.用NA表示阿伏加德罗常数的值。下列叙述中错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2
②CH3CH2Br+NaOH
③CH3COOCH2CH3+H2O 
④C6H5OH+3H2
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.利用下列实验器材(规格和数量不限),不能完成相应实验的选项是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.已知反应X(g)+Y(g) 
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.如图用石墨作电极的电解池中,放入某足量蓝色溶液500mL进行电解,观察到A电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6g。下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列鉴别实验中,所选试剂不合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.根据下列实验现象,所得结论错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,产物有HF、NO和HNO3。下列关于该反应的说法中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
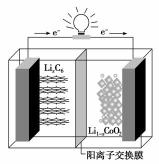
18.某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6=6C+LiCoO2,其电池如图所示。下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
21.分子式为C8H8O2,分子结构中含有苯环且能够发生水解反应的有机物有(不考虑立体异构)( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
22.某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.已知氧化性:Br2>Fe3+>I2,向含有a mol FeI2的溶液中加入含b mol Br2的溴水,下列判断或相应的离子方程式正确的是(忽略离子的水解)( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
②下列能提高碳的平衡转化率的措施是( ) 。
A.加入C(s)
B.加入
C.升高温度
D.增大压强
(2)将


① X在

② Y在时

③ Z在

已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是( )(填“X”或“Y”或“Z”),选择的理由是( )。
(3)合成气经压缩升温后进入
反应是:
已知:
①上述反应中△H1=( )
②

比较此时正、逆反应速率的大小:v正( )v逆 (填“>”、“<”或“=”)。
③若加入等物质的量的CO、





(4)生产过程中,合成气要进行循环,其目的是( )。
正确答案
(1)
①
②BC
(2)Z ,催化效率高且活性温度低(或催化活性高速度快,反应温度低产率高)
(3)
①-129.6
② >
③0.03 mol·L-1·min-1。
(4)提高原料CO、H2的利用率(或提高产量、产率亦可)。
解析
解析已在路上飞奔,马上就到!
知识点
28.以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为( )、( )。
(2)“滤渣1”的化学式为( )。
(3)在“滤液1”中加入盐酸的目的是( )。“滤渣2”的化学式为( )。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为( )。
正确答案
(1)Mg (OH)2 CaCO3
(2)NaHCO3
(3)除去HCO3- (多答“使更多的Na+形成NaCl析出,提高NH4Cl的纯度”不扣分)
NaCl
(4)NaHCO3+SO2 = NaHSO3+ CO2
解析
解析已在路上飞奔,马上就到!
知识点
29.Ⅰ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式:( )。
(3)研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
①装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有( )。
②实验中要持续通入氮气,否则测出的x会( )(填“偏大”、“偏小”或“不变”)。
硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
③从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式( )。
④装置D球形干燥管的作用( ) 。
⑤某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=( )。
II.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为( )。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为( )。
正确答案
I.
(1)32
(2)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(3)
①SO2
②偏小
③2FeSO4
④吸收尾气并防倒吸
⑤x= 7
Ⅱ.Mn2+-2e一+2H2O=MnO2+4H+ Pb+PbO2+2H2SO4=2PbSO4+2H2O
解析
解析已在路上飞奔,马上就到!
知识点
26.短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性。回答下列问题:
(1)A的氢化物的电子式是( )。
(2)下列叙述中,正确的是( )(填字母)。
a.稳定性:A的氢化物>C的氢化物
b.还原性:B2->D2-
c.酸性:H4CO4>H2DO4
d.最高化合价:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。
①根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到( ),证明分离效果较好。
②在原电池中,负极发生的反应式为( )。
③在电解过程中,电解槽阴极附近溶液pH( )(填“变大”、“变小”或“不变”)。
④将该工艺流程用总反应的化学方程式表示为:( );该生产工艺的优点有( )(答一点即可)。
⑤某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是( )mol·L-1。
正确答案
(1)
(2)a
(3)①无淡黄色沉淀产生,最终生成白色沉淀
②SO2+2H2O-2e-=4H++SO42-
③变大
④SO2+2H2O=H2SO4+H2 溴可以循环利用;获得清洁能源氢气;原电池产生的能源可供电解池使用,节约能源。
⑤0.001
解析
解析已在路上飞奔,马上就到!