- 真题试卷
- 模拟试卷
- 预测试卷
4.下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列结论正确的是( )
①微粒半径:S
②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S


④单质氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥分散系中分散质粒子的直径:Fe (OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.设NA为阿伏加德罗常数的值。下列有关叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列离子方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如下图所示),经过一段时间后,首先观察到溶液变红的区域是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.用惰性电极电解某溶液时,发现两极只有H2和O2生成,若电解前后温度变化忽略不计,则电解一段时间后,下列有关溶液的叙述正确的是( )
①该溶液的pH可能增大
②该溶液的pH可能减小
③该溶液的pH可能不变
④该溶液的浓度可能增大
⑤该溶液的浓度可能不变
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.将标准状况下的某气体(摩尔质量为
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列事实不能用勒夏特列原理解释的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.500mL KNO3和Cu(NO3)2的混合溶液中c(NO
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.可逆反应:3A
①B和C可能都是固体
②B和C一定都是气体
③若C为固体,则B一定是气体
④B和C可能都是气体
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.取pH值均等于1的盐酸和醋酸各100mL分别加水稀释到10倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.单斜硫和正交硫转化为二氧化硫的能量变化如图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.在相同的甲乙两密闭容器中,在相同温度下发生反应:N2(g)+3H2(g)===2NH3(g);△H =-QkJ·mol-1 (Q>0)。保持T.V恒定,向甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.对下列装置,不添加其他仪器无法检查气密性的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
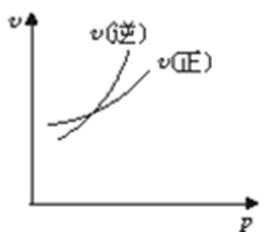
14.对于可逆反应A(g)+2B(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
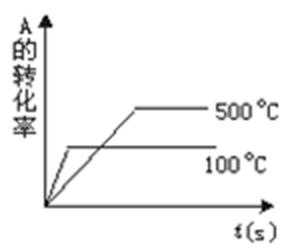
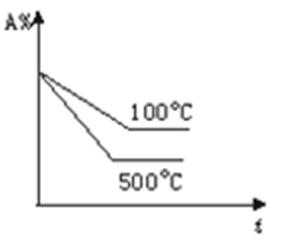
18.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应: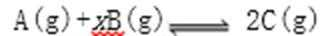
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.在298K时,NaCl在水中的溶解度为36g/100g水。如将0.5molNaCl溶解在1L水中,此溶解过程中体系的△H-T△S和熵如何变化( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g氧气中燃烧,至反应物耗尽,共放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是_________________,其相应的质量分别为_____________________。
(2)已知1molP在足量氧气中充分燃烧放热Y kJ。写出1molP与O2反应生成固态P2O3的热化学方程式:_______________________________。
正确答案
(1)P2O3 P2O5 2.75g 3.55g
(2)
解析
解析已在路上飞奔,马上就到!
知识点
21.如图所示,关闭阀门k,向甲中充入1.5molA.3.5molB,向乙中充入3molA.7molB,起始时,甲、乙的体积均为VL。在相同温度和有催化剂存在的条件下,两 容器中均发生下列反应:3A(g)+2B(g)===C(g)+2D(g);
(1)乙中B的转化率为_________;
(2)甲中D和乙中D的物质的量比较________(填“相等”.“前者大”.“后者大”);
(3)打开K,过一段时间再次重新达平衡时,乙的体积为___________(用含V的代数式表示,连通管中气体体积忽略不计)。
正确答案
(1)20%
(2)后者大
(3)0.29VL
解析
解析已在路上飞奔,马上就到!
知识点
20.电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A.B.C.D均为惰性电极,开始电解前在甲装置的A.B极两侧各滴入酚酞试液。工作一段时间后:
(1)A极附近可观察到的现象是________________________;
检验B电极上反应产物的通常方法是_____________;
甲电池中电解反应的离子方程式是 ________________________;
溶液中还可能存在的离子反应方程式是 ____________________________。
(2)甲槽溶液的pH________(填“增大”.“不变”或 “减小”,下同);乙槽溶液的pH________。当A极上收集到22.4L气体(标准状况)时,乙装置的C极上可得到______g金属单质。
利用A.D两极上析出的物质制成的燃料电池,是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答(3)~(6):
(3)氢氧燃料电池的能量转化主要形式是_______,在导线中电子流动方向为_______(用a.b 表示)。
(4)负极反应式为____________。
(5)电极表面镀铂粉的原因为__________
(6)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
①反应Ⅰ中的还原剂是_______,反应Ⅱ中的氧化剂是_______。
②先用锂吸收224L(标准状况)H2,将生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为_______mol。
正确答案
(1)有无色无味的气体产生,溶液由无色变浅红色
将湿润的淀粉KI试纸放在B极附近,试纸变蓝
(2)增大 减小 64
(3)由化学能转化为电能 由a到b
(4)
(5) 增大电极单位面积吸附H2、O2的分子数,加速电极反应速率
(6) ①Li H2O ② 32
解析
解析已在路上飞奔,马上就到!
知识点
22.有如下化学反应:2A(g)+B(g)===2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;反应的平衡常数为_______________(保留两位有效数字);若升高反应温度,该反应的平衡常数_______(填“增大”.“减小”或“不变”);
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_______________(保留三位有效数字);若再通入少量B气体,体系中A的体积分数_____________(填“增大”.“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有_____________________________;
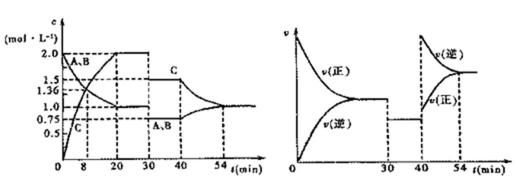
(4)下图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间段是_________________________________,t2时曲线发生变化的原因是_________________________________。
若在t4时将B的浓度增大0.lmol·L-1,请在下图中画出各物质浓度在t4以后的变化情况。
正确答案
(1)0.3mol·L-1·S-1 0.26 L·mol-1 减小
(2) 
(3)85.7% 减小 升高温度、充入A气体、减小压强
(4)t1-t2 t3-t4 降低温度
图像(见下图变化趋势正确,且注意量的比例)
解析
解析已在路上飞奔,马上就到!
知识点
23.某研究小组用下列装置探究SO2与酸性Fe(NO3)3溶液的反应。
请回答:
(1)装置A中反应的化学方程式是_______________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有_________性。
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学:在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是__________________,
证明该观点应进一步确认生成的新物质,其实验操作及现象是________________________。
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相
同条件下进行实验。应选择的试剂是(填序号) _________。
正确答案
(l)
(2) 打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹
(3) BaS04 还原性
(4)
取少量B中溶液于试管中,加入适量氢氧化钠溶液,开始产生白色沉淀,白色沉淀
迅速变成灰绿色,最终变为红褐色
② c
解析
解析已在路上飞奔,马上就到!