- 真题试卷
- 模拟试卷
- 预测试卷
7.下列过程属于物理变化的有( )
①石油分馏得到汽油
②煤通过干馏获得焦炭
③用铝土矿冶炼铝
④用海带提取碘单质
⑤空气液化
⑥白酒变酸
⑦粉尘爆炸
⑧干冰气化
⑨同素异形体之间的互变
⑩氯化钠溶液通电后导电
⑪活性炭使红墨水褪色
⑫新制氯水使有色布条褪色
正确答案
解析
①石油分馏得到汽油,利用沸点不同,加以分离,没有新物质生成的变化,是物理变化;
②煤通过干馏获得焦炭,干馏是在高温条件下反应,有新物质生成的变化,是化学变化;
③用铝土矿冶炼铝,有新物质生成的变化,是化学变化;
④用海带提取碘单质, 有新物质生成的变化,是化学变化;
⑤空气液化,没有新物质生成的变化,是物理变化;
⑥白酒变酸,有新物质生成的变化,是化学变化;
⑦粉尘爆炸,有新物质生成的变化,是化学变化;
⑧干冰气化,没有新物质生成的变化,是物理变化;
⑨同素异形体之间的互变,有新物质生成的变化,是化学变化;
⑩氯化钠溶液通电后导电,没有新物质生成的变化,是物理变化;
⑪活性炭使红墨水褪色,没有新物质生成的变化,是物理变化;
⑫新制氯水使有色布条褪色,有新物质生成的变化,是化学变化;
属于物理变化的有①、⑤、⑧、⑩、⑾共计5个。
故选C。
考查方向
解题思路
化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。
易错点
本题考查物理变化与化学变化的判断,难度不大.要注意化学变化和物理变化的本质区别是否有新物质生成。
知识点
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
正确答案
解析
A.在过氧化钠与水发生歧化反应中,每生成0.1mol氧气,转移电子的数目为0.2NA,A错误。
B.标准状况下22.4L气体的物质的量为1mol,氢氧燃料电池的正极发生还原反应,正极为氧气,所以1mol氧气完全反应得到4mol电子,根据电子守恒,电路中通过的电子数目为4NA,B错误;
C.3.2 g O2的氧原子物质的量n=m/M=3.2g/16g/mol=0.2mol,3.2 g O3的氧原子物质的量n=m/M=3.2g/16g/mol=0.2mol,故3.2 g O2和3.2 g O3中所含氧原子数都是0.2 NA,C正确;
D.这是一个可逆反应,2NO2=N2O4,反应放热,降温,平衡正向移动,在恒压条件下体积会小于22.4L,D错误。
故选C。
考查方向
解题思路
A.在过氧化钠与水发生歧化反应中,每生成0.1mol氧气,转移电子的数目为0.2NA。
B.标准状况下22.4L气体的物质的量为1mol,氢氧燃料电池的正极发生还原反应,正极为氧气,所以1mol氧气完全反应得到4mol电子,根据电子守恒,电路中通过的电子数目为4NA;
C.3.2 g O2的氧原子物质的量n=m/M=3.2g/16g/mol=0.2mol,3.2 g O3的氧原子物质的量n=m/M=3.2g/16g/mol=0.2mol,故3.2 g O2和3.2 g O3中所含氧原子数都是0.2 NA;
D.这是一个可逆反应,2NO2=N2O4,反应放热,降温,平衡正向移动,在恒压条件下体积会小于22.4L。
易错点
本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确过氧化钠中的阴离子为过氧根离子,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,正确分析反应或者的化合价变化为解答本题关键。
知识点
11. X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是( )
正确答案
解析
X的原子半径在短周期主旋元素中最大,应为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素,W元素与Z元素同主族,应为C元素,R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,应为S元素,依据分析可知:X为钠、Y为氧、Z为硅、W为碳、R为硫。
A.X与Y形成的两种化合物分别为Na2O、Na2O2,两种化合物中阴、阳离子的个数比均为1:2,故A正确;
B.Y是O元素,R是S元素,元素的非金属性越强其氢化物越稳定,氧元素的非金属性大于硫元素,所以水的稳定性大于硫化氢,且水中含有氢键,沸点高,故B正确;
C.非金属性:S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.SO2、CO2对应的酸的酸性比盐酸弱,与氯化钡都不反应,故D错误;
故选D。
考查方向
解题思路
X的原子半径在短周期主旋元素中最大,应为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素,W元素与Z元素同主族,应为C元素,R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,应为S元素,结合元素对应单质、化合物的性质以及元素周期律可解答该题。
易错点
本题考查原子结构和元素周期律的递变规律,题目难度中等,根据原子结构特点正确推断元素的种类为解答该题的关键,注意元素非金属性的比较。
知识点
12.A1/MnO4–电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示。已知电池总反应为Al+ MnO4–+2H2O=Al(OH)4-+MnO2。下列说法正确的是( )
正确答案
解析
A.电池工作时,K+向正极移动,A错误;
B.电池工作时,Al电极的电极反应式:Al+4OH–-3e- = Al(OH)4-,氢氧根离子减少,周围溶液pH减小,B错误;
C.正极反应MnO4–得电子,电极反应式为:MnO4–+2H2O+3e一= MnO2+4OH–,C正确;
D.电池工作时,电子由Al经外电路流向Ni,D错误。
故选C。
考查方向
解题思路
A1/MnO4–电池是一种高能电池,以Ga2O3为缓蚀剂。已知电池总反应为Al+ MnO4–+2H2O=Al(OH)4-+MnO2。Al为负极,失去电子,生成Al(OH)4-;Ni为正极,MnO4–得到电子,生成MnO2;
易错点
D中注意电池工作时电子由Al经外电路流向Ni。
知识点
13.常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示。下列说法不正确的是( )
正确答案
解析
A.点③溶液中,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可知:c(Na+)
B.点①溶液的是等浓度的CH3COOH和CH3COONa,点②溶液的是等浓度的HCN和NaCN,HCN的电离平衡常数
C.点④溶液中是CH3COONa溶液,醋酸根离子水解,溶液显碱性,因此:c(Na+)>c(CH3COO–)>c(OH–)>c(H+),C正确;
D.在点②和③之间(不包括端点),c(CH3COO-)>c(CH3COOH),醋酸的电离平衡常数大于醋酸根离子的水解平衡常数,因此:c(CH3COO–)>c(Na+),溶液的pH<7,因此:c(H+)>c(OH–),综上所述,存在离子浓度大小关系:c(CH3COO–)>c(Na+)>c(H+)>c(OH–),D正确。
故选A。
考查方向
解题思路
A.点③溶液中,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可知:c(Na+)<c(CH3COO-)+c(CH3COOH),因此:c(OH–)<c(H+)+c(CH3COOH);
B.点①溶液的是等浓度的CH3COOH和CH3COONa,点②溶液的是等浓度的HCN和NaCN,HCN的电离平衡常数<CH3COOH,NaCN水解平衡常数>CH3COONa,因此:点①溶液的c(CN–)<点②溶液的c(CH3COO–);
C.点④溶液中是CH3COONa溶液,醋酸根离子水解,溶液显碱性,因此:c(Na+)>c(CH3COO–)>c(OH–)>c(H+);
D.在点②和③之间(不包括端点),c(CH3COO-)>c(CH3COOH),醋酸的电离平衡常数大于醋酸根离子的水解平衡常数,因此:c(CH3COO–)>c(Na+),溶液的pH<7,因此:c(H+)>c(OH–),综上所述,存在离子浓度大小关系:c(CH3COO–)>c(Na+)>c(H+)>c(OH–)。
易错点
本题考查了图象分析,酸碱反应定量关系和溶液酸碱性的理解应用,掌握基础是关键,题目难度中等。
知识点
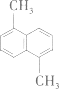
9. 
正确答案
解析
苯环上的二溴代物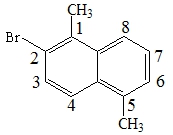
考查方向
解题思路
二溴苯中氢原子的种类等于三溴苯的种类,根据分子中等效氢原子判断。
易错点
本题考查同分异构体的书写,难度中等,根据等效氢判断同分异构体数目,利用对称性确定分子中等效氢原子数目是解题的关键。
知识点
10.下列装置或操作能达到实验目的的是( )
正确答案
解析
①.从碘水中分离碘单质,可以采取先萃取后蒸馏的方法,①错误;
②.用铜和稀硝酸反应制取一氧化氮气体,用排水法收集,②错误;
③.证明铁生锈时与氧气反应时,U形管两侧液面高度不一,③正确;
④.检查装置的气密性时,若气密性好,乙管液面比甲管高,④正确。
故选C。
考查方向
解题思路
①.从碘水中分离碘单质,可以采取先萃取后蒸馏的方法;
②.用铜和稀硝酸反应制取一氧化氮气体,用排水法收集;
③.证明铁生锈时与氧气反应时,U形管两侧液面高度不一;
④.检查装置的气密性时,若气密性好,乙管液面比甲管高。
易错点
本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯及实验基本操作等,把握物质的性质、实验技能为解答的关键,侧重性质与实验的考查,注意实验的可行性、评价性分析,题目难度不大。
知识点
硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:
已知:Ksp(Ag2S04)=1.4×10-5,请回答下列问题:
14.“加硫酸并焙烧”时的硫酸浓度最好为 (填字母)。
a.浓硫酸
b.10%硫酸
15.“加硫酸并焙烧”过程中Cu2Se参与反应的化学方程式为____________,该反应的还原剂是 。
16.“炉渣加水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是 ,“浸渣”中含有的金属成分是 ,若“浸出液”中c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为 (计算结果保留2位有效数字)。
17.操作I的名称为 。
18.+4价Se的氧化性强于+ 4价S的氧化性,SeO2、SO2混合气体用水吸收所发生反应的化学方程式为 。
19.操作I所得粗硒中含有Ni、Fe、Cu等杂质,可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
蒸馏操作中控制的最佳温度是 (填字母)。
a.455℃
b.462℃
c.475℃
d.515℃
正确答案
a
解析
将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,故选a;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
Cu2Se+6H2SO4(浓)
解析
加硫酸并焙烧”过程中Cu2Se与浓硫酸反应,参与反应的化学方程式为
Cu2Se+6H2SO4(浓)
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
加快浸出速率 Au、Pt 1.6×10-2 moL/L
解析
“炉渣加水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是增大接触面积,加快浸出速率,金属银能和热的浓硫酸反应,“浸渣”中含有的金属成分是金、铂,若“浸出液”中c(Ag+)=3.0×10-2 mol/L,根据Ksp(Ag2S04)=1.4×10-5,(3.0×10-2)2×c(SO42-)=1.4×10-5,则溶液中c(SO42-)最大为1.6×10-2 moL/L;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
过滤
解析
将固液分开,操作I的名称为过滤;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
SeO2+2SO2+2H2O=2H2SO4+Se↓
解析
+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸,混合气体用水吸收所发生反应的化学方程式为:SeO2+2SO2+2H2O=2H2SO4+Se↓;
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
正确答案
c
解析
由图可知475℃左右蒸馏的挥发物中硒含量最高,故选c。
考查方向
解题思路
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒,将铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入浓硫酸焙烧,迅速氧化Ag2Se、Cu2Se生成SeO2、SO2,加水吸收SeO2、SO2,+4价Se的氧化性强于+ 4价S的氧化性,在水溶液中发生反应:SeO2+2SO2+2H2O=2H2SO4+Se↓,二氧化硫将二氧化硒还原成单质硒;炉渣加水浸出,得到银、金、铂等固体混合物,据此作答。
易错点
解题的关键是了解+4价Se的氧化性强于+ 4价S的氧化性,SeO2将SO2氧化成硫酸。
氯化铝为共价化合物,熔点、沸点都很低,且会升华,极易潮解,遇水放热并产生白色烟雾。请回答下列问题:
20.甲组同学按照如图一所示装置,通过实验制备A1Cl3固体。装置B中滴入浓硫酸后发生的反应为2NaCl+H2SO4(浓)
①向装置B中滴加浓硫酸;
②点燃B处酒精灯;
③点燃D处酒精灯。这三项操作的正确顺序为 (填序号)。
21.乙组同学认为甲组同学的装置设计存在不安全因素,因此乙组同学对甲组同学所设计的装置D、E进行了改进(如图二所示),装置E改为带支管的烧瓶,该烧瓶的名称为 ,改进后的优点是 。
22.设计实验证明:
①AlCl3能够水解: 。
②AlCl3是共价化合物: 。
正确答案
浓硫酸 2Al+6HCl(g)=2AlC13+3H2 防止空气中的水蒸气进入装置E ①②③
解析
装置B中滴入浓硫酸后发生的反应为2NaCl+H2SO4(浓)
考查方向
解题思路
装置B中滴入浓硫酸后发生的反应为2NaCl+H2SO4(浓)
易错点
注意凝华的AlC13可能堵塞D、E之间的导气管。
正确答案
蒸馏烧瓶 防止凝华的AlC13堵塞D、E之间的导气管
解析
凝华的AlC13可能堵塞D、E之间的导气管,因此乙组同学对甲组同学所设计的装置D、E进行了改进(如图二所示),装置E改为带支管的烧瓶,该烧瓶的名称为蒸馏烧瓶,改进后的优点是生成物直接进入蒸馏烧瓶,防止凝华的AlC13堵塞D、E之间的导气管;
考查方向
解题思路
凝华的AlC13可能堵塞D、E之间的导气管,因此乙组同学对甲组同学所设计的装置D、E进行了改进(如图二所示),装置E改为带支管的烧瓶,该烧瓶的名称为蒸馏烧瓶,改进后的优点是生成物直接进入蒸馏烧瓶,防止凝华的AlC13堵塞D、E之间的导气管;
易错点
注意凝华的AlC13可能堵塞D、E之间的导气管。
正确答案
①取少量AlCl3溶液,用pH试纸测其pH,pH<7 ②做AlC13熔融状态下的导电实验
解析
①取少量AlCl3溶液,用pH试纸测其pH,pH<7,能证明AlCl3能够水解;
②做AlC13熔融状态下的导电实验,AlC13熔融状态下不导电,因此AlCl3是共价化合物。
考查方向
解题思路
①取少量AlCl3溶液,用pH试纸测其pH,pH<7;
②AlC13熔融状态下不导电。
易错点
注意凝华的AlC13可能堵塞D、E之间的导气管。
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
① CH4(g)+ H2O(g)= CO(g)+3H2(g) ∆H =+206.2kJ·mol-1
② CH4(g)+ CO2(g)= 2CO(g)+2H2(g) ∆H =+247.4kJ·mol-1
③ 2H2S(g)=2H2(g)+S2(g) ∆H =+169.8kJ·mol-1
23.以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
24.在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
①图中压强(p1、p2、p3)的大小顺序为 ,理由是 。
②该反应平衡常数的大小关系为K(T1) (填“>”、“<”或“=”)K(T2),理由是 。
③上图中M点的平衡常数Kp= MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有 。
25.氢气燃料电池能大幅度提高能量的转化率。甲烷--空气碱性(KOH为电解质)燃料电池的负极反应式为 。相同条件下,甲烷燃料电池与氢气燃料电池的能量密度之比为 (单位质量的输出电能叫能量密度,能量密度之比等于单位质量的可燃物转移电子数之比)。
正确答案
CH4(g)+ 2H2O(g)=CO2(g)+4H2(g) ∆H =+165.0kJ·mol-1
解析
① CH4(g)+ H2O(g)= CO(g)+3H2(g) ∆H =+206.2kJ·mol-1
② CH4(g)+ CO2(g)= 2CO(g)+2H2(g) ∆H =+247.4kJ·mol-1
③ 2H2S(g)=2H2(g)+S2(g) ∆H =+169.8kJ·mol-1
CH4(g)与H2O(g)反应生成CO2(g)和H2(g),由盖斯定律,①×2-②得CH4(g)+ 2H2O(g)=CO2(g)+4H2(g) ∆H =+165.0kJ·mol-1;
考查方向
解题思路
由盖斯定律,①×2-②得CH4(g)+ 2H2O(g)=CO2(g)+4H2(g) ∆H =+165.0kJ·mol-1;
易错点
本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练。
正确答案
①P1<P2<P3 该可逆反应的正反应是气体分子数增大的反应,相同温度下,增大压强,H2S的转化率减小
②< 该可逆反应的正反应是吸热反应,升高温度,平衡常数增大
③1
④及时分离出产物
解析
H2S气体分解生成H2和S2(g),该可逆反应的正反应是气体分子数增大的反应,在密闭容器中充入一定量的H2S,相同温度下,增大压强,H2S平衡转化率逆向进行;该反应是吸热反应,相同压强下,升高温度,H2S平衡转化率正向进行;
①相同温度下,增大压强,H2S平衡转化率逆向进行,压强的大小顺序为(p1<p2<p3),理由是该可逆反应的正反应是气体分子数增大的反应,相同温度下,增大压强,H2S的转化率减小;
②该反应是吸热反应,温度升高,平衡正向移动,因此平衡常数的大小关系为K(T1)<K(T2);
③M点: 2H2S(g)=2H2(g)+S2(g)
反应后分压(5MPa) 2/5 2/5 1/5
平衡常数
④如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有及时分离出产物;
考查方向
解题思路
H2S气体分解生成H2和S2(g),该可逆反应的正反应是气体分子数增大的反应,在密闭容器中充入一定量的H2S,相同温度下,增大压强,H2S平衡转化率逆向进行;该反应是吸热反应,相同压强下,升高温度,H2S平衡转化率正向进行;进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有及时分离出产物;
易错点
本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练。
正确答案
CH4-8e一+10OH-=CO32-+7H2O 1:2
解析
甲烷--空气碱性(KOH为电解质)燃料电池的负极甲烷失去电子,在碱性条件下生成碳酸根离子,反应式为CH4-8e一+10OH-=CO32-+7H2O,相同条件下,16gCH4失去8mole一,16g失去16mole一,甲烷燃料电池与氢气燃料电池的能量密度之比为1:2。
考查方向
解题思路
甲烷--空气碱性(KOH为电解质)燃料电池的负极甲烷失去电子,在碱性条件下生成碳酸根离子,反应式为CH4-8e一+10OH-=CO32-+7H2O,相同条件下,16gCH4失去8mole一,16g失去16mole一,甲烷燃料电池与氢气燃料电池的能量密度之比为1:2。
易错点
本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练。
[化学——选修化学与技术]
氯碱工业必须解决的问题是如何隔开氯气与氢气和NaOH溶液并保证电解反应正常进行。水银法也是氯碱工业常采用的一种方法,其电解食盐水原理示意图如图所示。在电解槽中,以汞为阴极,金属钛为阳极。已知Na+在汞阴极上放电并析出金属钠,钠与汞生成钠汞齐合金并进入解汞槽。请回答下列问题:
26.气体A是 ,产生气体B的电极反应是 。
27.溶液C的溶质是 ,解汞槽中发生反应的化学方程式是 。
28.该方法中能循环使用的物质是 。(只需写出一种)
29.氯碱生产常用方法比较见下表:
结合表中数据回答,与离子膜法相比,水银法的优点是 ;水银法也有明显的不足,从生产中所用材料来看主要是 。
正确答案
氢气 2Cl--2e-=Cl2↑
解析
在电解池的阴极上是阳离子氢离子发生得电子的还原反应,产生氢气,在阳极上是阴离子氯离子发生失电子的氧化反应,产生氯气,即2Cl--2e-=Cl2↑;
考查方向
本题考查学生电解池的工作原理
解题思路
在电解池的阴极上是阳离子发生得电子的还原反应,在阳极上是阴离子发生失电子的氧化反应,根据电解池的工作原理来回答判断;
易错点
本题考查学生电解池的工作原理知识,结合实际化工生产过程来考查,增加了难度。
正确答案
氢氧化钠 2Na+2H2O=2NaOH+H2↑
解析
根据题意,Na+在汞阴极上放电并析出金属钠,且金属钠可以和水之间发生反应生成氢氧化钠溶液和氢气,2Na+2H2O=2NaOH+H2↑,所以溶液C的溶质是氢氧化钠;
考查方向
本题考查学生电解池的工作原理。
解题思路
金属钠可以和水之间发生反应生成氢氧化钠;
易错点
本题考查学生电解池的工作原理知识,结合实际化工生产过程来考查,增加了难度。
正确答案
Hg(或是NaCl)
解析
根据电解槽的工作原理,在反应过程中,可以看出淡盐水是产物,饱和食盐水需要不断补充,可以知道氯化钠是可以循环使用的物质,此外,作电极材料的Hg也是可以循环使用的;
考查方向
本题考查学生电解池的工作原理。
解题思路
根据电解槽的工作原理来判断可以循环利用的物质;
易错点
本题考查学生电解池的工作原理知识,结合实际化工生产过程来考查,增加了难度。
正确答案
烧碱纯度高,质量好 汞容易造成环境污染
解析
比较表中的各组数据可以看出,与离子膜法相比,水银法获得的烧碱纯度高,且质量好,但是水银法使用的材料汞有毒,容易造成环境污染。
考查方向
解题思路
比较各组数据结合实际获得烧碱的原理来回答即可。
易错点
本题考查学生电解池的工作原理知识,结合实际化工生产过程来考查,增加了难度。








