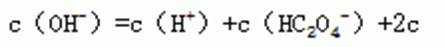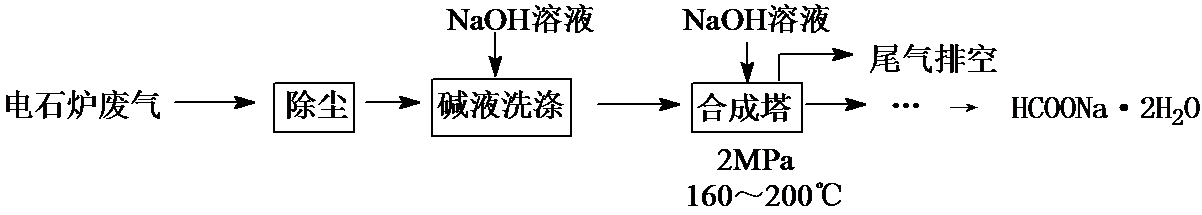- 真题试卷
- 模拟试卷
- 预测试卷
3.分枝酸结构简式如图,下列说法正确的是()
正确答案
解析
A. 分子式为 C10H10 O6
B、根据分支酸的结构简式可知分枝酸含羧基、羟基和碳碳双键三种官能团,错误;
C、分枝酸含有羧基和羟基,可分别与乙醇、乙酸发生酯化反应,反应类型相同,正确;
D、分支酸分子中含有2个羧基,所以1mol分枝酸最多能与2mol NaOH发生中和反应,错误.
考查方向
解题思路
A. 分子式为 C10H10 O6
B、分枝酸含羧基、羟基和碳碳双键三种官能团;
C、分枝酸含有羧基和羟基可与乙醇、乙酸发生反应;
D、分支酸分子中含有2个羧基;
易错点
本题考查了有机化合物的结构与性质,包含了通过分析有机化合物的结构简式,易错点在判断有机化合物的官能团、反应类型的判断、有机物的性质。
知识点
7.短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y 的次外层电子数是最外层的
正确答案
解析
A、Y、Z、W具有相同电子层结构的离子(O2-、Na+、Al3+),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,其半径依次减小,故A错误;
B、X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2),故B错误;
C、化合物X2Y、ZY、WY3 中化学键的类型相同,故C错误;
D、由X、Y、Z、W组成的化合物的水溶液可能显酸性故选C。
考查方向
解题思路
从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Al元素,R是S元素。
易错点
由原子结构判断元素;
知识点
1.化学与科学、技术、社会、环境密切相关,下列叙述正确的是()
正确答案
解析
A、裂解是深度裂化,所以石油裂化的目的是为了提高汽油等轻质油的产量,裂解的目的是为了获得乙烯、丙烯等短链烃,错误;
B、目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,电子迁移速率快,所以可以取代硅用于制造更好的晶体管,正确;
C、催化剂只能降低反应的活化能,但不能改变平衡,所以不能提高反应的转化率,错误;
D、近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的,乙醇使蛋白质变性并非是将病毒氧化,高锰酸钾溶液和双氧水的消毒原理相同,都是利用二者的强氧化性;双氧水具有较强的氧化性,稀溶液能用于皮肤的消毒;次氯酸钠溶液中通入少量二氧化硫,发生氧化还原反应生成硫酸根和氯离子。
考查方向
解题思路
A、裂解是深度裂化,裂解的目的是为了获得乙烯、丙烯等短链烃;
B、单原子层锗,其电子迁移率是硅的10倍;
C、催化剂不能改变平衡;
D、乙醇使蛋白质变性,高锰酸钾溶液和双氧水具有强氧化性;
易错点
1. 裂解的含义及目的
2.各种消毒剂消毒的原理。
知识点
2.NA表示阿伏加德罗常数,下列叙述正确的是()
正确答案
解析
A.未交代等物质的量的N2和CO含有多少mol。
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为3 NA
D.标准状况下,戊烷是液体。
考查方向
解题思路
C.过氧根O算一种2离子。
易错点
1.标准状况下物质纯在的状态。
2. 过氧根O算一种2离子
知识点
5.下列说法正确的是()
正确答案
解析
A.氢氧化钠溶液和氨水具有相同的pH,由于氢氧化钠是强电解质,则在稀释时强碱的变化程度大,加水稀释促进一水合氨电离;
B. 常温下5.0×10-3mol·L-1KHA溶液的pH=3.75 ,说明HA-是弱离子,电离大于水解,该溶液中c(A2-)>c(H2A) C. HCN是很弱的酸,因此假设刚好中和 全部生成 NaCN,由于CN-会水解,必定造成CN-的浓度小于Na+的浓度,因此a=b时 也是c(Na+)>c(CN-)D. Na2C2O4溶液:存在物料守恒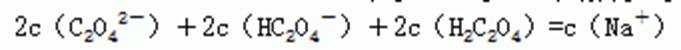
考查方向
解题思路
A.氢氧化钠是强电解质,则在稀释时强碱的变化程度大;
B. HA-是弱离子,存在电离和水解 ;
C. HCN生成NaCN,由于CN-会水解;
D. Na2C2O4溶液:存在物料守恒和电荷守恒二式。
易错点
本题属于综合知识的考查,易错点注意盐的类型和溶液酸碱性关系,酸碱都抑制水的电离.
知识点
6.铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4
正确答案
解析
原电池的总反应为:Pb+PbO2+4HBF4=2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;
充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极。
A、放电时,此装置为原电池,阴离子BF4-要向负极移动,故A正确;
B、放电时,正极反应:PbO2+2e-+4H+=Pb2++2H2O,每当转移2mol电子时正极有1molPbO2溶解,质量减少239g,故转移1mol电子时正极减少的质量为119.5g,故B正确;
C、充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,故C错误;
D、充电时的阴极反应即是将放电时的负极反应倒过来,故阴极反应为:Pb2++2e-=Pb,故D正确.
故选C
考查方向
解题思路
原电池的总反应为:Pb+PbO2+4HBF4===2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;
充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极.据此分析.
易错点
本题考查了原电池中电极反应式的书写和离子移动方向的判断,应注意的是在原电池中,阴离子移向负极,阳离子移向正极;在电解池中,阴离子移向阳极,阳离子移向阴极.
知识点
4.下列实验“操作和现象”与“结论”对应关系正确的是()
正确答案
D
解析
A、产生红棕色气体是因为加入了硫酸后溶液中就有了硝酸,硝酸与亚铁离子发生反应,硝酸被还原为一氧化氮,一氧化氮与氧气结合生成了红棕色的二氧化氮的缘故;
B、葡萄糖与新制氢氧化铜浊液的反应是在碱性的环境下,淀粉水解后没中和原来的硫酸,导致没有红色沉淀产生;
C、乙醇与浓硫酸混合加热产生的气体除乙烯外还可能产生二氧化硫,二氧化硫也能使酸性高锰酸钾溶液褪色,所以使溶液褪色的不一定是乙烯。
D、硅酸钠的酸性度小于碳酸,所以向饱和的碳酸钠溶液中通二氧化碳产生析出硅酸沉淀。
考查方向
解题思路
A、加入了硫酸后溶液中就有了硝酸;
B、葡萄糖与新制氢氧化铜浊液的反应是在碱性的环境下;
C、乙醇与浓硫酸混合加热产生的气体除乙烯外还可能产生二氧化硫;
D、硅酸钠的酸性度小于碳酸。
易错点
1.硝酸的强氧化性;
2. 醛基被氧化的环境。
知识点
9.1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
(1)、将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 。
(2)、装置中长玻璃管的作用是: 。
(3)、该反应能否用实验室制备乙酸乙酯的装置 (选填“能”或“不能”),简述理由 。
(4)、反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是 (选填编号)。a.③②④① b.①②③④ c.②①③④
(5)、实验测得1-乙氧基萘的产量与反应时间、温度的变化
如图所示,时间延长、温度升高,1-乙氧基萘的产量下降
可能的两个原因是 。
(6)、提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为 。
正确答案
(1)、提高1-萘酚的转化率 (2)、冷凝回流
(3)、不能、产物沸点大大高于反应物乙醇,会降低产率 (4)、a
(5)、 1-萘酚被氧化,温度高乙醇大量挥发或温度高发生副反应 (6)、50%
解析
(1)首先,根据


(2)反应结束,烧瓶中液体含有













(3)由于酚类物质容易被空气中的氧气氧化,乙醇的沸点较低,因此反应时间延长,温度升高,

(4)根据反应方程式知,



考查方向
解题思路
(1)使用过量的乙醇可提高1-萘酚的转化率,
(2)结合题中的相关物质的物理常数,提纯产物的步骤为A,
(3)如果时间延长,温度升高1-萘酚被氧化(或:温度高乙醇大量挥发)(或:温度高发生副反应),
(4)结合化学方程式计算得1-乙氧基萘的产率为50%。
知识点
10.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
H4(g)+H2O(g)
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
⑵在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
①若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
正确答案
⑴①0.0030 mol/(L·min) ②< 2.25×10-4 ③>
⑵①BD ②A.a=150,b=1/3 B.0.1
解析
(1)①根据v(H2)=3v(CH4)=3×
②根据化学方程式可以得出,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以去200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
100℃时平衡常数= 
故答案为:<;2.25×10-4;
③一定压强下,升高温度平衡向正反应方向移动,则正反应是吸热反应,所以△H>0;正反应是气体物质的量增大的反应,气体的物质的量越多,其熵越大,所以△S>0,故答案为:>,>;
(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B正确;C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;D、再充入amol CO和3amol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故选:BD
②A、采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,
考查方向
解题思路
(1)根据v(H2)=3v(CH4)进行计算。
(2)①平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
②

③当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
④存在平衡且平衡发生移动时才能应用平衡移动原理。
易错点
1.外界条件对化学平衡移动的影响。2.有关化学反应原理的相关计算。
知识点
8.粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,等物质的量浓度的NH4Fe(SO4)2、NH4 Cl、CH3COO NH4 的溶液中NH4+ 的浓度由小到大的顺序为
(2)滤渣B的主要成分为 ,其与NaOH溶液反应的离子方程式为 .
(3)已知KSP[Fe(OH)3]=4×10﹣
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、 、 ,得到的晶体主要成份是(填化学式) .第⑤步所加试剂D是 
正确答案
(1)CH3COO NH4<NH4 Cl<NH4Fe(SO4)2
(2)SiO2、SiO2+2OH﹣=SiO32﹣+H2O;
(3)6 ;H++HCO3﹣=H2O+CO2↑;
(4)玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O= Al(OH)3↓+HCO3-
解析
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2、氨气和水,发生反应的化学方程式为Fe2O3+4NH4HSO4
(2)SiO2不溶于一般酸性溶液,不溶于氨水;SiO2与NaOH溶液反应的离子方程式为SiO2+2OH﹣=SiO32﹣+H2O;
故答案为:SiO2、SiO2+2OH﹣=SiO32﹣+H2O;
(3)根据KSP=1×10﹣33;c(Al3+)均小于或等于1×10﹣9molL﹣1可认为完全沉淀,此时c(OH﹣)==1×10﹣8;在酸性溶液中,H++HCO3﹣=H2O+CO2↑;
故答案为:6;H++HCO3﹣=H2O+CO2↑;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合硫酸根离子,第⑥步生成Al(OH)3的离子方程式为通入CO2,酸碱中和生成(NH4)2SO4;
故答案为:玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O= Al(OH)3↓+HCO3-
考查方向
本题主要考查了考查物质制备实验分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法,盐类水解分析应用。
解题思路
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2、氨气和水,发生反应的化学方程式为Fe2O3+4NH4HSO4
(2)SiO2不溶于一般酸性溶液,不溶于氨水,所以滤渣B的主要成分为SiO2 。
(3)由于Ksp[Fe(OH)3]=4×10-38< Ksp [Al(OH)3]=1×10-32,Fe(OH)3先出现沉淀,根据Ksp [Al(OH)3]=1×10-32;c(Al3+)均小于或等于1×10﹣5 mol•L﹣1可认为完全沉淀,此时c(OH﹣)==1×10﹣9,c(H+)= 1×10﹣5,PH=5,所以溶液A至少应调节到pH=5。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;滤液C的主要成分是硫酸铵溶液,所以得到的晶体是硫酸铵。
易错点
1.离子方程式、化学方程式书写。
2. 根据Ksp判断沉淀。
知识点
11.【化学-—选修2:化学与技术】
甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。用电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)其合成部分工艺流程如下:
(1)上述工艺用碱液洗涤的目的是 ,可能发生的反应有 (列举两例)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是 ;最后排空的尾气主要成分是 。
(3) 合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa·2H2O的主要步骤有 、 、 ,再经先涤干燥得到。
(4) 甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为 。
(5) 在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要工业产品保险粉(Na2S2O4)同时产生二氧化碳,该反应的离子方程式为 。
正确答案
(1)除去其中的CO2、H2S等酸性气体
CO2+2NaOH =Na2CO3+H2O, H2S+2NaOH = Na2S + H2O等
(2)使尾气中的CO被充分吸收;N2和CH4
(3)蒸发浓缩、冷却结晶、过滤
(4)2HCOONa 
(5)HCOO- + 2SO2 + OH-= S2O4 2-+ CO2 +H2O
解析
电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)先除尘,然后用碱液洗涤,溶液中CO2、H2S反应生成盐,然后将气体通入合成塔,并加入NaOH溶液、加热至160﹣200℃、加压,最终得到HCOONa.2H2O,最后剩余N2和CH4,将尾气排空。
(1)碱液具有碱性,能吸收酸性气体,CO2、H2S都是酸性气体,被碱液吸收,发生的反应为CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O,
故答案为:除去其中的CO2、H2S等酸性气体;CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O;
(2)反应物接触面积越大,反应越充分,合成工艺中采用循环喷射吸收合成目的是增大反应物接触面积,使尾气中的CO被充分吸收;反应过程中N2、CH4不参加反应,所以最后排空的尾气主要成分是N2和CH4,
故答案为:使尾气中的CO被充分吸收;N2、CH4;
(3)从溶液中获取溶质采用蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到,故答案为:蒸发浓缩;
(4)甲酸钠高温时分解生成草酸钠和氢气,反应方程式为2HCOONa
故答案为:2HCOONa
(5)反应物是甲酸钠、NaOH和二氧化硫,生成物是Na2S2O4和二氧化碳、水,离子反应方程式为HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O,
故答案为:HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O
考查方向
解题思路
电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)先除尘,然后用碱液洗涤,溶液中CO2、H2S反应生成盐,然后将气体通入合成塔,并加入NaOH溶液、加热至160﹣200℃、加压,最终得到HCOONa.2H2O,最后剩余N2和CH4,将尾气排空,
(1)碱液具有碱性,能吸收酸性气体;
(2)反应物接触面积越大,反应越充分;最后排空的尾气主要成分是N2和CH4;
(3)从溶液中获取溶质采用蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到;
(4)甲酸钠高温时分解生成草酸钠和氢气;
(5)反应物是甲酸钠、NaOH和二氧化硫,生成物是Na2S2O4和二氧化碳、水,根据反应物、生成物书写离子方程式.
易错点
本题考查物质分离和提纯,为高频考点,易错点在离子反应、基本实验操作、氧化还原反应等知识点,明确反应原理及操作基本方法是解本题关键。