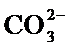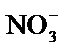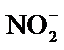- 真题试卷
- 模拟试卷
- 预测试卷
1.下列说法错误的是( )
正确答案
解析
A.蔗糖有甜味,可作调味剂,故A正确;B.铁粉可与氧气反应,吸收氧气,可作食品抗氧剂,故B正确;C..双氧水有强氧化性,使得蛋白质变性,可作消毒剂,故C正确; D.氢氧化钙和水不反应,不能做干燥剂,故D错误。
故选D。
考查方向
解题思路
A.蔗糖有甜味 B.铁粉可与氧气反应,吸收氧气C..双氧水有强氧化性,使得蛋白质变
性D.氢氧化钙和水不反应
易错点
本题主要考查常见元素化合物知识,题目难度小,易错点是把氧化钙和氢氧化钙混淆。
3.下列分子中,其中子总数为24的是( )
正确答案
解析
A.每个18O中有10个中子,其中子总数为30,故A错误; B.每个2H中有1个中子,每个17O中有9个中子,其中子总数为20,故B错误;C..每个14N中有7个中子,每个16O中有8个中子,其中子总数为23,故C错误;D.每个14C中有8个中子,每个16O中有8个中子,其中子总数为24,故D正确。
故选D。
考查方向
解题思路
A.每个18O中有10个中子B.每个2H中有1个中子,每个17O中有9个中子 C..每个14N中有7个中子,每个16O中有8个中子 D.每个14C中有8个中子,每个16O中有8个中子
易错点
本题考查原子的组成,质量数=质子数+中子数,题目难度小。
4.在酸性条件下,可发生如下反应:


正确答案
解析
根据离子反应方程式中,反应前后所带电荷数相等,即6-1=8-n-1,解得n=2,从而得出M2O7n-中M的化合价为+6价 A.M的化合价为+6价,故A错误; B.M的化合价为+6价,故B错误; C..M的化合价为+6价,故C正确; D.M的化合价为+6价,故D错误。
故选C
考查方向
解题思路
根据离子反应方程式中,反应前后所带电荷数相等,即6-1=8-n-1,解得n=2,从而得出M2O7n-中M的化合价为+6价
易错点
本题考查离子反应中的电荷守恒,方程式等号两边的电荷代数和相等,题目难度一般。
9.每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
NA为阿伏加德罗常数的值。下列叙述错误的是( )
正确答案
解析
A.乙烯的结构简式为CH2=CH2,1mol乙烯中含有碳氢键的物质的量为4mol,故A说法正确;B.甲烷燃烧生成CO2,甲烷中C的化合价为-4价,CO2中C的化合价为+4价,因此1mol甲烷完全燃烧转移电子物质的量为8mol,故B说法正确;C..乙酸是弱酸,部分电离,因此溶液中H+物质的量小于0.1mol,故C说法错误;D.1molCO含有质子物质的量为(6+8)mol=14mol,1molN2中含有质子物质的量为2×7mol=14mol,因此1molN2和CO的混合气体中含有质子物质的量为14mol,故D说法正确。
考查方向
解题思路
A.乙烯的结构简式为CH2=CH2,1个l乙烯中含有碳氢键为4 B.甲烷燃烧生成CO2,甲烷中C的化合价为-4价,CO2中C的化合价为+4价或者利用电子守恒计算氧气得电子也可以C..乙酸是弱酸,部分电离 D.1molCO含有质子物质的量为(6+8)mol=14mol,1molN2中含有质子物质的量为2×7mol=14mol
易错点
本题考查阿伏伽德罗常数,1mol物质含有NA个微粒,题目借助阿伏伽德罗常数进一步考查物质的构成和反应,是高考频考点,难度一般。
10.每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
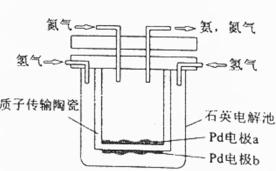
一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )
正确答案
解析
本装置是电解池,目标是N2+3H2=2 NH3,依据电解池工作原理分析。 A.Pb电极b通入氢气,反应过程氢气失电子被氧化,因此反应是阳极反应,故A错误;B.阴极发生还原反应,根据N2+3H2=2 NH3分析,氮气得电子被还原,因为氢离子导电,故阴极反应为N2+6H++6e−=2NH3,故B正确;C..电解池中阳离子向阴极移动,故C正确; D.陶瓷只允许氢离子通过,可以隔离N2和H2,故D正确。
故选A。
考查方向
解题思路
A.Pb电极b通入氢气,反应过程氢气失电子被氧化 B.阴极发生还原反应,根据N2+3H2=2 NH3分析 C..电解池中阳离子向阴极移动 D.陶瓷只允许氢离子通过
易错点
本题考查电解池工作原理,是高考频考点,关键是理清电极反应类型、离子移动方向,难度中等,准确进行氧化还原分析是前提。
2.分别将足量下列气体通入稀Na2S溶液中,可以使溶液变浑浊的是( )
正确答案
解析
A.CO不与Na2S发生反应,因此没有沉淀产生,故A错误;B.SO2具有弱氧化性,与Na2S发生氧化还原反应,即SO2+2S2-+4H+=3S↓+2H2O,故B正确;C..利用酸性强的制取酸性弱的,即发生2H++S2-=H2S,没有沉淀产生,故C错误;D.CO2 +H2O +S2- = HS- +HCO3- 不产生沉淀,故D错误。
故选B。
考查方向
解题思路
A.CO不与Na2S发生反应 B.SO2具有弱氧化性,与Na2S发生氧化还原反应 C..酸性强的制取酸性弱的酸,生成弱电解质D.生成更弱的酸,即更难电离的弱电解质
易错点
本题考查物质之间的化学反应,硫离子的性质主要包括两方面一是还原性,二是弱酸根,难点在于难易判断物质间反应的原因。
5.下列危险化学品标志中表示腐蚀品的是( )
正确答案
解析
A.为腐蚀品标志,故A正确;B.为易燃固体标志,故B错误;C..为辐射标志,故C错误;D.为易燃液体或依然固体标志,故D错误。
故选A。
考查方向
解题思路
A.为腐蚀品标志 B.为易燃固体标志 C..为辐射标志 D.为易燃液体或依然固体标志
易错点
本题考查几种常见的与化学有关的图标,了解各个常见标志所代表的含义是解答此类题的关键。
6.能正确表达下列反应的离子方程式为( )
正确答案
解析
A.醋酸是弱酸不能拆写成离子,应是2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O,故A错误;B.浓硫酸具有强氧化性,能把H2S氧化成S,把Fe2+氧化成Fe3+,故B错误;C..发生双水解反应,应是2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故C错误;D.NO2与OH-发生歧化反应,离子反应方程式为2NO2+2OH-= NO3-+NO2- + H2O,故D正确。
故选D。
考查方向
解题思路
A.醋酸是弱酸不能拆写成离子 B.浓硫酸具有强氧化性,能把H2S氧化成S,把Fe2+氧化成Fe3+ C..发生双水解反应 D.NO2与OH-发生歧化反应电子得失相等
易错点
本题考查离子方程式的书写,关键在于三个守恒:质量守恒、电荷守恒、电子守恒,同时注意反应物之间量的关系,反应是否符合事实。
7.每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
下列叙述正确的是( )
正确答案
解析
A.铜的金属活动顺序排在氢后,故稀硫酸和铜粉不反应,故A错误;B.浓硫酸有强氧化性,能氧化负一价的碘离子,故B错误; C..过氧化钠与二氧化碳反应生成氧气和碳酸钠,故C正确;D.铝箔在氯气中燃烧生成氯化铝,故D正确。
故选CD。
考查方向
解题思路
A.铜的金属活动顺序排在氢后 B.浓硫酸有强氧化性 C..过氧化钠与二氧化碳反应生成氧气和碳酸钠 D.铝箔在氯气中燃烧生成氯化铝
易错点
本题考查常见的物质的性质,包括金属活动顺序、氧化性等,难度一般,关键在于平时知识积累。
8.每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
下列叙述正确的是( )
正确答案
解析
A.乙醇被氧化成乙酸,乙醇和乙酸发生酯化反应,即CH3CH2OH+CH3COOH
故选AD。
考查方向
解题思路
A.乙醇被氧化成乙酸,乙醇和乙酸发生酯化反应 B.乙烷和丙烷没有同分异构体,丁烷存在同分异构体 C..聚乙烯中不含碳碳双键 D.甲烷与足量氯气在光照下反应产物是氯化氢和CCl4
易错点
本题考查常见的有机物的性质,题目难度一般,主要是知识积累。
12.每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
下列实验操作正确的是( )
正确答案
解析
A.锥形瓶不能用待测液润洗,否则多消耗标准液,故A错误;B.容量瓶和滴定管使用前均需要检漏,故B正确;C..蒸馏完毕时,先停止加热,再关闭冷凝水,故C错误;D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出,故D正确。
故选BD。
考查方向
解题思路
A.锥形瓶不能用待测液润洗 B.容量瓶和滴定管使用前均需要检漏 C..蒸馏完毕时,先停止加热,再关闭冷凝水 D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出
易错点
本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键
11.每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
已知反应CO(g)+H2O(g)
正确答案
解析
A.此反应的正反应是放热反应,升高温度平衡向逆反应方向进行,化学平衡常数只受温度的影响,即升高温度,K值减小,故A正确;B.反应前后气体系数之和相等,因此减小压强,平衡不移动,即n(CO2)不变,故B错误;C..催化剂对化学平衡移动无影响,因此CO的转化率不变,故C错误;D.恒压下,充入N2,容器的体积增大,组分浓度降低,但化学反应前后气体系数之和不变,因此化学平衡不移动,n(H2)不变,故D正确。
故选AD。
考查方向
解题思路
A.化学平衡常数只受温度的影响;此反应的正反应是放热反应,升高温度平衡向逆反应方向进行 B.反应前后气体系数之和相等,因此减小压强,平衡不移动 C..催化剂对化学平衡移动无影响 D.化学反应前后气体系数之和不变,因此化学平衡不移动
易错点
本题考查化学平衡常数、化学平衡的移动方向,其中B和D项易错,注意本题是前后气体物质的量不变的反应。
13.(8分)
X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
正确答案
(1)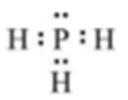
(2)离子,CaH2+2H2O=Ca(OH)2+H2↑;
(3)第二周期IIIA族, H3BO3;
(4)-3。
解析
X2为最轻的气体,即X为H,Y、L、M三种元素的质子数为5的倍数,质子数等于原子序数,质子数可能为5、10、15、20中的三个,四种元素为主族元素,因此质子数为10舍去,即三种元素分别为B、P、Ca,(1)形成简单化合物是PH3,其电子式为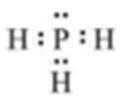
(2)形成的化合物是CaH2,属于离子化合物,与水发生的反应是CaH2+2H2O=Ca(OH)2+H2↑;
(3)Y为B,属于第二周期IIIA族元素,其含氧酸为H3BO3;
(4)形成的化合物是Ca3P2,其中P显-3价。
考查方向
元素周期表和元素周期律的综合应用
解题思路
X2为最轻的气体,即X为H,Y、L、M三种元素的质子数为5的倍数,质子数等于原子序数,质子数可能为5、10、15、20中的三个,四种元素为主族元素,因此质子数为10舍去,即三种元素分别为B、P、Ca,(1)形成简单化合物是PH3
(2)形成的化合物是CaH2,其中钙元素化合价+2,氢元素-1价
(3)Y为B,属于第二周期IIIA族元素
(4)形成的化合物是Ca3P2
易错点
本题主要考查元素周期表和元素周期律的综合应用,为高考频考点,难度一般,易错点是离子方程式书写,CaH2属于离子化合物及其化合价判断易错。
17.(10分)
以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:
硼镁泥的主要成分如下表:
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
正确答案
(1)H2SO4,SiO2;
(2)将Fe2+氧化为Fe3+;调节溶液pH,使Fe3+、Al3+以氢氧化物的形式沉淀除去;
(3)取滤液将其酸化后滴加KSCN溶液,若溶液未变红,则说明除杂完全;
(4)防止MgSO4·7H2O结晶析出。
解析
(1)制取MgSO4·7H2O,溶液中引入的是硫酸根,故“酸解”时应该加入的酸是硫酸;加入硫酸后二氧化硅不溶,故滤渣1主要是二氧化硅,故答案为:H2SO4,SiO2;
(2)通过调节溶液pH,沉淀阳离子时铁离子比亚铁离子更易除去,因此需要把亚铁离子氧化为铁离子,故加入次氯酸钙的作用是将亚铁离子氧化为铁离子;加入氧化镁的目的是调节溶液pH,Fe3+、Al3+以氢氧化物的形式沉淀除去,故答案为:将Fe2+氧化为Fe3+;调节溶液pH,使Fe3+、Al3+以氢氧化物的形式沉淀除去;
(3)因为除杂的目的是除去Fe3+、Al3+,因此可以通过检验铁离子是否有剩余来确定杂质是否除净,故答案为:取滤液将其酸化后滴加KSCN溶液,若溶液未变红,则说明除杂完全;
(4)MgSO4的溶解度受温度影响较大,若温度降低会析出MgSO4·7H2O,故答案为:防止MgSO4·7H2O结晶析出。
考查方向
解题思路
(1)制取MgSO4·7H2O,溶液中引入的是硫酸根;加入硫酸后二氧化硅不溶
(2)通过调节溶液pH,沉淀阳离子时铁离子比亚铁离子更易除去,因此需要把亚铁离子氧化为铁离子,故加入次氯酸钙的作用是将亚铁离子氧化为铁离子;加入氧化镁的目的是调节溶液pH,Fe3+、Al3+以氢氧化物的形式沉淀除去
(3)因为除杂的目的是除去Fe3+、Al3+,因此可以通过检验铁离子是否有剩余来确定杂质是否除净
(4)MgSO4的溶解度受温度影响较大,若温度降低会析出MgSO4·7H2O
易错点
本题考查化学与技术,涉及离子的检验方法、仪器的选取、物质的分离等知识点,注意阅读题给信息并充分利用信息进行解答,难度较大
14.(8分)
碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称________,可作为碱使用的原因是___________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)
②NaOH(s)+CO2(g)
反应2NaHCO3(s)
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
正确答案
(1)纯碱或苏打;CO32-+H2O
(2)135.6,c(H2O)×c(CO);
(3)24。
解析
(1)碳酸钠俗称纯碱或者苏打,可作为碱使用的原因是碳酸根水解,故答案为:纯碱或苏打;CO32-+H2O
(2)①2NaOH(s)+CO2(g)
②NaOH(s)+CO2(g)
反应2NaHCO3(s)
利用盖斯定律,③ =①-2×②,ΔH3=ΔH1-2ΔH2=135.6 kJ·mol−1
关于2NaHCO3(s)
K= c(H2O)×c(CO),故答案为:(2)135.6,c(H2O)×c(CO);
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,关于硫酸钡和碳酸钡都存在沉淀溶液平衡,Ksp(BaCO3)=c(Ba2+)×c(CO32-)=2.6×10−9,Ksp(BaSO4)= c(Ba2+)×c(SO42-)=1.1×10−10。
因为是在同一溶液中,故钡离子浓度相同,故
考查方向
解题思路
(1)碳酸钠俗称纯碱或者苏打,可作为碱使用的原因是碳酸根水解
(2)利用盖斯定律,③ =①-2×②,ΔH3=ΔH1-2ΔH2
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,关于硫酸钡和碳酸钡都存在沉淀溶液平衡,因为是在同一溶液中,故钡离子浓度相同。
易错点
本题考查盖斯定律、化学平衡常数表达式、沉淀溶解平衡,难度一般,易错点是第三问,较难理解的是同一溶液中钙离子浓度相同,同时适合于两个常数。
16.(10分)
锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)用碳酸锂和_______反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为__________。
(2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是__________。
(3)硬脂酸锂是锂肥皂的主要成分,可作为高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是__________。
(4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF5和__________。
正确答案
(1)盐酸,Li++e-=Li;
(2)金属锂在CO2仍可燃烧;
(3)分别取样品进行焰色反应,锂盐焰色为深红色,钠盐焰色为黄色,钾盐焰色为紫色(透过蓝色钴玻璃);(4)LiF。
解析
(1)碳酸锂制备氯化锂,利用碳酸锂的性质与碳酸镁的性质相似,因此碳酸锂与盐酸反应制备氯化锂,根据电解原理,阴极上发生还原反应,得到电子,电极反应式为Li++e-=Li;
(2)根据元素周期表中对角线原则,Li和Mg的性质相似,Mg能在CO2中燃烧,Mg与CO2反应生成MgO和C,因此锂也能与CO2反应,因此不能用CO2灭火;
(3)阳离子不同,阳离子属于碱金属元素,因此采用焰色反应进行鉴别,分别取样品进行焰色反应,锂盐焰色为深红色,钠盐焰色为黄色,钾盐焰色为紫色(透过蓝色钴玻璃);
(4)LiPF6中Li显+1价,P显+5价,F显-1价,PF5中P显+5价,F显-1价,因此LiPF6分解不属于氧化还原反应,根据元素守恒,另一种产物中含有Li,即另一种产物是LiF。
考查方向
解题思路
(1)碳酸锂制备氯化锂,利用碳酸锂的性质与碳酸镁的性质相似;根据电解原理,阴极上发生还原反应,得到电子;
(2)根据元素周期表中对角线原则,Li和Mg的性质相似
(3)阳离子不同,阳离子属于碱金属元素,因此采用焰色反应进行鉴别
(4)LiPF6分解不属于氧化还原反应
易错点
本题考查元素周期表的应用,焰色反应,元素化合价分析,题目难度一般,易错点是第四问,其中元素化合计均为变化是关键。
15.(8分)
已知苯可以进行如下转化:
回答下列问题:
(1)反应①的反应类型为________,化合物A的化学名称为___________。
(2)化合物B的结构简式为_________,反应②的反应类型为_______。
(3)如何仅用水鉴别苯和溴苯__________。
正确答案
(1)加成,环己烷;
(2)
(3)在试管中加入少量水,向其中滴入几滴苯或溴苯未知液体,若沉入水底,则该液体为溴苯,若浮在水面上,则该液体为苯。
解析
(1)反应①是苯和氢气生成环己烷,反应类型为加成反应,故答案为:加成,环己烷;
(2)A是环己烷,根据反应条件,判断反应是烷烃的取代反应,从产物的化学式也证明反应是取代反应,化合物B的结构简式为:

(3)水和苯和溴苯都不反应,鉴别的关键是利用物质的性质差异,根据二者的物理性质密度差异可得出结论,在试管中加入少量水,向其中滴入几滴苯或溴苯未知液体,若沉入水底,则该液体为溴苯,若浮在水面上,则该液体为苯,故答案为:在试管中加入少量水,向其中滴入几滴苯或溴苯未知液体,若沉入水底,则该液体为溴苯,若浮在水面上,则该液体为苯。
考查方向
解题思路
(1)根据反应条件和化学式判断
(2)根据反应条件和化学式判断
(3)鉴别的关键是利用物质的性质差异,根据二者的物理性质密度差异可得出结论
易错点
本题考查反应类型的判断、物质的鉴别,其中反应类型的判断主要从反应条件和物质的组成两个角度分析,题目整体难度一般。
18.请考生从第18、19题中任选一题作答。如果多做,则按所做的第一题计分。第18、19题中,第Ⅰ题为选择题,在给出的四个选项中,有两个选项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,请在答题卡相应位置作答并写明小题号。
[选修5:有机化学基础](20分)
Ⅰ(6分) 香茅醛(
A.分子式为C10H18O
B.不能发生银镜反应
C.可使酸性KMnO4溶液褪色
D.分子中有7种不同化学环境的氢
Ⅱ(14分)当醚键两端的烷基不相同时(R1-O-R2,R1≠R2),通常称其为“混醚”。若用醇脱水的常规方法制备混醚,会生成许多副产物:
R1—OH+ R2—OH 
一般用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,某课外研究小组拟合成
Ⅰ:
Ⅱ:①
②
③
回答下列问题:
(1)路线Ⅰ的主要副产物有______________、______________。
(2)A的结构简式为______________。
(3)B的制备过程中应注意的安全事项是______________。
(4)由A和B生成乙基苄基醚的反应类型为______________。
(5)比较两条合成路线的优缺点:______________。
(6)苯甲醇的同分异构体中含有苯环的还有________种。
(7)某同学用更为廉价易得的甲苯替代苯甲醇合成乙基苄基醚,请参照路线Ⅱ,写出合成路线______________。
正确答案
I.AC;
II.(1)
(2)
(3)规范使用金属钠,防止氢气爆炸;
(4)取代反应;
(5)路线I比路线II步骤少,但路线I比路线II副产物多,产率低;
(6)4;
(7)

解析
ⅠA.香茅醛(
故选 AC。
Ⅱ(1)根据题目信息提示,R1—OH+ R2—OH 
路线Ⅰ的产物,除了


(2)用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,反应物是卤代烃和醇钠,发生取代反应,反应①


(3)反应②
制备过程中应注意的安全事项是规范使用金属钠,防止氢气爆炸,故答案为:规范使用金属钠,防止氢气爆炸;
(4)从反应物和产物分析,A和B生成乙基苄基醚的反应类型为取代反应,故答案为:取代反应;
(5)比较两条合成路线的优缺点,路线I比路线II步骤少,但路线I比路线II副产物多,产率低,故答案为:路线I比路线II步骤少,但路线I比路线II副产物多,产率低;
(6)醇和醚互为同分异构体,因此有

(7)根据Williamson的方法,醇钠和卤代烃反应生成所要物质,因此让甲苯在光照的条件下与氯气发生取代反应,然后与乙醇钠发生取代反应,路线:
故答案为:
考查方向
解题思路
Ⅰ有机物结构与性质的关系,抓住结构中的官能团。
Ⅱ(1)根据题目信息提示,R1—OH+ R2—OH 
(2)用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,反应物是卤代烃和醇钠,发生取代反应
(3)反应②
制备过程中应注意的安全事项是规范使用金属钠
(4)从反应物和产物分析,A和B生成乙基苄基醚的反应类型为取代反应
(5)比较两条合成路线的优缺点,路线I比路线II步骤少,但路线I比路线II副产物多,产率低
(6)同分异构体书写包括官能团异构和位置异构以及碳链异构。
(7)根据Williamson的方法,醇钠和卤代烃反应生成所要物质,因此让甲苯在光照的条件下与氯气发生取代反应,然后与乙醇钠发生取代反应
易错点
本题考查有机合成路线设计,同分异构体书写,物质结构与性质,题目难度较大,关键是分析变化包括官能团变化碳链变化,利用好题目给的信息。
19.请考生从第18、19题中任选一题作答。如果多做,则按所做的第一题计分。第18、19题中,第Ⅰ题为选择题,在给出的四个选项中,有两个选项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,请在答题卡相应位置作答并写明小题号。
[选修3:物质结构与性质](20分)
Ⅰ(6分)下列叙述正确的有( )
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
Ⅱ(14分)ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。
(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
正确答案
I.AD;
II.(1)混合型晶体,σ键、π键;sp2;
(2)4,正四面体,非极性;
(3)①均为分子晶体,范德华力随分子相对质量增大而增大;②减弱,增强;
(4)K3C60,2.0。
解析
A.某元素原子核外电子总数是最外层电子数的5倍,若电子层数为2,则有2+x=5x,不合理;若电子层数为3,则有2+8+x=5x,不合理;若电子层数为4,则有2+8+18+x=5x,x=7,合理,则其最高正价为+7,故A正确;B.钠元素的第一电离能小于镁元素的第一电离能,而钠元素的第二电离能失去的是稳定状态的2d6电子,镁元素第二电离能失去的是3s1电子,故钠元素的第二电离能大于镁元素的第二电离能,故B错误;C.高氯酸的酸性大于次氯酸的酸性,高氯酸的氧化性小于次氯酸的氧化性,故C错误; D.邻羟基苯甲醛主要是分子内氢键,对羟基苯甲醛主要是分子间氢键,因此邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点,故D正确。
故选AD。
Ⅱ(1)图(a)所示单质的晶体是石墨,每一层碳原子之间是以共价键结合,而层与层之间是范德华力,故晶体类型是混合型晶体;层内碳原子之间形成σ键,层间的碳原子间形成的是π键;石墨中碳原子有3个σ键,无孤电子对,因此杂化类型为sp2,故答案为:混合型晶体,σ键、π键;sp2;
(2)SiCl4中心原子是Si,有4个σ键,孤电子对数为(4-4×1)/2=0,价层电子对数为4,空间构型为正四面体;因为是正四面体构型,正负电荷重心重合,属于非极性分子,故答案为:4,正四面体,非极性;
(3)①SiX4属于分子晶体,不含分子间氢键,范德华力越大,熔沸点越高,范德华力随着相对质量的增大而增大,即熔沸点增高;
②同主族从上到下非金属性减弱,得电子能力减弱,因此PbX2中化学键的离子型减弱,共价型增强,故答案为:①均为分子晶体,范德华力随分子相对质量增大而增大;②减弱,增强;
(4)根据晶胞的结构,C60位于顶点和面心,个数为8×1/8+6×1/2=4,K为与棱上和内部,个数为12×1/4+9=12,因此化学式为K3C60,晶胞的质量为
考查方向
解题思路
A.元素原子核外电子总数是最外层电子数的5倍,讨论合理的可能性B.钠元素的第二电离能失去的是稳定状态的2d6电子,镁元素第二电离能失去的是3s1电子C.高氯酸的酸性大于次氯酸的酸性,高氯酸的氧化性小于次氯酸的氧化性 D.邻羟基苯甲醛主要是分子内氢键,对羟基苯甲醛主要是分子间氢键
Ⅱ(1)图(a)所示单质的晶体是石墨,层内碳原子之间形成σ键,层间的碳原子间形成的是π键;石墨中碳原子有3个σ键,无孤电子对,因此杂化类型为sp2
(2)SiCl4中心原子是Si,有4个σ键,孤电子对数为(4-4×1)/2=0,价层电子对数为4,空间构型为正四面体;因为是正四面体构型,正负电荷重心重合,属于非极性分子
(3)①SiX4属于分子晶体,范德华力随着相对质量的增大而增大,即熔沸点增高;
②同主族从上到下非金属性减弱,得电子能力减弱,因此PbX2中化学键的离子型减弱,共价型增强
(4)根据晶胞的结构,C60位于顶点和面心;晶胞的质量为
易错点
本题主要考查元素电离能、分子构型、轨道杂化、晶胞等,题目难度较大,关于石墨晶体的知识尽管难度不大,但规范的描述对学生来说仍是个难点。