- 真题试卷
- 模拟试卷
- 预测试卷
7.下列处理不当的是
正确答案
解析
A. 氯气易溶于水,且会与水发生反应生成盐酸与次氯酸,氯气的密度比空气大,因此高处的氯气的密度一定比低处的氯气的密度小。所以用湿毛巾捂住口鼻,向高处跑可以有效防止氯气中毒。
B. 氨气极易溶于水氨气泄露的时候喷洒水雾有助于吸收氨气。
C. 钾钠会与水反应产生氢气,氢气遇火爆炸。
D. 碳酸钙撒入酸雨污染过的水中,呈酸性的河水会与碳酸钙反应,从而降低河水的酸性。
考查方向
解题思路
氯气的密度比空气大。
氨气极易溶于水。
钾钠会与水反应产生氢气。
呈酸性的河水会与碳酸钙反应,从而降低河水的酸性。
易错点
钾钠会与水反应产生氢气;酸性的河水会与碳酸钙反应。
知识点
8、设NA为阿伏伽德罗常数的数值,下列说法正确的是
正确答案
解析
A.未交代标况下。
B.说明该碳酸氢钠溶液的体积,所以无法判断。
C.乙烯与丙烯在标况下均为气态,其最简式为(CH2),22.4L乙烯和丙烯的混合气体中含有的碳原子数目为1NA。
D.碘离子与亚铁离子均具有还原性,而碘离子的还原性强于亚铁离子的还原性,当碘化亚铁与氯气均为1mol时,碘离子被氯气氧化,反应转移电子数为2mol。
考查方向
解题思路
A.标况下,22.4L的任何气体、任何混合气体的物质的量均为1mol。
B.未说明该碳酸氢钠溶液的体积。
C.乙烯与丙烯在标况下均为气态,其最简式为(CH2)。
D.碘离子与亚铁离子均具有还原性。
易错点
乙烯与丙烯最简式均为(CH2)
知识点
9.下列各组离子可以大量共存的是
正确答案
考查方向
解题思路
A. 遇酚酞变红的溶液含有OH-
B. 常温下Kw/c(H+)=1×10-13mol/L的溶液中, Kw/c(H+)=c(OH-)
C. 水电离出的c(H+)=10-10mol/L的溶液即显酸性又显碱性。
D.AlCl3溶液中铝离子水解显酸性。
易错点
Kw/c(H+)=1×10-13mol/L的溶液中, Kw/c(H+)=c(OH-)
水电离出的c(H+)=10-10mol/L的溶液即显酸性又显碱性
知识点
13、若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是
正确答案
解析
A. c点出溶液即为醋酸钠溶液,而醋酸钠溶液显碱性。
B. B点处加入的碱的量为醋酸总量的一半的时候溶液为醋酸钠与醋酸的混合溶液,溶液中钠离子的物质的量是溶液中醋酸与醋酸钠的物质的量的一半,B正确。
C. b点是醋酸钠与醋酸的混合溶液,c点是醋酸钠溶液,d点是醋酸钠与氢氧化钠混合溶液,当溶液中只有醋酸钠时,水的电离程度最大,而当溶液中有酸,例如醋酸,或者有碱例如氢氧化钠存在时会抑制水的电离。
D. 图示所反应的只是溶液整体温度的变化,该反应的中和热一直在增大,达到c点之后中和反应进行完全,不再有热量放出。
考查方向
解题思路
A. c点处,温度最高电离常数与电离程度最大,此时酸碱完全中和,之后一直延续到d点,温度任然比a点高的原因是,散热需要一个过程。
易错点
B点处加入的碱的量为醋酸总量的一半的时候溶液为醋酸钠与醋酸的混合溶液
知识点
11.某有机物A的结构简式如右图所示,有关叙述中正确的是
正确答案
解析
A.有机物A与浓硫酸混合加热,羟基相邻C上脱不了H原子。
B.1molA中苯环被完全加成。
C.脂基水解后有一个酚生成。
D.有机物A的同分异构体中能在稀硫酸下水解生成二苯酚的有12种
考查方向
解题思路
A.有机物A与浓硫酸混合加热,羟基相邻C上脱不了H原子。
B.1molA中苯环被完全加成。
C.脂基水解后有一个酚生成。
D.有机物A的同分异构体中能在稀硫酸下水解生成二苯酚的有12种
易错点
有机物同分异构体个数的考查
知识点
12.X、Y、Z为短周期主族元素,X的最外层电子数为内层电子数的2倍,Y的最高化合价与最低化合价的代数和为4,Z与Y同周期,Z的原子半径小于Y。下列叙述不正确的是
正确答案
解析
A. Z为氟元素,所以HF是同主族氢化物里沸点最低的一种。
B. 非金属性F>O>C,判断正确。
c二氧化碳中C与O,均满足8电子稳定结构,C正确。
D.乙烷C2H6中的C-C键是非极性键。
考查方向
解题思路
由题意X为碳元素,Y为氧元素,Z为氟元素。
易错点
X的最外层电子数为内层电子数的2倍,Y的最高化合价与最低化合价的代数和为4,Z与Y同周期,Z的原子半径小于Y推导元素。
知识点
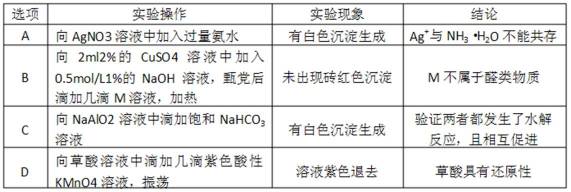
10.下列实验操作、实验现象和结论均正确的是
正确答案
D
解析
A.过量的氨水会与银离子形成氢氧化二氨合银,是一种溶液。
B.该实验操作氢氧化钠的用量应该要比硫酸铜的用量大,才能保证氢氧化铜在碱性条件下与醛发生反应并且
有红色沉淀产生,但是此处氢氧化钠的用量过少。
C.偏铝酸的酸性弱于碳酸所以偏铝酸钠的碱性强于碳酸氢钠的碱性,而偏铝酸钠进行水解时会抑制碳酸氢钠的水解。两者在一起,碳酸氢钠电离,偏铝酸钠水解。
D.草酸会因为具有还原性与具有强氧化性的高锰酸钾反应而使得高锰酸钾褪色。
考查方向
解题思路
A.过量的氨水会与银离子形成氢氧化二氨合银。
B.氢氧化钠的用量大,才能保证氢氧化铜在碱性条件下与醛发生反应。
C.偏铝酸的酸性弱于碳酸所以偏铝酸钠的碱性强于碳酸氢钠的碱性。
D.草酸会因为具有还原性。
知识点
开发新能源是解决环境污染的重要举措,工业常用CH4与CO2反应制备H2和CO,再H2和CO利用合成甲醇。
26. 已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1274.0KJ/mol
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0KJ/mol
③ H2O(g)=H2O(l) △H3=-44KJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
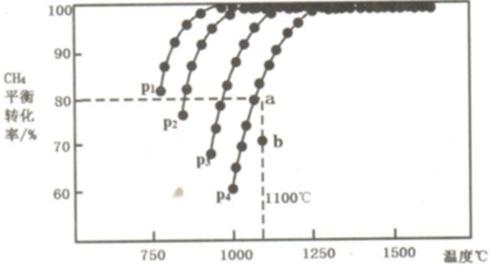
27.在恒容密闭容器中通入CH4与CO2,使其物质的量浓度为1.0mol/L,在一定条件下发生反应:CO2(g) + CH4(g) 
则:①该反应的△H 0(填“<、= 或>”);
②压强P1、P2、P3、P4由大到小的关系为 。压强为P4时,在b点:v(正) v(逆)。(填“<、= 或>”)
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp= ;如果P4=0.36MPa,求a点的平衡常数Kp= ;(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度 关系曲线:v正~c(CH4)和v逆~c(CO)。
则:ⅰ)与曲线v正~c(CH4)相对应的是上图中曲线 (填“甲”或“乙”)。
ⅱ)当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为 (填字母)。
正确答案
CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
解析
根据盖斯定律可以求出该反应的热化学方程式为:CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
考查方向
解题思路
根据盖斯定律可以求出该反应的热化学方程式为:CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
易错点
读图分析反应平衡移动的方向。
正确答案
① >; ② p4> p3> p2 >p1 ;>
③ P2(CO)·P2(H2)/(P(CO2) ·P(CH4)) ;1.64(MPa)2
④ i)乙 ; ii)B F
解析
①由图可知,温度升高甲烷的平衡转
②由该反应式可知,增大压强有助于反应向逆反应方向进行,所以从P1到P4压强依次增大,由图可知此时该反应还在向正反应方向进行着,所以正反应速率大于逆反应速率。
③以气体压强表示气体的浓度则平衡常数为:P2(CO)·P2(H2)/(P(CO2) ·P(CH4))
④由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速,所以乙曲线对应甲烷的反应速率曲线。
考查方向
解题思路
①由图可知,温度升高甲烷的平衡转
②由该反应式可知,增大压强有助于反应向逆反应方向进行。
④由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速。
易错点
读图分析反应平衡移动的方向。
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2 + Cl2 + SCl2=2SOCl2,部分装置如右下图所示,回答以下问题:
14.仪器c的名称是 ,装置f的作用是 。
15.实验室制Cl2的化学方程式为 。
16.SOCl2与水反应的化学方程式为 。蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因: 。
17.下列四种制备SO2的方案中最佳选择是 。
18.装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂。
19.试验结束后,将三颈烧瓶中混合物分离开的实验操作是 ;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为 (保留三位有效数字)。
20.分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是 。
正确答案
球形冷凝管,吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解。
解析
仪器c是球形冷凝管,f有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。
考查方向
解题思路
f有两个作用一个是防止有毒的氯气与二氧化硫逸出,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。
易错点
氯化亚砜与水反应的方程式书写。
正确答案
MnO2 + 4HCl(浓) 
解析
实验室氯气制备的方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
考查方向
解题思路
实验室氯气制备的方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
易错点
氯化亚砜与水反应的方程式书写。
正确答案
SOCl2+H2O=SO2↑+2HCl↑;AlCl3溶液易水解,AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解。
解析
氯化亚砜与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生。
考查方向
解题思路
AlCl3溶液易水解。
易错点
氯化亚砜与水反应的方程式书写。
正确答案
丁
解析
丁制取二氧化硫比较合理,因为甲中加热亚硫酸氢钠确实会产生二氧化硫,但是同时也会生成水,所以向下倾斜试管自然是不行。乙中,18.4mol/L的硫酸太浓,其中水分过少硫酸任然以分分子形式存在,无法与铜反应制取二氧化硫。乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根而无法得到二氧化硫。丁中反应生成硫酸钾与二氧化硫还有水。
考查方向
解题思路
乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根而无法得到二氧化硫。
易错点
氯化亚砜与水反应的方程式书写。
正确答案
考查方向
易错点
氯化亚砜与水反应的方程式书写。
正确答案
蒸馏;50.0%(7)取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。
解析
已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离。消耗氯气0.04mol,得到氯化亚砜的理论值为0.08mol,即为9.52g,产率为50%.
考查方向
解题思路
已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离。.
易错点
氯化亚砜与水反应的方程式书写。
正确答案
取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。
解析
取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。滴加硝酸酸化是为了除去可能存在的碳酸根离子,碳酸氢根离子与过量的氢氧化钠,而加入足量的硝酸钡溶液是为了除去过量的亚硫酸根离子。
考查方向
解题思路
取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。
易错点
氯化亚砜与水反应的方程式书写。
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料。 Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O + 2H+=Cu2+ + Cu + H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Ⅰ) 某同学利用乙醛与新制氢氧化铜加热制的砖红色沉淀。
Ⅱ) Cu2O常用电解法制备,流程如下:
21.乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为 。
22.砖红色沉淀加入稀硫酸,现象为 。 砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为 。
23. 精制食盐水需要除去其中的钙镁离子,依次加入的试剂为 。
24.实验室模拟电解装置如右图,观察的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
则:ⅰ)电解池的阳极反应式为 。 ⅱ)b极附近的白色沉淀开始变成黄色,颜色变化的离子方程式为 。
此时溶液中c(OH-)/c(Cl-)= 。
25. Cu2O在潮湿空气中容易被氧气氧化为CuO而变质,请设计实验方案检验其是否变
质: 。
正确答案
2Cu(OH)2+NaOH+CH3CHO Cu2O↓+ CH3COONa + 3H2O
解析
乙醛与新制氢氧化铜的反应式为:2Cu(OH)2+NaOH+CH3CHO 
考查方向
本题主要考查了金属元素铜的性质,综合化学实验操作。
解题思路
乙醛与新制氢氧化铜的反应式为:2Cu(OH)2+NaOH+CH3CHO 
易错点
金属元素铜的性质,综合化学实验操作。
正确答案
溶液由无色变为蓝色,有红色不溶物
Cu2O+2H++2Clˉ=2CuCl↓+H2O
解析
氧化亚铜与稀硫酸反应生成铜单质,硫酸铜溶液与水,所以反应现象是硫酸溶液由无色变为蓝色,且有红色物质生成。③Cu2O+2H++2Clˉ=2CuCl↓+H2O
考查方向
解题思路
氧化亚铜与稀硫酸反应生成铜单质,硫酸铜溶液与水
易错点
氧化亚铜与稀硫酸反应生成铜单质,硫酸铜溶液与水
正确答案
NaOH、Na2CO3、HCl
解析
除去钙镁离子,首先加入氢氧化钠除去镁离子,再向溶液中加入碳酸钠溶液除去钙离子,经过过滤之后除去沉淀最后加入盐酸溶液除去过量的氢氧化钠与碳酸钠溶液。
考查方向
本题主要考查了金属元素铜的性质,综合化学实验操作。
解题思路
除去钙镁离子,首先加入氢氧化钠除去镁离子,再向溶液中加入碳酸钠溶液除去钙离子。
易错点
金属元素铜的性质,综合化学实验操作。
正确答案
i) Cu+Cl- -e- = CuCl↓(2 分)
ii)CuCl+OH- = CuOH+Cl- 5/6×10-8 或 8.3×10-9 或 1/12× 10-7
解析
ⅰ)b极为电解池的阳极,发生氧化反应。电解质溶液为氯化钠溶液,所以阳极的电极反应式为:Cu+Cl- -e- = CuCl↓ ii)氯化亚铜水解结合水中的氢氧根形成氢氧化亚铜方程式为:CuCl+OH- = CuOH+Cl- 将氢氧化亚铜与氯化亚铜的KSP之比即为所求。
考查方向
解题思路
ⅰ)b极为电解池的阳极,发生氧化反应。
ii)将氢氧化亚铜与氯化亚铜的KSP之比即为所求。
易错点
金属元素铜的性质,综合化学实验操作。
正确答案
加入足量浓盐酸,溶液变为绿色,则含有 CuO
解析
氧化铜与盐酸反应产生氯化铜与水,氯化铜中有二价铜离子故溶液显蓝色。
考查方向
解题思路
氯化铜中有二价铜离子故溶液显蓝色。
易错点
金属元素铜的性质,综合化学实验操作。