- 真题试卷
- 模拟试卷
- 预测试卷
3.下列离子方程式书写正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)6种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应, 下列推断不合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(x2-xO3·O)。处理含1 mol Cr2O废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列有关铁及其化合物的离子方程式一定错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.下列物质的转化在给定条件下能实现的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
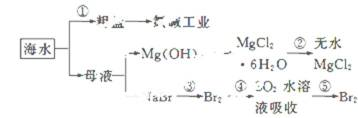
4.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)
下列有关说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.在封闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.某核反应堆内使用液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关铝钠合金的说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.为探究NaHCO3、Na2CO3与1 mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.某稀溶液中含4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe粉,充分反应后产生的NO气体在标准状况下的体积为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件下关于离子存在的说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14. NA表示阿伏伽德罗常数,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.下列有关溶液组成的描述合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列各项中,理由、结论及因果关系均正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,滤出沉淀物,经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式_____________________、_________________。
②AlCl3产品的纯度为________。
(5)工业上另一种以铝灰为原料制备无水AlCl3的工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是_______________________________________________。
正确答案
(1)Al2O3+3Cl2+3C===2AlCl3+3CO
(2)SO+Cl2+H2O===SO+2Cl-+2H+
(3)除去FeCl3
(4)①Fe3++3OH-===Fe(OH)3↓ Al3++4OH-===AlO+2H2O
②96%
(5)在HCl气流中加热脱去结晶水
解析
解析已在路上飞奔,马上就到!
知识点
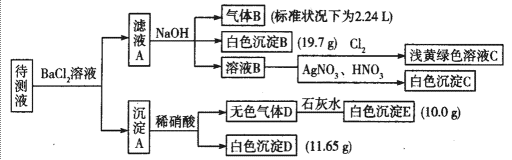
20.1 000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
(1)写出生成白色沉淀B的离子方程式:_______________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
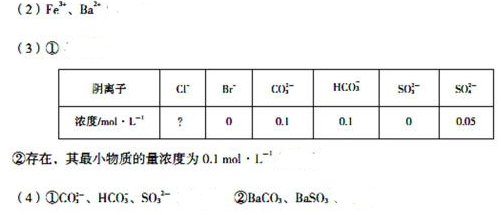
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:_______________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是_____________________.
②沉淀A中能与稀硝酸反应的成分是__________________________(写化学式)。
正确答案
(1)HCO3_ +OH- + Ba2+ = BaCO3+H2O
解析
解析已在路上飞奔,马上就到!
知识点
17.(I)现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
回答下列问题:
(1)装置A中液体试剂选用________,理由是______________________________________。
(2)装置B的作用是____________________________________________________________。装置E中碱石灰的作用是_______________________________________________________。
(3)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
(II)为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品Na2O2并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。回答下列问题:
(4)装置B中湿润的红色纸条褪色,证明A中反应有________________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因_________________________________________。
(5)装置C的作用是____________________________________________________________。
(6)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,其不赞成的理由可能为
①________________________________________________________;
②O2有可能是Na2O2与盐酸中的H2O反应所得。
正确答案
(1)6 mol·L-1盐酸 硫酸与CaCO3固体反应生成的CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续
(2)除去气体中的HCl 吸收装置D中反应剩余的CO2
(3)78%
(4)Cl2 ;4H++4I-+O2===2I2+2H2O
(5)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气
(6)①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2
解析
解析已在路上飞奔,马上就到!
知识点
19.某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 g CuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_____________(填实验序号),步骤①③中研磨固体所用仪器的名称是_____________;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,相关数据如下:
回答下列问题:
(2)上述实验中“待测数据”指______________________;
(3)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是_____________(选填“酸式”或“碱式”)滴定管;读数时需要注意
①____________
②视线与刻度线相平
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.___________________________________________,
b.CuO的化学性质有没有改变。
正确答案
(1)①②③ 研钵
(2)KClO3完全反应所用的时间
(3)碱式 上下移动右管使两液面相平
(4)CuO的质量有没有改变
解析
解析已在路上飞奔,马上就到!