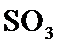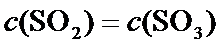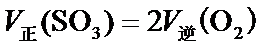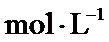- 真题试卷
- 模拟试卷
- 预测试卷
8.下列离子方程式书写正确的是 ( )
正确答案
解析
A.大理石与盐酸反应的离子方程式应为CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.氢氧化铝固体与盐酸反应的离子方程式应为Al(OH)3+H+=Al3++3H2O,故B错误;
C.氯化镁溶液中滴入氢氧化钠溶液反应的离子方程式应为Mg2++2OH−=Mg(OH)2↓,故C错误;
D.氯化钡溶液中滴入硫酸钠溶液生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42−=BaSO4↓,
故D正确.
考查方向
解题思路
大理石不溶于水,应写成化学式;氢氧化铝不溶于水,应写成化学式;氯化镁溶于水且电离呈离子;氯化钡溶液中滴入硫酸钠溶液生成硫酸钡沉淀.
易错点
不能熟练掌握离子方程式的书写,缺乏元素化合物知识的综合应用能力,没有把握离子方程式的书写方法,离子反应要符合反应的实际,易错点为A和B,注意物质的化学式。
知识点
10.
正确答案
解析
A.氯气和水的反应为可逆反应,故转移的电子的个数小于0.1NA个,故A错误;
B.过氧化钠与水时,氧元素的价态由−1价变为0价,故当生成1mol氧气时转移2mol电子,则生成0.1mol氧气时转移0.2mol电子即0.2NA个,故B正确;
C.标况下2.24L二氧化氮的物质的量为0.1mol,而3mol二氧化氮反应生成2mol硝酸,故当0.1mol二氧化氮反应时生成0.07mol硝酸,则硝酸根为0.07NA个,故C错误;
D.在电解饱和食盐水时,当生成2mol氢氧化钠时,生成1mol氢气和1mol氯气,故当生成4.0g氢氧化钠即0.1mol氢氧化钠时,生成0.2mol气体即0.2NA个气体分子,故D错误.
故选B。
考查方向
解题思路
氯气和水的反应为可逆反应;过氧化钠与水时,氧元素的价态由−1价变为0价;求出二氧化氮的物质的量,然后根据3mol二氧化氮反应生成2mol硝酸来分析;在电解饱和食盐水时,当生成2mol氢氧化钠时,生成1mol氢气和1mol氯气。
易错点
不能熟练掌握阿伏伽德罗常数的有关计算,不能熟练掌握公式的使用和物质的结构.
知识点
11.已知咖啡酸的结构如图所示.关于咖啡酸的描述正确的是( )
正确答案
解析
A.分子中含8个H,分子式为C9H8O4,故A错误;
B.含双键与溴水发生加成反应,含酚−OH,酚−OH的邻对位与溴水发生取代反应,故B正确;
C.苯环与双键与氢气发生加成反应,则1mol咖啡酸最多可与4mol氢气发生加成反应,故C错误;
D.含−COOH,与Na2CO3溶液.NaHCO3溶液均反应,故D错误;
故选B。
考查方向
解题思路
由结构可知,分子中含酚−OH.碳碳双键.−COOH,结合酚.烯烃.羧酸的性质来解答。
易错点
不能熟练掌握有机物的结构与性质,不能把握官能团与性质的关系,不能分辨酚.羧酸.烯烃性质,没注意D中酚与羧酸性质的差别.
知识点
13.下列事实不能用元素周期律解释的是( )
正确答案
解析
A.碳酸氢盐易分解,碳酸盐难分解,所以热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,故选A;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:C>Si,则酸性:H2CO3>H2SiO3,能用元素周期律解释,故B不选;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Li,则碱性:NaOH>LiOH,能用元素周期律解释,故C不选;
D.元素的非金属性越强,气态氢化物的稳定性越强,非金属性:F>Br,热稳定性:HF>HBr,故D不选.
故选A.
考查方向
解题思路
碳酸氢盐易分解,碳酸盐难分解;元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;元素的非金属性越强,气态氢化物的稳定性越强。
易错点
没有注意把握元素周期律的递变规律以及相关知识的积累。
知识点
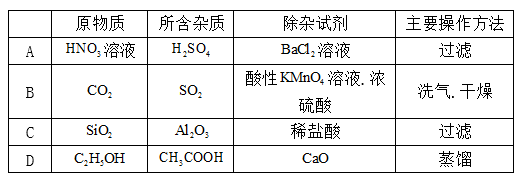
7.下列除杂试剂或方法有错误的是( )
正确答案
解析
A.硫酸与氯化钡反应生成硫酸钡和盐酸,引入新杂质,故A错误;
B.二氧化硫与高锰酸钾发生反应,而二氧化碳不能,则利用酸性KMnO4溶液.浓硫酸试剂洗气. 干燥可除杂,故B正确;
C.氧化铝与盐酸反应,而二氧化硅不能,则加足量稀盐酸.过滤可除杂,故C正确;
D.乙酸与CaO反应后,增大与乙醇沸点差异,则加CaO后蒸馏可分离,故D正确;故选A。
考查方向
解题思路
硫酸与氯化钡反应生成硫酸钡和盐酸;二氧化硫与高锰酸钾发生反应,而二氧化碳不能;氧化铝与盐酸反应,而二氧化硅不能;乙酸与CaO反应后,增大与乙醇沸点差异。
易错点
对物质的分离,提纯不熟悉,没有把握物质的性质。发生的反应及混合物分离方法,缺乏侧重分析与应用的能力,没有掌握元素化合物知识的综合应用。
知识点
9.煤矸石是采煤和洗煤时的废弃物,其主要成分是








正确答案
解析
A.煤矸石主要成分是Al2O3.SiO2,Al2O3.SiO2均难溶于水,故A错误;
B.P2O5和SO3对应水化物的酸为磷酸.硫酸,硫酸为强酸,所以酸性较强的是H2SO4,故B错误;
C.煤矸石主要成分是Al2O3.SiO2,可用于生产矸石水泥.耐火砖等建筑材料,故C正确;
D.SiO2不能溶于盐酸,所以用盐酸可以溶解煤矸石中的部分氧化物如Al2O3,而SiO2不能溶,故D错误.
故选:C.
考查方向
解题思路
Al2O3.SiO2均难溶于水;P2O5和SO3对应水化物的酸为磷酸.硫酸,硫酸酸性强;煤矸石主要成分是Al2O3.SiO2,熔点高硬度大;SiO2不能溶于盐酸.
易错点
不能熟练掌握物质分类方法和物质性质的判断,主要是两性氧化物.碱性氧化物性质的分析判断.
知识点
12.下图是电解
正确答案
解析
在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A.阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,故A正确;
B.由分析可知,d为阴极.c为阳极,故B正确;
C.d极上氢离子得电子生成氢气,c极上氢氧根离子失电子生成氢离子,所以溶液的pH不会升高,故C错误;
D.电解过程中,阴离子向阴极移动,故D正确.
故选C。
考查方向
解题思路
在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极,据此分析.
易错点
不清楚电解池的工作原理,不会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,缺乏分析能力.
知识点
铁及其化合物有重要用途,如聚合硫酸铁
请回答下列问题:
14.若A为
15.若B为


16.若C为







17.为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量



已知:


滴定选用的指示剂及滴定终点观察到的现象__________.
溶液Ⅰ中铁元素的总含量为__________ 

正确答案
3Fe+4H2O(g)=Fe304+4H2;
解析
根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁.硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3−氧化Fe2+为Fe3+,本身被还原为Cl−,根据化合价升降相等配平,配平后的离子方程式为:6Fe2++ClO3−+6H+═6Fe3++Cl−+3H2O,故答案为:6Fe2++ClO3−+6H+═6Fe3++Cl−+3H2O;
考查方向
解题思路
铁与水蒸气在高温下反应生成四氧化三铁和氢气;
正确答案
6Fe2++ClO3﹣+6H+═6Fe3++Cl﹣+3H2O;
解析
根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁.硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3−氧化Fe2+为Fe3+,本身被还原为Cl−,根据化合价升降相等配平,配平后的离子方程式为:6Fe2++ClO3−+6H+═6Fe3++Cl−+3H2O,故答案为:6Fe2++ClO3−+6H+═6Fe3++Cl−+3H2O;
考查方向
解题思路
溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3−氧化Fe2+为Fe3+,本身被还原为Cl−,根据得失电子相等.电荷守恒.质量守恒配平。
正确答案
1.3.2.K2FeO4.3.H2O;
解析
KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O,故答案为:1.3.4.2.K2FeO4.3.2.H2O;
考查方向
解题思路
若C为KKO3和KOH的混合物,与Fe2O3加热共融制得高铁酸钾,则缺项物质为K2FeO4和H2O,根据得失电子相等.质量守恒配平;
正确答案
淀粉;溶液由蓝色变无色且保持半分钟不变色;5.6; 偏高.
解析
Fe3+氧化I−生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
由2Fe3++2I−═2Fe2++I2.I2+2S2O32−═2I−+S4O62−可得:Fe3+~S2O32−,则n(Fe3+)=n(S2O32−)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:56g/mol×0.002mol/0.02L=5.6g/L;H2O2也能氧化I−生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,故答案为:5.6;偏高;
考查方向
解题思路
反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;根据反应2Fe3++2I−═2Fe2++I2.I2+2S2O32−═2I−+S4O62−找出关系式Fe3+~S2O32−,然后根据关系式计算出铁离子的物质的量,再根据c=nV计算出铁元素含量;根据双氧水对消耗S2O32−的物质的量的影响判断误差;
工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
18.某温度下,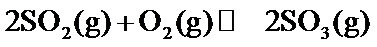
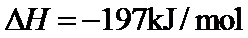
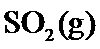
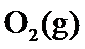
19.若体积不变的条件下,下列措施中有利于提高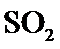
20.在硫酸工业生产过程中,有反应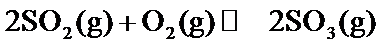
21.能判断该反应达到平衡状态的依据是___________。
22.在
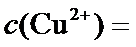
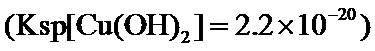
23.若在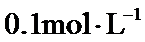
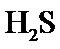
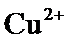
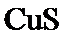
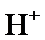

正确答案
0.56 ,减小
解析
根据反应2SO2(g)+O 2(g)⇌2SO3(g)△H=−197kJ/mol,当放出394kJ的热量时,生成SO3的物质的量为394/197×2mol=4mol,所以平衡时SO2的浓度为 (8.0mol−4mol)/10L=0.4mol/L,SO3的浓度为0.4mol/L,O2的浓度为 (20mol−2mol)/10L=1.8mol/L,所以K=0.42/(0.42×1.8)=0.56,该反应为放热反应,所以升高温度平衡向逆反应方程移动,平衡常数减小,故答为:0.56;减小。
考查方向
解题思路
根据热化学方程式及放出的热量可计算出平衡时各物质的物质的量,进而求得平衡浓度,根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数,根据温度对平衡的影响判断K的变化;
易错点
缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
正确答案
解析
A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率,所以通入氧气,二氧化硫的转化率提高,故A正确;
B.减小一种反应物的浓度可以降低另一种反应物的转化率,所以移出氧气,二氧化硫的转化下降高,故B错误;
C.该反应为体积减小的反应,增大压强,平衡向体积减小的方向移动,二氧化硫的转化率提高,故C正确;
D.减小压强,平衡向体积增大的方向移动,二氧化硫的转化率减小,故D错误;
E.加入催化剂,对平衡没有影响;
故选AC;
考查方向
解题思路
A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率;
B.减小一种反应物的浓度可以降低另一种反应物的转化率;
C.增大压强,平衡向体积减小的方向移动;
D.减小压强,平衡向体积增大的方向移动;
E.加入催化剂,对平衡没有影响;
易错点
缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
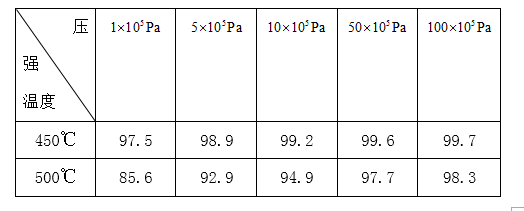
正确答案
450℃ 1×105Pa
解析
根据表中数据,在温度一定时,压强越大,二氧化硫的转化率越高,但增加的幅度不大,在压强一定时,温度越高转化率越小,考滤生成成本等因素,所以选择的条件是450℃,1×105Pa,故答案为:450℃;1×105Pa;
考查方向
解题思路
根据表中数据,在温度一定时,压强对转化率的影响,在压强一定时,温度对转化率的影响,据此选择合适的条件;
易错点
:缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
正确答案
解析
A.该反应为体积减小的反应,所以容器的压强不变,反应达到平衡状态,故A正确;
B.该反应前后气体质量守恒,体积不变,所以混合气体的密度不变,不能判断反应是否处于平衡状态,故B错误;
C.混合气体中SO3的浓度不变,则反应处于平衡状态,故C正确;
D.C(SO2)=C(SO3),不能说明正逆反应速率是否相等,故D错误;
E.v 正(SO2)=v 正(SO3),都是指正反应速率,不能确定与逆反应的关系,故E错误;
F.v 正(SO3)=2v 逆(O2),说明正逆反应速率相等,所以反应处于平衡状态,故F正确,故选:ACF.
考查方向
解题思路
根据正逆反应速率相等.各组份的组成不变以及某些外部特征可判断反应是否处于平衡状态.
易错点
缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
正确答案
2.2×10-8 0.2
解析
根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH−)=10−6mol/L,Ksp[Cu(OH)2]=2.2×10−20,则c(Cu2+)=2.2×10-8mol•L−1,在0.1mol•L−1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42−)不变,为0.1mol•L−1,由电荷守恒可知c(H+)为0.2mol•L−1,故答案为:2.2×10-8;0.2.
考查方向
解题思路
溶液的pH=8即c(OH−)=1×10−6 mol•L−1,根据Ksp[Cu(OH)2]=c(Cu2+)•c2(OH−)计算c(Cu2+);根据溶液的电中性计算H+浓度。
正确答案
2.2×10-8 0.2
解析
根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH−)=10−6mol/L,Ksp[Cu(OH)2]=2.2×10−20,则c(Cu2+)=2.2×10-8mol•L−1,在0.1mol•L−1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42−)不变,为0.1mol•L−1,由电荷守恒可知c(H+)为0.2mol•L−1,
故答案为:2.2×10-8;0.2.
考查方向
解题思路
溶液的pH=8即c(OH−)=1×10−6 mol•L−1,根据Ksp[Cu(OH)2]=c(Cu2+)•c2(OH−)计算c(Cu2+);根据溶液的电中性计算H+浓度.
易错点
缺乏对平衡状态的判断.不会运用盖斯定律的应用.溶度积常数的有关计算以及物质的量浓度的有关计算等。
X.Y.Z.Q.R是五种短周期元素,原子序数依次增大.X是原子半径最小的主族元素;Y元素最高正价与最低负价之和为0;Q与X同主族,;Z.R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
24.①五种元素中,原子半径最大的是 ,非金属性最强的是 .(写元素符号)
②X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)
③由以上某些元素组成的化合物A.B.C.D有如下转化关系:
25.工业合成氨时,合成塔中每产生
①工业合成氨的热化学方程式是 .
②已知:N≡N的键能为945.8kJ/mol,H﹣H的键能为436.0kJ/mol,则断开1mol N—H键所需的能量是 kJ.
26.氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为:

正确答案
① Na O .② C2H2 ③ 
解析
X.Y.Z.Q.R是五种短周期元素,原子序数依次增大.X是原子半径最小的主族元素,则X为H元素;Z.R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素.R为Al;Y元素最高正价与最低负价之和为0,由原子序数可知,只能处于第ⅣA族,而其原子序数又小于O元素,故Y为碳元素;Q与X同主族,结合原子序数可知Q为Na;
①所有元素中H原子半径最小,同周期自左而右原子半径减小.非金属增强,同主族自上而下原子半径增大.非金属性减弱,故上述五种元素中,Na的原子半径最大,O的非金属性最强,
故答案为:Na;O;
②H与C能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质为C2H2,
故答案为:C2H2;
③由以上某些元素组成的化合物A.B.C.D有如下转化关系:

故答案为:
考查方向
解题思路
X.Y.Z.Q.R是五种短周期元素,原子序数依次增大.X是原子半径最小的主族元素,则X为H元素;Z.R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素.R为Al;Y元素最高正价与最低负价之和为0,由原子序数可知,只能处于第ⅣA族,而其原子序数又小于O元素,故Y为碳元素;Q与X同主族,结合原子序数可知Q为Na;
易错点
不知道结构性质位置关系应用.热化学方程式书写.键能与反应热关系.原电池等,无法推断元素,需注意元素最高正价与最低负价之和均为0,可以为ⅣA族元素,也可以为H元素,中学中较少涉及H元素的负化合价。
正确答案
①N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.2kJ/mol
② 391 kJ.
解析
①生成2mol氨气放出的热量为46.1kJ×2=92.2kJ,反应热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=−92.2kJ/mol,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=−92.2kJ/mol;
②设断开1mol N−H键所需的能量是xkJ,则945.8kJ/mol+3×436.0kJ/mol−6×xkJ/mol=−92.2kJ/mol,解得x=391,
故答案为:391;
考查方向
解题思路
①计算生成2mol氨气放出的热量,注明物质的聚集状态与反应热书写热化学方程式;②反应热=反应物总键能−生成物总键能;
易错点
不知道结构性质位置关系应用.热化学方程式书写.键能与反应热关系.原电池等,无法推断元素,需注意元素最高正价与最低负价之和均为0,可以为ⅣA族元素,也可以为H元素,中学中较少涉及H元素的负化合价。
正确答案
2NH3+6OH﹣﹣6e﹣=N2+6H2O
解析
原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为:2NH3+6OH−−6e−=N2+6H2O,
故答案为:2NH3+6OH−−6e−=N2+6H2O。
考查方向
解题思路
原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水.
易错点
不知道结构性质位置关系应用.热化学方程式书写.键能与反应热关系.原电池等,无法推断元素,需注意元素最高正价与最低负价之和均为0,可以为ⅣA族元素,也可以为H元素,中学中较少涉及H元素的负化合价。
X.Y.Z.M.W均为周期表中前四周期的元素.X元素的基态原子外围电子排布式为3s2;Y原子的L能层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;W为过渡元素,它的基态原子外围电子排布成对的电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
27.W的基态原子的外围电子排布图为 其基态原子核外有 种不同电子运动状态;
28.Z的氢化物的沸点比其下一周期同族元素氢化物的沸点高的原因是
29.W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为 ;与YM分子互为等电子体的离子的化学式为 。(写一种即可)
30.W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A.B所示:图B中原子堆积方式为 ,A.B中W原子的配位数之比为 .A.B晶胞的棱长分别为a cm和b cm,则A.B两种晶体的密度之比为 。
31.X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为 .
正确答案

解析
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则B为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为:1s22s22p63s23p63d64s2,故W为Fe元素,W为Fe元素,E为26号元素,其核外电子总数为26,核外电子排布为:1s22s22p63s23p63d64s2,其基态原子的外围电子排布图为:
故答案为:
考查方向
解题思路
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为1s22s22p63s23p63d64s2,故W为Fe元素,据此进行解答。
易错点
无法运用位置、结构与性质关系的综合应用、晶胞的计算等知识,题目难度中等,不会推断各元素,没有掌握原子结构与元素周期律、元素周期律的关系。
正确答案
氨分子间形成氢键
解析
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则B为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为:1s22s22p63s23p63d64s2,故W为Fe元素,Z为N元素,N的氢化物为正确,其下一周期同族元素氢化物为H3P,由于氨气分子中存在氢键,所以氨气的沸点高于磷化氢,故答案为:氨分子间形成氢键
。
考查方向
解题思路
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为1s22s22p63s23p63d64s2,故W为Fe元素,据此进行解答。
易错点
无法运用位置、结构与性质关系的综合应用、晶胞的计算等知识,题目难度中等,不会推断各元素,没有掌握原子结构与元素周期律、元素周期律的关系。
正确答案
0 CN﹣或C22﹣
解析
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则B为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为:1s22s22p63s23p63d64s2,故W为Fe元素,W与YM易形成配合物W(YM)5为Fe(CO)5,Fe与CO易形成配合物Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0,则Fe的化合价为0;
根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,所以与CO分子互为等电子体的离子的化学式为CN−或C22−,
故答案为:0;CN−或C22−;
考查方向
解题思路
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为1s22s22p63s23p63d64s2,故W为Fe元素,据此进行解答。
易错点
无法运用位置、结构与性质关系的综合应用、晶胞的计算等知识,题目难度中等,不会推断各元素,没有掌握原子结构与元素周期律、元素周期律的关系。
正确答案
面心立方堆积 2:3 b3:2a3
解析
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则B为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为:1s22s22p63s23p63d64s2,故W为Fe元素,以顶点Fe原子研究,与之最近的原子处于面心,每个顶点为12个面共用,故面心立方堆积中Fe原子配位数为12,体心立方堆积中Fe原子配位数为8,故A.B两种堆积中配位数之比为8:12=2:3;
A中原子占据体心和顶点,为体心立方结构,原子数为1+8×1/8=2,B中占据顶点和面心,原子数为6×1/2+8×1/8=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;A.B晶胞的棱长分别为a cm和b cm,体积分别为a3cm3.b3cm3,晶胞的密度等于晶胞中铁原子的质量与体积的比,为 2m/a3:4m/b3=b3:2a3,
故答案为:面心立方;2:3;b3:2a3;
考查方向
解题思路
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为1s22s22p63s23p63d64s2,故W为Fe元素,据此进行解答。
易错点
30题为难点,需要明确均摊法在晶胞计算中的应用。
正确答案
FeMg2或Mg2Fe
解析
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则B为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为:1s22s22p63s23p63d64s2,故W为Fe元素,
Fe位于面心和顶点,数目为:6×1/2+8×1/8=4,Mg原子位于体心,数目为8,则其化学式为:FeMg2或Mg2Fe,故答案为:FeMg2或Mg2Fe.
考查方向
解题思路
X.Y.Z.M.W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为1s22s22p63s23p63d64s2,故W为Fe元素,据此进行解答。
易错点
31题为难点,需要明确均摊法在晶胞计算中的应用。