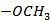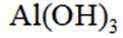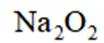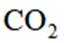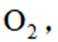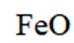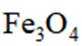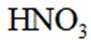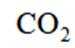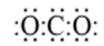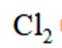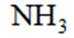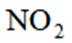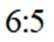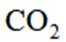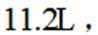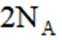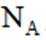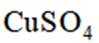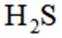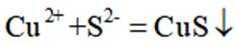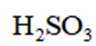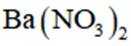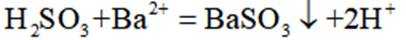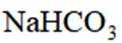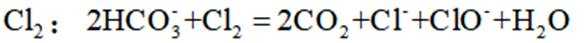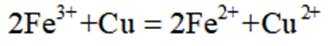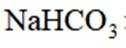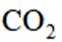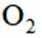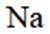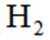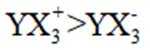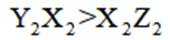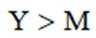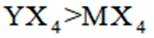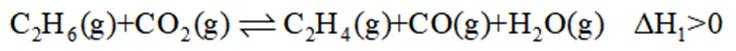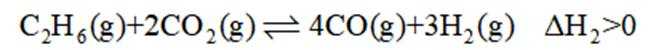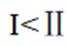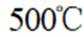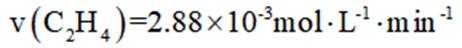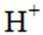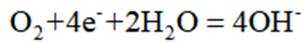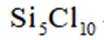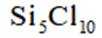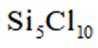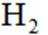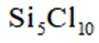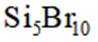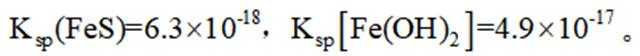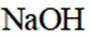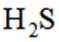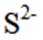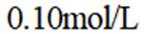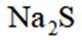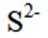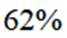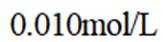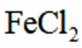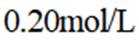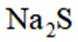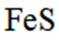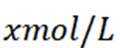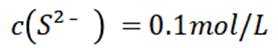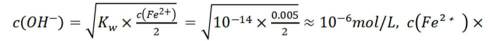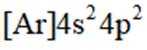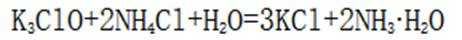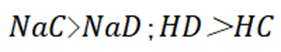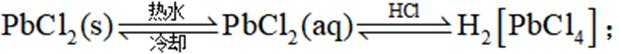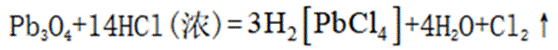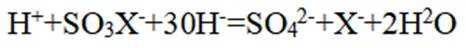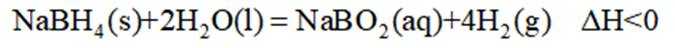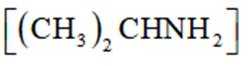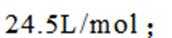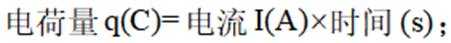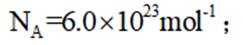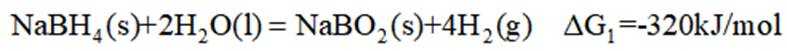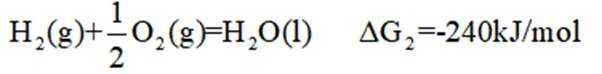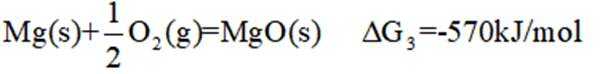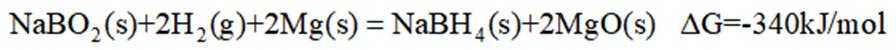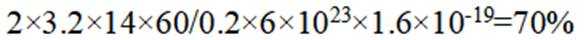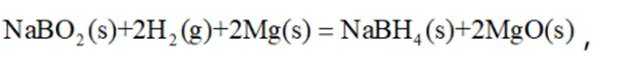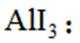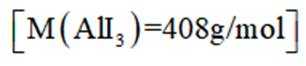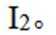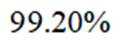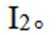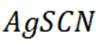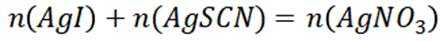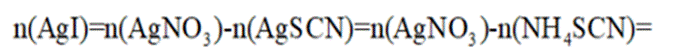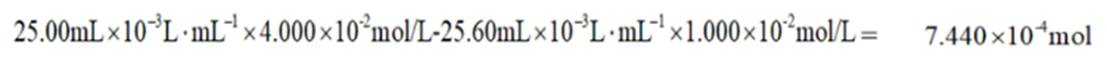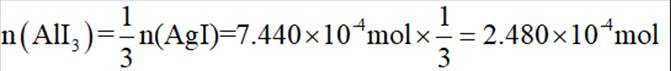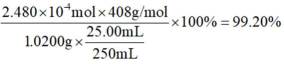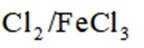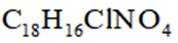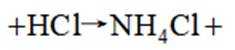- 真题试卷
- 模拟试卷
- 预测试卷
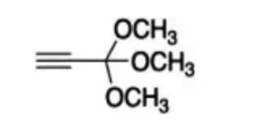
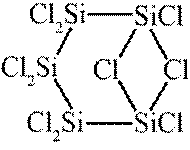
按物质组成分类,
正确答案
解析
本题主要考查了物质的分类这一知识点,需要明确酸、碱、盐、混合物的定义和特征,根据给定物质的组成和性质来判断其所属类别。
酸是在水溶液中电离出的阳离子全部是氢离子的化合物;碱是在水溶液中电离出的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物;混合物是由两种或多种物质混合而成的物质。
故本题答案为:C。
下列说法不正确的是
正确答案
解析
本题主要考查了一些物质的性质及应用的知识点。包括氢氧化铝的性质与应用、过氧化钠的性质与用途、氧化亚铁的性质以及硝酸的性质与保存方法等。
A选项氢氧化铝能用于治疗胃酸过多,A错误。
B选项过氧化钠能与二氧化碳反应产生氧气,可作供氧剂,B正确。
C选项氧化亚铁被氧化生成的不是四氧化三铁沉淀,C正确。
D选项硝酸见光易分解,应保存在棕色瓶中,D正确。
故本题答案为:AC。
下列表示不正确的是
正确答案
解析
本题主要考查了一些常见物质的电子式、电子云图、空间填充模型以及键线式等知识点。
A选项二氧化碳的电子式应该是:O::C::O:,A错误。
B选项氯气中共价键的电子云图表示正确,B正确。
C选项氨气的空间填充模型表示正确,C正确。
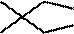
D选项3,3-二甲基戊烷的键线式表示正确,D正确。
故本题答案为:A。
下列说法不正确的是
正确答案
解析
本题主要考查了化学实验装置的用途、常见危险化学品标识以及一些物质的性质等知识点。
A选项铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,装置①可以通过铜丝与浓硫酸反应,生成的二氧化硫能使品红溶液褪色,可用于检验气态产物二氧化硫,A正确。
B选项图②标识表示易燃类物质,B正确。
C选项氯化铵与氢氧化钙反应生成氨气,氨气的密度比空气小,应用向下排空气法收集,而装置②是向上排空气法,不能用于收集氨气,C错误。
D选项碘在水中溶解度较小,易溶于有机溶剂,装置④可以利用萃取原理从碘水中萃取碘,故D正确。
化学与人类社会可持续发展息息相关。下列说法不正确的是
正确答案
解析
本题主要考查了金属的冶炼、煤的气化、抗氧化剂的作用以及混凝剂的作用等知识点。涉及到化学变化与物理变化的区别、常见化学物质的性质和用途等内容。
A选项:如氧化铜可以在高温下用一氧化碳还原为铜,A正确。
B选项:煤的气化是一个化学变化过程,是将煤转化为一氧化碳、氢气等可燃性气体,B错误。
C选项:维生素C具有抗氧化性,能防止水果被氧化,从而延长保质期,C正确。
D选项:聚合氯化铝可以使污水中的细小悬浮物聚集成大颗粒,便于沉淀等后续处理,D正确。
故本题答案为:B。
利用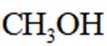
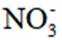
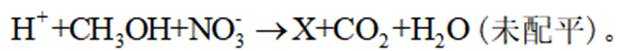
正确答案
解析
本题主要考查了化学实验装置的用途、常见危险化学品标志以及物质的分离与制取等知识点
A选项根据原子守恒和电荷守恒,配平后的方程式为
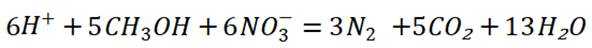
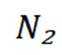
B选项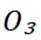
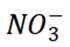
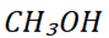
C选项从配平后的方程式可以看出,氧化剂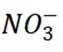
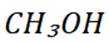
D选项由方程式可知,生成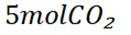
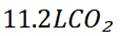
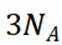
故本题答案为:C。
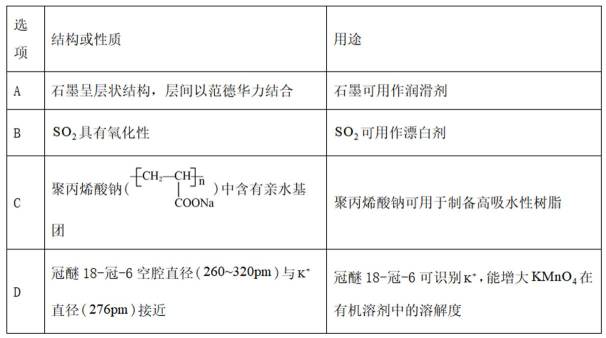
物质微观结构决定宏观性质,进而影响用途。下列结构或性质不能解释其用途的是
正确答案
解析
本题主要考查了物质的微观结构与宏观性质、用途之间的关系,涉及到石墨的结构与润滑性、二氧化硫的性质与用途、聚丙烯酸钠的结构与吸水性、冠醚的结构与对离子的作用等知识点。
A选项石墨呈层状结构且层间以范德华力结合,这种结构使得石墨层间容易滑动,所以可用作润滑剂,该选项合理。
B选项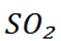
C选项聚丙烯酸钠中含有亲水基,所以具有良好的吸水性,可用于制备高吸水性树脂,该选项合理。
D选项冠醚18-冠-6的空腔直径与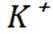
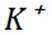
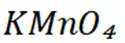
故本题答案为:B。
下列离子方程式正确的是
正确答案
解析
本题主要考查离子方程式的书写及正误判断,涉及到一些物质在溶液中的反应以及离子的性质等知识点。
A选项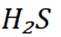
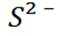
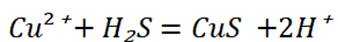
B选项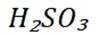
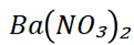
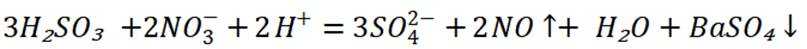
C选项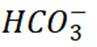
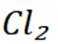
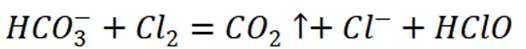
D选项该离子方程式符合客观事实,原子守恒、电荷守恒,D正确。【分值】3
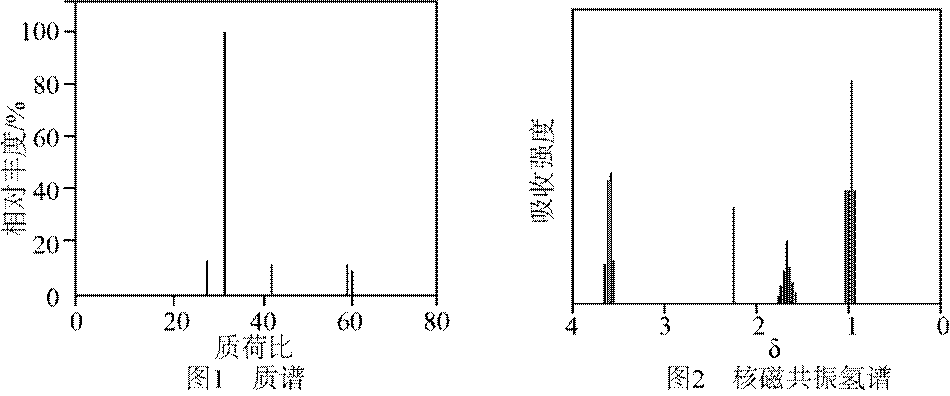
有机物A经元素分析仪测得只含碳、氢、氧3种元素,红外光谱显示A分子中没有醚键,质谱和核磁共振氢谱示意图如下。下列关于A的说法正确的是
正确答案
解析
本题主要考查了有机物的结构与性质相关的知识点,包括根据质谱图和核磁共振氢谱图分析有机物的组成和结构,以及根据有机物的结构推测其可能具有的化学性质
仅根据所给信息不能确定该有机物能发生水解反应,A错误。
B选项该有机物含有羧基才能与
C选项仅从这些信息无法推断出能与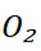
删除D选项该有机物含有羟基能与钠反应生成氢气,D正确。
X、Y、Z、M四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y与M同主族,Y与Z核电荷数相差2,Z的原子最外层电子数是内层电子数的3倍。下列说法不正确的是
正确答案
解析
本题考查了元素周期表、元素周期律、分子的空间结构、分子的极性、共价晶体的性质、氢化物的稳定性等知识点。
A选项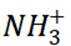
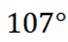
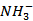
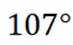
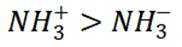
B选项
C选项氮元素形成的共价晶体熔点比磷元素形成的共价晶体熔点高,C正确。
D选项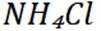
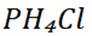
故本题答案为:B。
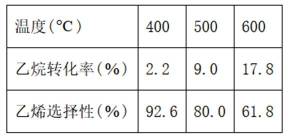
二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.
II.
向容积为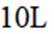
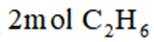
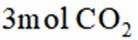
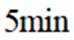
正确答案
解析
本题考查了化学反应的活化能、反应速率的计算、化学平衡的移动以及转化率等知识点。
A选项温度越高,反应速率越快,达到相同转化率所需时间越短,从表中数据可知,温度越高,乙烷转化率越大,说明反应速率越快,所以反应活化能: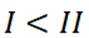
B选项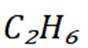
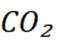
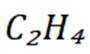
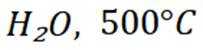
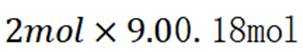
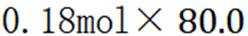
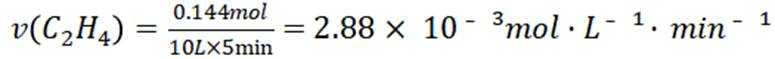
C选项及时移除
D选项增大投料比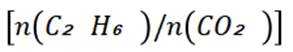
故本题答案为:D。
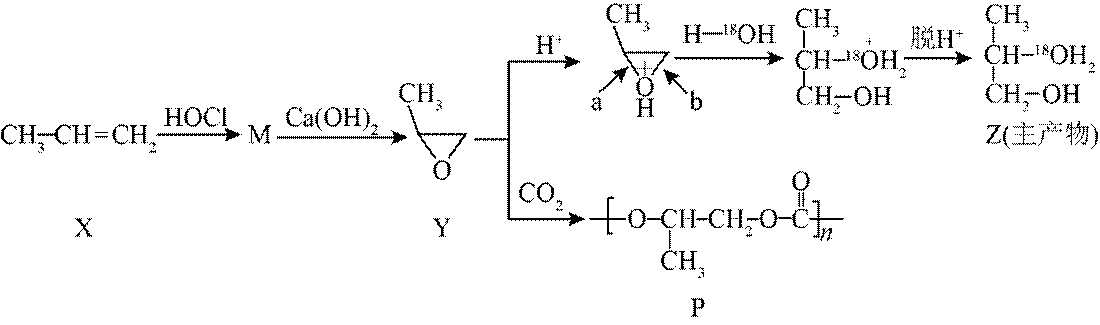
丙烯可发生如下转化(反应条件略):
下列说法不正确的是
正确答案
解析
本题考查了有机化学反应的类型(加成、加聚)、同分异构体、化学键的断裂、催化剂对反应速率的影响以及环保等知识点
A选项丙烯与水加成生成丙醇,丙醇有1-丙醇和2-丙醇两种结构,且互为同分异构体,A正确。
B选项氢离子可以作催化剂,能提高反应速率,B正确。
C选项Y到Z的反应中,a处的碳氧键断裂,所以a处碳氧键更易断裂,C正确。
D选项Y到P是发生加聚反应生成高分子化合物,该工艺有利于减少二氧化碳的排放,从而有利于减轻温室效应,D错误
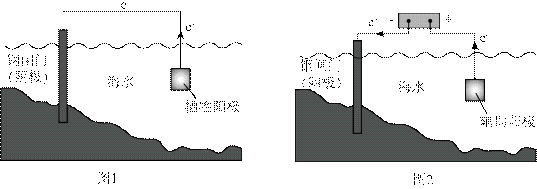
金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两种对海水中钢闸门的防腐措施示意图:
下列说法正确的是
正确答案
解析
本题主要考查了金属的电化学腐蚀与防护的相关知识点,包括阳极、阴极的反应,以及外加电压对防护效果的影响等。
A选项图1中阳极材料失去电子,图2中是辅助阳极,不是阳极材料本身失去电子,所以A错误。
B选项图2中,外加电压偏高时,钢闸门作阴极,发生还原反应,氧气在阴极得电子,可发生反应: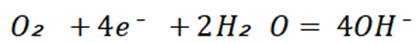
C选项图2中,外加电压保持恒定不变,不能确定是否有利于提高对钢闸门的防护效果,C错误
D选项当钢闸门表面的腐蚀电流为零时,只是说明钢闸门腐蚀速率为零,但化学反应仍在进行,D错误。
故本题答案为:B。

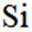
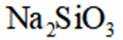
正确答案
解析
本题主要考查了原子杂化轨道、物质的结构、化学反应以及一些物质性质的比较等知识点。涉及到对给定分子结构的分析、与其他物质反应的判断、酸的强弱以及沸点比较等内容。
A选项从给出的结构示意图看,该选项说法有可能正确,A错误。
B选项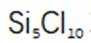
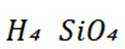
C选项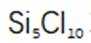
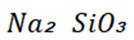
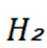
D选项相对分子质量越大,沸点越高,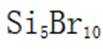
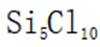
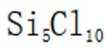
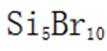
故本题答案为:A。
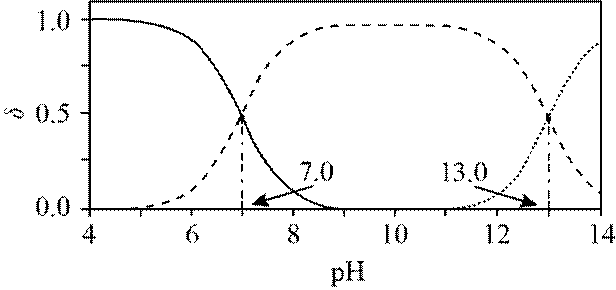
室温下,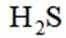
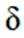
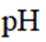
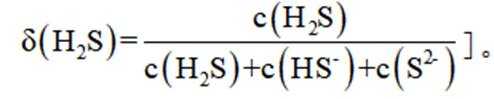
下列说法正确的是
正确答案
解析
本题主要考查了溶解平衡、酸碱中和滴定、盐类水解以及根据溶度积判断沉淀的生成等知识点
A选项已知.
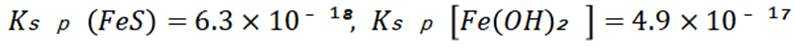
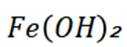
B选项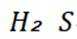
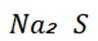
C选项设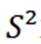

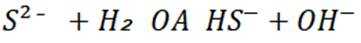
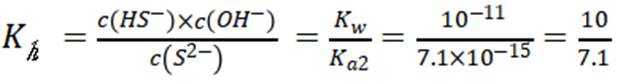
可得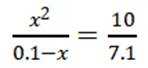
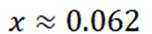
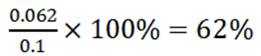
D选项混合后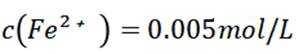
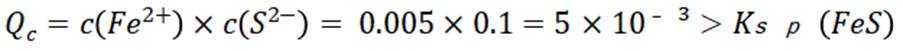
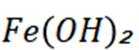
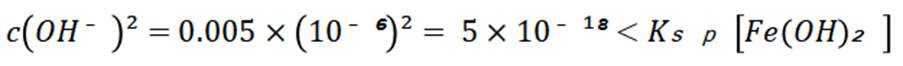
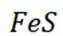
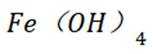
故正确答案为C
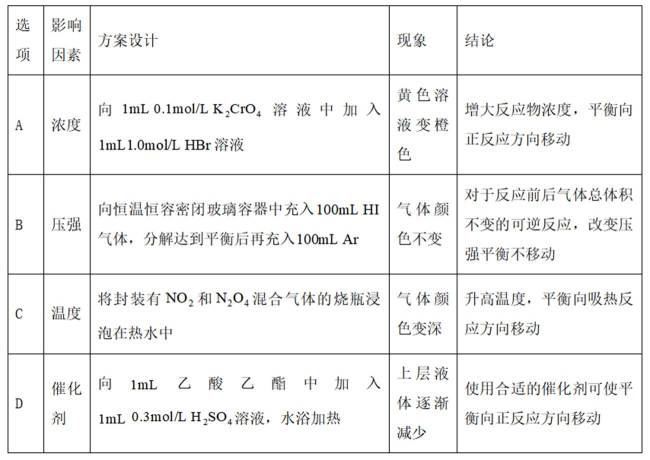
为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是
正确答案
解析
本题主要考查了化学平衡移动的影响因素,包括浓度、压强、温度、催化剂等对化学平衡状态的影响。同时也涉及到一些具体反应及实验现象的分析和判断。
A选项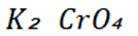
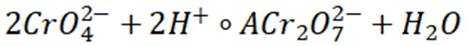
B选项对于反应前后气体总体积不变的反应,充入惰性气体,压强虽然增大,但各物质的浓度不变,平衡不移动,B正确。
C选项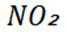
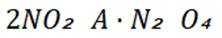
D选项乙酸乙酯的水解反应是可逆反应,但加入硫酸是作催化剂还是反应物不明确,不能确定平衡移动方向,D错误。
氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1,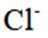
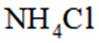
(2)下列有关单核微粒的描述正确的是_______。
A. 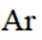
B. 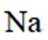
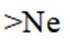
C. 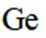
D. 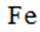
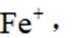
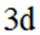
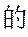
(3)化合物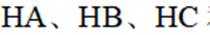
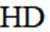
①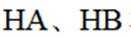
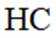
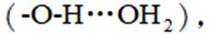
②已知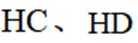
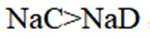
正确答案
(1)①. 12 ②.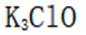
(2)AB
(3) ①. 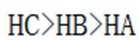
解析
本题考查了晶胞计算、元素化学性质、化学式确定、化学方程式书写、电子排布、电离能、氢键、原子结构与性质以及酸碱性质等知识点。
(1)由晶胞图可知,与每个Cl紧邻的阳离子有8个,所以Cl的配位数为8;配位数
化合物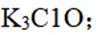
(2)A选项:Ar的基态原子电子排布方式只有一种,A正确。
B选项:Na的第二电离能大于Ne的第一电离能,B正确。
C选项:Ge的基态原子简化电子排布式为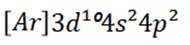
D选项:Fe原子变成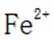
故本问答案为:AB。
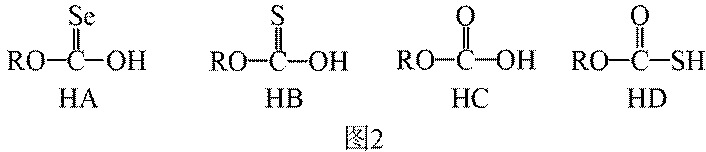
(3)①0的电负性大于S,电负性越大,对氢原子的吸引力越大,形成的氢键越强,所以按照氢键由弱到强的排序为HA<HB<HC;
②HC中含有-COOH,HD中含有-CSH,-COOH的酸性大于-CSH,所以钠盐的碱性
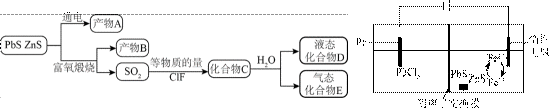
矿物资源的综合利用有多种方法,如铅锌矿(主要成分为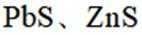
已知:①
②电解前后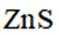
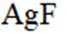
请回答:
(1)根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果,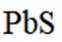
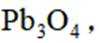
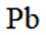
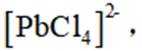
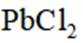
(2)下列说法正确的是_______。
A. 电解池中发生的总反应是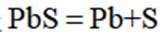
B. 产物B主要是铅氧化物与锌氧化物
C.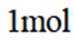
D. 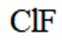
(3)D的结构为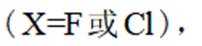
①实验方案:取D的溶液,加入足量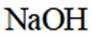
②写出D(用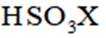
正确答案
(1) ①. 还原性 ②.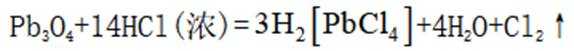
(2)AB
(3) ①. 加入足量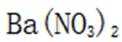

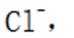
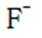
解析
本题主要考查了元素化合物的性质、氧化还原反应、化学方程式的书写、物质的分离提纯等知识点。
(1)在富氧煅烧和通电电解过程中,P6S中的硫元素被氧化生成了二氧化硫,体现了还原性。产物B中有少量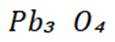
加入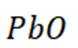
(2)A选项,电解池中发生的反应不是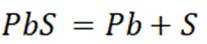

B选项,根据已知信息可知产物B主要是铅氧化物与锌氧化物,B正确。
C选项,化合物C为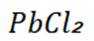
D选项,无法比较ClF和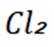
故本题答案为:AB。
(3)①实验方案:取D的溶液,加入足量NaOH溶液,加热充分反应,然后过滤,向滤液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,则X为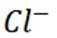
②D(用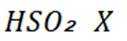
氢是清洁能源,硼氢化钠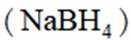
请回答:
(1)该反应能自发进行的条件是_______。
A. 高温 B. 低温 C. 任意温度 D. 无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
A. 升高溶液温度 B. 加入少量异丙胺
C. 加入少量固体硼酸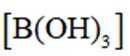
(3)为加速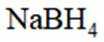
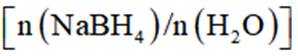
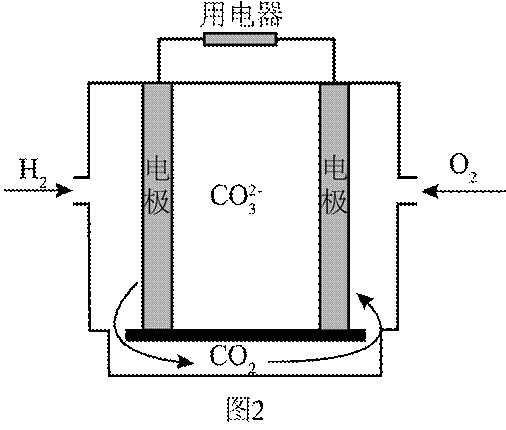
(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图2所示,正极上的电极反应式是_______。该电池以
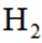
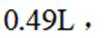
[已知:该条件下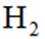
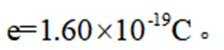
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方法,将反应副产物偏硼酸钠(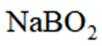
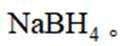
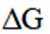
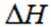
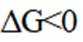
I.
II.
III.
请书写一个方程式表示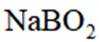
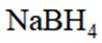

正确答案
(1)C
(2)A
(3)随着投料比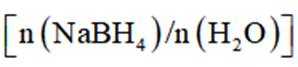
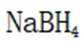
(4) ①. 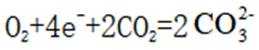
(5)
解析
本题考查了化学反应自发进行的条件、影响反应速率的因素、电极反应式的书写、电能转化率的计算以及盖斯定律的应用等知识点。
(1)由
(2)选项A,升温,反应速率快。选项B,加入异丙胺,反应速率降低。选项C,加硼酸,反应速率降低。选项D,加压忽略体积,浓度不变,反应速率降低。答案选A。
(3)比例增大,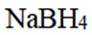
(4)根据题干,该燃料电池中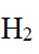
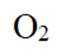
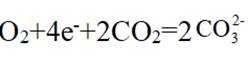
(5)结合题干信息,要使得氢原子利用率为100%,可由
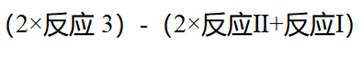
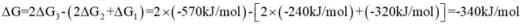
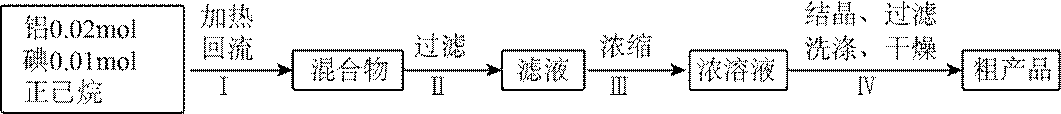
某小组采用如下实验流程制备
已知: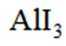
请回答:
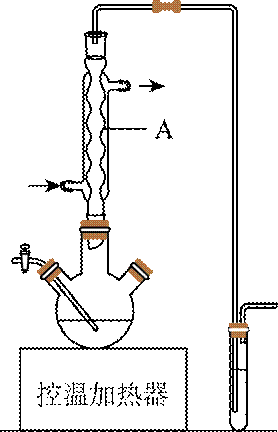
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是_______,判断步骤I反应结束的实验现象是_______。
(2)下列做法不正确的是_______。
A. 步骤I中,反应物和溶剂在使用前除水
B. 步骤I中,若控温加热器发生故障,改用酒精灯(配石棉网)加热
C. 步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜
D. 步骤Ⅳ中,使用冷的正己烷洗涤
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证_______。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中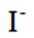
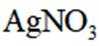
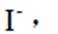
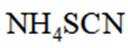
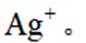
①从下列选项中选择合适的操作补全测定步骤_______。
称取产品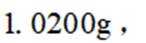
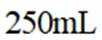
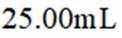
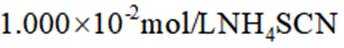
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂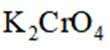
d.滴加指示剂硫酸铁铵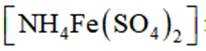
e.准确移取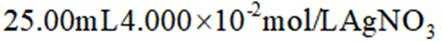
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是_______。
③三次滴定消耗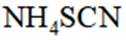
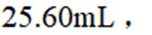
正确答案
(1) ①. 球形冷凝管 ②. 三颈烧瓶溶液紫色褪去
(2)BC
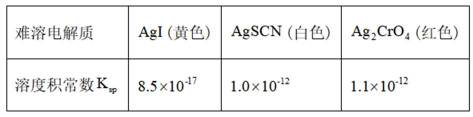
(3)加入淀粉溶液,若溶液出现蓝色,则含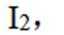
(4) ①.a e d f ②.抑制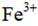
解析
本题考查了实验仪器的识别、实验现象的判断、实验操作的正误判断、物质的检验、实验步骤的补充、实验误差的分析以及纯度的计算等知识点。
(1)由实验装置图中仪器的结构可知,图中仪器A的名称为球形冷凝管,碘溶于正己烷使溶液显紫红色,当碘反应完全后,紫色褪去因此,三颈烧瓶中紫色褪去。
(2)选项A.吸水强,先除水。选项B.乙烯禁止使用明火。选项C.在空气中易氧化,要有保护气。选项D.要用冷的正己烷洗涤。
综上所述,本题选BC。
(3)因为碘易溶于正己烷,而可溶于热的正己烷、不易溶于冷的正己烷,所以,加入淀粉溶液,若溶液出现蓝色,则含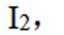
(4)①经过水洗后,需要润洗,ab中从滴定管尖嘴也需要润洗,选a;移取待测液后,同时需要准确移取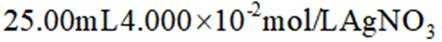
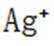
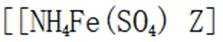
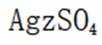
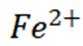
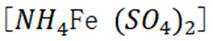
②加入稀酸B的作用是抑制
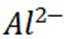
③在滴定过程中,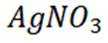
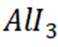
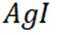
其中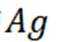
则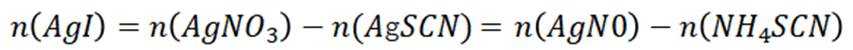
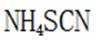
由I守恒可知:
则产品纯度为:
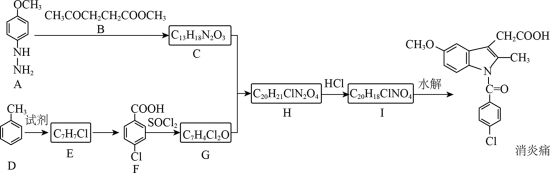
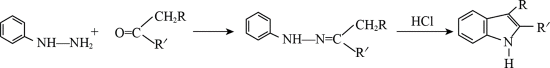
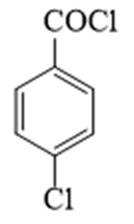
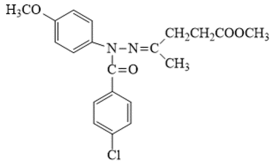
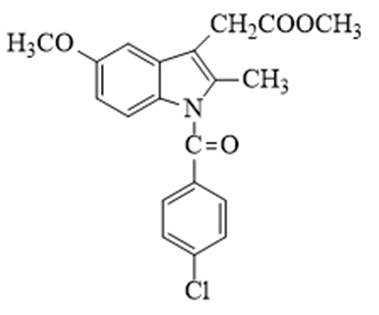
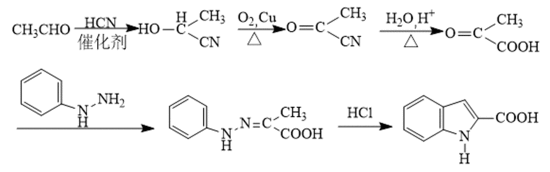
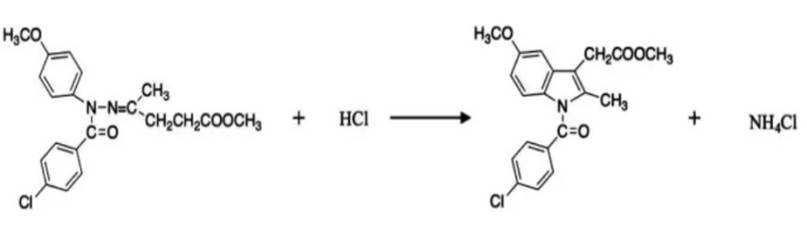
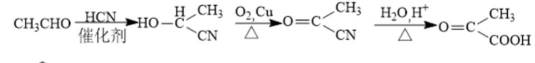
某研究小组按下列路线合成抗炎镇痛药“消炎痛”(部分反应条件已简化)。
已知:
请回答:
(1)化合物F的官能团名称是_______。
(2)化合物G的结构简式是_______。
(3)下列说法不正确的是_______。
A. 化合物A的碱性弱于
B. 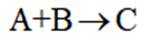
C. 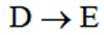
D. “消炎痛”的分子式为
(4)写出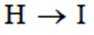
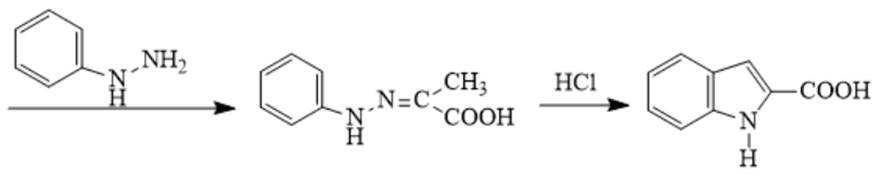
(5)吗吲哚-2-甲酸(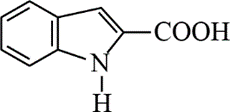
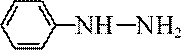
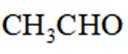
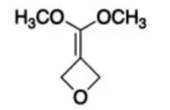
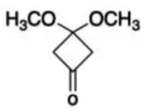
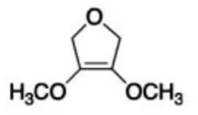
(6)写出4种同时符合下列条件的化合物B的同分异构体的结构简式_______。
①分子中有2种不同化学环境的氢原子;
②有甲氧基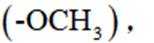
正确答案
(1)羧基、氯原子
(2)
(3)AD
(4)
(5)
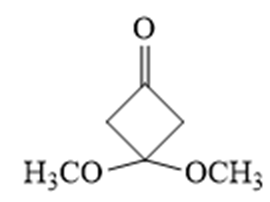
(6)
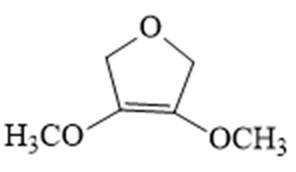
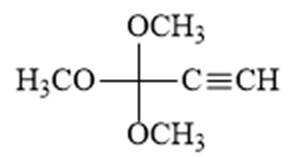
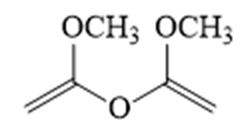
解析
本题主要考查了有机化学中的官能团、反应类型、有机物的结构与性质、有机合成路线设计以及同分异构体等知识点。
(1)由F的结构可知,F的官能团为羧基、碳氯键(氯原子);
(2)由分析得,G为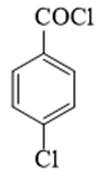
(3)A项,化合物A中氮原子上连接的基团较大,对氮原子上孤对电子的屏蔽作用较大,碱性较弱,而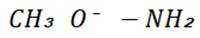
选项B.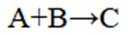
选项C.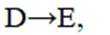
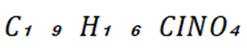
(4)化学方程式为:
(5)合成路线为:
(6)由B的结构简式可得,同分异构体中有2种不同化学环境的氢原子,说明其结构高度对称,且有