- 真题试卷
- 模拟试卷
- 预测试卷
5. 2013年诺贝尔化学奖授予“为复杂化学系统创立了多尺度模型”的三位美国科学家,使化学家能通过计算机模拟,更快获得比传统实验更精准的预测结果。以下说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.三聚氰胺(结构如图)六元环中的碳氮键键长相等。与制酚醛树脂相似,甲醛与三聚氰胺缩聚也可制得三聚氰胺树脂。以下关于三聚氰胺的叙述肯定错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列化合物中同分异构体数目最少的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.关于硫原子核外电子的叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.下列仪器名称书写正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.以下化学用语错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.有关物质用途的叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.乙炔是重要的基础有机化工原料,—些发达国家已从1994年开始淘汰煤—炼焦—电石—乙炔的生产工艺,我国也正在研究将煤直接用新热源——等离子体裂解获得乙炔的新方法,该方法不可能产生的效果是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.以下描述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.如下图,在25℃,101.3KPa下,将10mLO2全部压入左端盛有20mLN0的注射器中充分反应。以下对压入O2后左端注射器中的气体描述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.某学生用滴定的方法测定含有少量NaCl的小苏打固体中NaHCO3的质量分数,所用标准盐酸的浓度为0.1000mol/L。关于该实验的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.一个化学反应一般都有旧化学键的破坏和新化学键的形成。在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催化剂的反应历程),下列叙述正确的是( )
①使用催化剂可降低生产能耗
②该反应的热化学方程式为N2(g)+3H2(g) 
③相同状况下,lmol氮气和3mol氢气总能量高于2mol氨气的总能量
④相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.以NA表示阿伏加德罗常数,下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下图是已经合成的一种硫氮化合物的分子结构,下列说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.如图,a、b是两根碳棒。以下叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.一定温度下,下列溶液的离子浓度关系式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.下列气体的收集用错装置的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
19.某溶液含有NO3-、CH3COO-、A1O2-、S2-,若向其中加入过量的盐酸,充分搅拌,再加入过量的 NaOH溶液,溶液中大量减少的离子是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
20.往明矾溶液中加入氢氧化钡溶液,下列离子方程式可能正确的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
22.有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯加热至恒重测得的数据如下:
经分析得到的15.600g固体是纯净物。则下列叙述正确的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
21.某固体混合物可能含有NH4C1、NaOH、KOH、AgNO3、AlCl3、CuCl2中的几种,加适量水充分搅拌,得无色澄清溶液,取溶液进行如下实验:
①蘸取少量原溶液灼烧,未见火焰出现黄色;
②蘸取少量原溶液滴在PH试纸上,试纸显蓝色,与标准比色卡比较,pH约为11;
③取lmL原溶液加入3滴乙醛,水浴加热,试管内壁出现光亮的“银镜”。
根据上述实验现象,以下推测正确的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
24.从2014年4月15日零点开始,上海市空气质量实时发布系统将以实时空气质量指数替代原来的AQI指数。燃煤烟气和汽车尾气是引发AQI指数上升的主要污染源。因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。
汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) 
(1)该热化学反应方程式的意义是____________________________。
一定条件下用气体传感器测得该反应在不同时间的NO和CO浓度如下表:
(2)前2s内的平均反应速率υ(N2)_________(保留两位小数);CO的平衡转化率为_________。
(3)下列描述中能说明上述反应已达平衡的是________________。
a.2υ正(NO)=υ逆(N2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,并获得铵盐。
其中脱硫的总反应式:SO2+O3+2NH3+H2O → (NH4)2SO4+O2;
在(NH4)2SO4溶液中存在水解反应,常温下该水解反应的平衡常数表达式可表示为K=_________;
有三种铵盐溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ,若它们的物质的量浓度相等,c(NH)由大到小的顺序是____________________(填序号,下同);若它们的pH值相等,c(NH)由大到小的顺序是____________________。
正确答案
(1)2mol NO气体和2mol CO气体完全反应生成1mol N2和2 mol CO2气体放热Q kJ
(2)1.88×10-4 mol/(L·s) ; 25%
(3)bd
(4)
解析
解析已在路上飞奔,马上就到!
知识点
26.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有Al2O3、CaO、MnO、Fe2O3、FeO、SiO2等杂质,以此为原料提取硫酸镁晶体和氢氧化铝。
从硼镁泥中提取MgSO4·7H2O的流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀。
请完成下列填空:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有__________(注明规格)。
(2)加入的NaClO有三个作用,用离子方程式表示其中一个作用:_____________________。
已知MgSO4、CaSO4的溶解度如下表:
(3)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,操作步骤依次为蒸发浓缩、____________。
操作Ⅰ中的步骤之一是洗涤沉淀,具体的操作方法是_________________________ 。
(4)如果测得提供的硼镁泥的质量为100.0 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_____________。
(5)从硼镁泥提取硫酸镁晶体后的滤渣,主要还含有Al(OH)3、Fe(OH)3 ,MnO2、SiO2,先用稀盐酸除去MnO2和SiO2,请补全下面的流程图,完成从滤渣中获取Al(OH)3的方案(仿照上述流程图表示)。
正确答案
(1)10mL量筒、100mL容量瓶
(2)ClO-+Mn2++H2O→+2H++Cl-+ MnO2↓、ClO-+2Fe2++2H+→Cl-+2Fe3++H2O、ClO-+ H+
(3)趁热过滤 ;向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次。
(4)80.0%
(5)
解析
解析已在路上飞奔,马上就到!
知识点
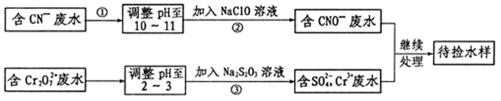
23.某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
请完成下列填空:
(1)HCN有剧毒,电子式是__________,其分子属于_____(填“极性”、“非极性”)分子。
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态:_________________________,其中最外层有________种不同能量的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是______。
a.相同条件下水溶液的pH:NaClO>Na2S2O3
b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3
d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为:_______________________。
(5)反应③中,每消耗0.5 mol Cr2O72-转移的电子数为___________;
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因__________________________。
正确答案
(1)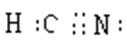
(2)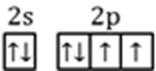
(3)bd;
(4)3S2O32-+4Cr2O72-+26H+→6SO42-+8Cr3++13H2O
(5)3.0NA(或1.806×1024)
(6)Cu2++2OH-→Cu(OH)2↓、Cu(OH)2(s)+S2-(aq) →CuS(s)+2OH-(aq)
或相同温度下,S(CuS)<S[Cu(OH)2],使沉淀的溶解平衡向更难溶的方向转化
解析
解析已在路上飞奔,马上就到!
知识点
25.FeCl2·4H2O可直接用于污水处理,作为还原剂和媒染剂,广泛用于印染、制造、医药和冶金等行业。某化学探究小组进行了FeCl2·4H2O的制备、结晶水含量测定的探究实验。
FeCl2·4H2O的制备:在一定浓度的盐酸溶液中,逐渐加入一定量的铁屑进行加热保温反应。经冷却、过滤、蒸发、趁热过滤、冷却结晶、固液分离、快速干燥制得。
(1)在蒸发、趁热过滤过程中必须采取的措施及理由是________________________。
(2)利用下图装置对所获晶体(FeCl2•nH2O)中结晶水的含量进行测定。

装置A是用浓盐酸和石灰石反应制取二氧化碳的装置,并希望能“随开随用、随关随停”,下图中可选用的发生装置是________(填写字母)。
该实验中选用浓盐酸和石灰石反应制取二氧化碳的理由是____________________。
(3)上述实验测定的实验数据记录如下:
若无需再进行第三次称量,则W的数值应为___________________。
计算n的实测值为_________(保留二位小数),相对误差为________(保留二位小数)。
正确答案
(1)在滤液中加入少许洗净的铁块,防止生成的氯化亚铁被氧化
(2)ac ;通过产生的CO2排尽装置中的空气,防止Fe2+被氧化;通过浓盐酸挥发出的氯化氢抑制Fe2+的水解
(3)84.028(或者84.027;84.029); 3.94;-1.50%
解析
解析已在路上飞奔,马上就到!
知识点
27.有机物A为烃类化合物,相对分子质量为70,其相关反应如下图所示,其中A、B、D、E的结构中均含有2个-CH3,它们的分子中均有4种不同环境的氢原子。
(1)Ⅱ的反应类型为_________ ;Ⅳ中①的反应类型为_________ ;
(2)写出反应I的化学方程式_____________________________;
(3)A的同类别的同分异构体有____ 种(不包括A)。
写出A形成高分子化合物的化学方程式______________________;
(4)E有多种同分异构体,其中能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为________________________。
正确答案
(1)取代反应;氧化反应
(2)
(3)4;
(4)
解析
解析已在路上飞奔,马上就到!
知识点
28.下图是一种药物分子合成的部分路线图(反应条件已经略去):
已知①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键,遇酸分解。
(1)写出一种满足下列条件的A的同分异构体的结构简式为____________________.
①属于芳香族化合物;
②能使FeCl3溶液显色;
③分子中有4种不同化学环境的氢原子。
(2)有机物E分子中含氧官能团名称为____________________。
(3)C用LiBH4还原可以得到D。C→D不直接用氢气(镍作催化剂)还原的原因是__________________________。
(4)检验D是否完全转化为E的实验方法是(用化学方程式表示)____________________.
(5)请写出B→C的合成路线图(CH3I和无机试剂任选)。合成路线流程图例如下:
正确答案
(1)
(2)羰基、醛基、碳碳双键(任意两个即可)
(3)避免碳碳双键被氢气加成或还原 、酯很难和氢气发生还原反应
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
29.锌是一种应用广泛的金属,火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100—1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.8、0.2)。主要反应为:
焙烧炉中:2ZnS(s)+3 O2
鼓风炉中:2C(s)+ O2 (g) 
鼓风炉中:ZnO(s)+CO(g) 
(1)ZnS质量分数为0.620的闪锌矿(杂质不含锌)中锌的质量分数为_______ (保留三位小数)。
(2)焙烧炉产生的炉气中SO2的体积分数不超过_______ (保留三位小数)。
(3)鼓风炉容积固定,炉内部分气态物质物质的量浓度(mol/L)变化如下:
则鼓风炉中CO的总转化率为___________;若生产中CO的总利用率为98%,则每生产1 mol Zn至少需补充焦炭_________g。
(4)若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2的混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余。则每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共为多少L(STP)?
正确答案
(1)0.415
(2)0.143
(3)90.9%;12.25g
(4)459.2L
解析
解析已在路上飞奔,马上就到!