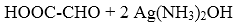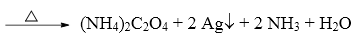- 真题试卷
- 模拟试卷
- 预测试卷
1.物质在下列应用中,利用了其还原性的是
正确答案
解析
A.纯碱水解碱性的应用;
B. 利用铝的金属活动性还原(冶炼)一些难熔金属,是铝的还原性应用的典型一例,故选B;
C. 硝酸制炸药如硝化纤维、三硝基基本等应用的是硝酸的酸性和氧化性;
D. 漂粉精漂白织物是利用的其水解产生的次氯酸的氧化性。
考查方向
解题思路
紧紧抓住物质的还原性。
易错点
B、C、D等选项中的主体物质颠倒。
知识点
2.有关化学用语的表述正确的是
正确答案
解析
A.轨道表示式表示N2中的共用电子对,其中另一N原子的2p上的三个成单电子自旋方向要相反;
B.C.均错在“只能”上,还有很多其它双原子分子也符合;
D.的甲烷比例模型正确,是为正确选项。
考查方向
解题思路
准确理解轨道表示式、比例模型、球棍模型,及“只能”。
易错点
审题时忽视关键词“只能”等而错选B等。
知识点
3.关于砹(85At)及其化合物的说法中正确的是
正确答案
解析
A.HX的稳定性是从F到I再到At,逐渐减弱,故HAt<HCl,A错;
B.卤素单质的氧化性从F2到I2再类推到At2,逐渐减弱,故At2< I2,B错误;
C.卤素单质均为双原子分子,属于分子晶体,故At2为分子晶体,C选项正确;
D.HX的水溶液的酸性从F到I再类推到At,逐渐增强,HAt属于强酸,则NaAt的水溶液呈中性,故D错误。
考查方向
解题思路
正确理顺卤素单质及其氢化物的性质。
易错点
HX的水溶液的酸性规律及强弱不清而错选D。
知识点
5. 仅用蒸馏水,不能鉴别的一组物质是
正确答案
解析
A.汽油、甘油和四氯化碳分别加水后,水在下层的是汽油,水在上层的是四氯化碳,与水混溶的是甘油,故A可以鉴别;B.葡萄糖、蔗糖和纯碱均溶于水且形成无色溶液,故仅用蒸馏水是不能鉴别的;C.溴蒸气在水中溶解度很小,其水溶液呈黄色或红棕色,二氧化氮与水反应生成硝酸和NO,溶液无色,故C可以鉴别;D.碘和高锰酸钾溶于水,分别呈现的颜色是黄色(或棕黄色、褐色)和紫红色,故D可以鉴别。
考查方向
解题思路
了解物质在水中的溶解性、及密度相对大小、与水的反应、溶水后的颜色变化等。
易错点
因忽视物理性质,如溶解性、密度的相对大小不清而错选A。
知识点
6.下列反应的产物中,只存在+3价铁元素或氮元素的是
正确答案
解析
A.过量的铁丝在氯气燃烧,只能生成FeCl3,故选A;
B.过量的铁粉与溴水反应,生成的溴化铁最终被过量的铁还原为溴化亚铁;
C.2NO2+2NaOH=NaNO3+NaNO2+H2O;
D.2Cu(NO3)2 
考查方向
解题思路
熟悉相关物质的化学性质。
易错点
“过量的铁丝在氯气燃烧”与溶液中的过量铁的反应混淆而漏选A。
知识点
7.下列各组数据比较,前者比后者小的是
正确答案
解析
A.氯水中有Cl2、H2O、H+、Cl-、HClO、ClO-、OH-等7种微粒,氨水中有NH3、H2O、NH3·H2O、NH4+、OH-、H+等6种微粒,比氯水少;
B.乙烷中的碳碳单键比苯分子中特殊的碳碳键的键长长;
C.铯与钠同在IA族,且铯离子的半径比钠离子大,故氯化铯的熔点低于氯化钠的熔点,是符合题意的选项;
D.Al2O3是离子晶体,熔点远高于属于分子晶体的AlCl3。
考查方向
解题思路
氯气、氨气与水反应的性质、有机物分子中的碳碳键、物质的熔沸点规律。
易错点
氯水与氨水中微粒种类。
知识点
9.有机物M的结构如图所示。关
正确答案
解析
A.分
B.官能团有羧基能发生中和反应、取代反应、醇羟基能发生消去、氧化等反应、碳碳双键能发生加成反应等,故B正确;
C.1 molM与溴水发生加成反应的产物就可能有4种(1:1加成3种,1:2加成1种),故C错误;
D.1molM与足量氢氧化钠溶液反应,消耗3molNaOH(1个羧基消耗1个NaOH、1个碳酸氢酯水解后生成Na2CO3消耗2个NaOH),故D错误。
考查方向
解题思路
从官能团的决定性出发解题。
易错点
1 molM与溴水发生反应的产物可能有3种;1molM与足量氢氧化钠溶液反应,消耗4molNaOH。
知识点
4.化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H
正确答案
解析
N2H6SO4类比于(NH4)2SO4,可推知是由非金属元素构成的离子晶体,阳离子、阴离子之间是离子键,阳离子、阴离子内还有共价键,没有分子间作用力。故选C。
考查方向
解题思路
“晶体类型与硫酸铵相同”给出了与硫酸铵类比的思路。
易错点
忽视了共价键而错选B。
知识点
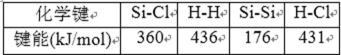
13.由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol
晶体硅的热效应是
正确答案
解析
在晶体硅中,每个硅原子与其它4个硅原子相连,且每个Si-Si键又是被2个硅原子共有,因此,平均每个硅原子占有的共价键数是4×1/2=2个。故反应热为:360×4+436×2-176×2-431×4=236,故吸收236 kJ的热,选A。
考查方向
解题思路
反应热为生成物的键能之和与反应物的键能之和的差值。
易错点
1mol晶体硅中Si-Si键的确定。
知识点
17.某溶液中含有下列离子中的五种:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3–、CO32–、Cl–、NO3–、SO42–,浓度均为0.1mol/L。向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化。以下分析错误的是
正确答案
解析
从阳离子看,不可能共存的离子首先可以否定掉CO32–。若有HCO3–,则阳离子中能共存的只有Ba2+、Mg2+——此时阴离子只能是HCO3–、Cl–、NO3–,电荷不守恒,若阳离子只有Mg2+——此时阴离子只能是HCO3–、Cl–、NO3–、SO42–,仍是电荷不守恒,则HCO3–也不存在,故A.正确。D. 若原溶液中有三种阳离子,最小的电荷组合是3×2×0.1 mol/L,而两种阴离子的最大电荷组合是0.1mol/L+2×0.1mol/L,电荷不守恒,故D.错误。
考查方向
解题思路
从离子共存性质判断入手,辅之电荷守恒。
易错点
“向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化”信息判断失误,而不能确定是增加氯离子、还是原来就有氯离子。
知识点
11.向0.1 mol / L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起
正确答案
解析
CH3COOH电离平衡中,加CH3COONa晶体,会抑制醋酸的电离(故B错误),c(H+)减小,c(OH-)增大(故D.错误)pH增大;且CH3COONa是强电解质,溶液中自由离子的浓度增大,导电能力增强(故C.错误);或加水稀释,促进醋酸的电离,但是溶液中c(H+)减小,则c(OH-)增大,pH增大,故A.正确。
考查方向
解题思路
CH3COOH电离平衡的移动原理。
易错点
B.CH3COOH的电离程度增大。
知识点

下列说法错误的是
正确答案
解析
①Cl2+2Br–→Br2+2Cl– ;②使溴挥发富集;③吸收与富集:SO2+Br2+2H2O→2HBr+H2SO4,故B.错误;④Cl2+2Br–→Br2+2Cl–。
考查方向
解题思路
氯气置换溴,SO2还原单质溴。
易错点
C.步骤②③的目的是富集溴元素。
知识点
15.有某温度下KCl饱和溶液m1 g,溶质质量分数为ω1%。对其蒸发结晶或降温结晶,若析出KCl的质量、所得母液质量及溶质质量分数用m g、m2 g和ω2%表示,分析正确的是
正确答案
解析
A.原条件下KCl的溶解度较大,大于ω1 g ,故A错误;
B. 依据溶质的量守恒,前后溶液中溶质的差值即为 m1∙ω1% - m2∙ω2%= m,故B正确;
C.只有降温结晶时ω1大于ω2 ,故C.错误;
D.因蒸发结晶有溶剂损失,则 m1 - m2 ≥m,故D.错误。
考查方向
解题思路
蒸发结晶,析出晶体,还要损失溶剂;而降温结晶则只析出晶体。但是溶质的量守恒。
易错点
前后溶液的质量差D. m1 - m2 ≤ m。
知识点
16.80C,0.1 mol/L NaHB溶液中c(H+)>c(OH–),可能正确的关系是
正确答案
解析
A.为电荷守恒,但等式右边漏掉了 c(OH–),故A.错误;
B.当0.1 mol/L NaHB完全电离时,溶液的pH=1,因此可能正确的关系是选项B;
C.c(H+)∙c(OH–)= 10–14 是在常温下的水的离子积,故C.错误;
D.为物料守恒,但是等式右边缺少 c(B2–),故D.错误。
考查方向
解题思路
从信息c(H+)>c(OH–)推知NaHB溶液中电离程度大于水解程度。
易错点
忽视温度标准而错选C.c(H+)∙c(OH–)= 10–14。
知识点
21.自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4。在该反应中
正确答案
解析
依据S的守恒,产物5FeSO4+12H2SO4中的12+5=17个硫酸根,减去反应物14CuSO4,得出有3 SO42-是源于FeS2中的硫部分氧化。因此得出5FeS2中共10个-1价的S,3S共失去3×7=21 e-生成硫酸根离子,另7个-1价的S得到7×e-生成7Cu2S,还有14CuSO4中的铜离子得到14×e-生成7Cu2S,得失电子守恒。FeS2中的S相当于发生了歧化反应,故选项A正确。
考查方向
解题思路
依据S的守恒,判断FeS2中的硫一部分被氧化、一部分被还原。
易错点
电子转移数的计算。
知识点
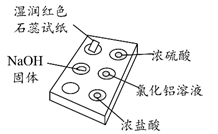
8.右图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。
正确答案
D
解析
A. NH3极易溶于水且与水反应显碱性才使红色石蕊试纸变蓝,故A错误;
B. 浓硫酸附近无白烟是因为浓硫酸的难挥发性,浓硫酸能与氨气反应生成铵盐,故B错误;
C.离子方程式中NH3·H2O 是弱电解质,不能拆,故C错误;.正确。
考查方向
解题思路
氨气的物理性质与化学性质。
易错点
忽视浓硫酸的酸性而错选B。
知识点
23.H、C、N、O、Al、S是常见的六种元素。完成下列填空:
(1)碳元素有12C、13C和14C等同位素。在14C原子中,核外存在 对自旋相反的电子。
(2)碳在形成化合物时,其所成化学键以共价键为主,原因是 。
任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式
上述元素可组成盐NH4Al(SO4)2。向10 mL 1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下。
①NH4Al(SO4)2溶液中所有离子的浓度由大到
小的顺序是( ) ,请解释阳
离子浓度差异的原因 ( )
②写出N点反应的离子方程式 ( )
③若向10 mL1mol/L NH4Al(SO4)2溶液中加入20 mL
1.2 mol/LBa(OH)2溶液,充分反应后,产生沉淀 ( )mol。
正确答案
2
解析
碳原子的基态原子电子排布式
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
正确答案
碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构。
解析
碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+ 、Al3+的水解能力差异、及NH4+ 、Al3+与OH–反应的先后顺序。
正确答案
H:O:O:H或H:C︙︙ C:H
解析
四原子的共价化合物且含非极性键:如H2O2、C2H2等。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+ 、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
正确答案
①c(SO42-)> c(NH4+)> c(Al3+)> c(H+)> c(OH–),由于碱性:氨水>Al(OH)3,故Al3+的水解程度大于NH4+的水解程度,c(NH4+) > c(Al3+) ;溶液显酸性,是由于NH4+和Al3+水解造成的,因水解程度较小,所以c(NH4+) 、c(Al3+)远大于c(H+) 浓度。
②NH4+ +OH–→NH3∙H2O。
③0.022。
解析
①从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+可知,碱性强弱是:氨水>Al(OH)3,故Al3+的水解程度大于NH4+的水解程度,c(NH4+) > c(Al3+) ;溶液显酸性,是由于NH4+和Al3+水解造成的,因水解程度较小,所以c(NH4+) 、c(Al3+)远大于c(H+)浓度。
②N点时,不论是从图像还是NH4+ 、Al3+与OH–反应的先后顺序得到:NH4+ +OH–→NH3∙H2O。
③依据: NH4Al(SO4)2 + 2Ba(OH)2 → Al(OH)3↓+ NH3∙H2O + 2BaSO4↓
10×10-3L×1mol/L 2×10×10-3L×1mol/L 0.01mol 0.02 mol
又因:Ba(OH)2过量20×10-3×1.2 mol/L-2×10×10-3L×1mol/L=0.004 mol,
即过量n(OH-)=0.008mol.
依据Al(OH)3 + OH- = AlO2-+ 2H2O
0.008 mol 0.008 mol
最终剩余Al(OH)3的物质的量为0.01mol - 0.008 mol = 0.002 mol,
故最后所得沉淀总量是:0.02 mol+0.002 mol= 0.022 mol。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+ 、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
24.氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2+4HCl
完成下列填空:
该反应化学平衡常数K的表达式为 ( );实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是( )反应(填“吸热”或者“放热”)。
上述实验中若压缩体积使压强由P0增大至P1,
在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: ( ) 。
该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)=( )mol。
对该反应达到平衡后,以下分析正确的是 ( )(选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
氯元素能形成多种离子。在水溶液中1molCl–、1molClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示)( ) ;若有1.5molB发生反应,转移电子( ) mol。
正确答案
K=[Cl2]2 [H2O]2/([O2][HCl]4) 放热
解析
直接由反应方程式书写化学平衡常数K的表达式为K=[Cl2]2 [H2O]2/([O2][HCl]4;
再由HCl平衡转化率α(HCl)随温度T的变化曲线,得出:温度升高,转化率α(HCl)降低,说明升高温度,平衡逆移,则正反应是放热反应。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
无
正确答案
增大压强,平衡右移,温度相同情况下,转化率增大
解析
若压缩体积使压强由P0增大至P1,即增大压强,平衡正移(正反应是体积减少的反应),则α(HCl)增大。
考查方向
化学平衡及其计算、化学反应热。
解题思路
增大压强,平衡右移,温度相同情况下,转化率增大
易错点
作图
正确答案
解析
该反应在P0、320°C条件下进行,达平衡状态A时,
依据: O2 + 4HCl
始量/mol a 0
变量/mol 4x 2x
A平量/mol a-4x 2x
测得容器内n(Cl2)=7.2×10–3mol,即2x=7.2×10–3mol,4x=14.4×10–3mol,
又知:平衡状态A时,α(HCl)=0.85=14.4×10–3/a,a≈16.94×10–3mol,
则此时容器中的n(HCl)= a-4x =16.94×10–3mol-14.4×10–3mol=2.54×10–3mol。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
无
正确答案
a,d
解析
a.增加n(HCl)的瞬间,正反应速率瞬间增大,故a正确;
b.体积不变加入稀有气体,平衡混合物中各成分的浓度不变,反应速率没影响,且平衡不移动,故b错误;
c.压强不变加入稀有气体,反应体系的体积会增大,相当于减小压强,平衡会向着体积增大的逆反应方向移动,但逆反应速率减小的少于正反应速率,故c错误。
d.该反应正反应放热,如果平衡常数K值增大,则是平衡正向移动,且K只与温度有关,故应该是降温,逆反应吸热,故降温对逆反应的速率的减小更大,d正确。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
平衡状态分析。
正确答案
3ClO–(aq)→2Cl–(aq)+ClO3–(aq)+117 kJ 2
解析
从图示看到B→A+C反应中价态变化关系是:B(+1,60)→A(-1,0)+C(+5,63),得出:3ClO–(aq)→2Cl–(aq)+ClO3–(aq)+117 kJ。若有1.5molB发生反应,转移电子2 mol。
考查方向
化学平衡及其计算、化学反应热。
解题思路
把握好化学反应速率与化学平衡的规律、勒夏特列原理、计算公式。
易错点
无
25.实验小组为探究SO2的漂白性和还原性,设计了以下实验。
完成下列填空:
实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用 (选填编号),其理由是( )
a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
33.用如图所示装置(气密性良好)进行实
验,观察到如下现象:ⅰ中红色褪去、ⅱ中无变化。
①足量碱石灰的作用是 ( )
②从实验中可知使品红的水溶液褪色的
微粒可能是 ( )
实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3–或SO32–。你认为这一结论是否正确 ( ) ,理由是 ( ) 。
将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是(),如何检验该反应所得含氧酸根离子() 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32–。则②中红棕色变为浅绿色的原因是 ( ) 。
正确答案
b
解析
实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,选用的是70%硫酸,其理由是98%浓硫酸中c(H+)小不易反应,10%硫酸溶液水含量高不易使SO2放出。
考查方向
探究实验、实验设计、二氧化硫性质。
解题思路
了解基本的实验室制法与实验原理,及紧紧围绕二氧化硫的漂白性与还原性去解题。
易错点
无
正确答案
①防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染
②H2SO3、HSO3–、SO32–
解析
①足量碱石灰的作用是既防止空气中的水蒸气进入ⅱ中干扰实验,又吸收二氧化硫防污染。
②从实验中可知使品红的水溶液褪色而醇溶液不褪色,显然与SO2+H2O=H2SO3,及亚硫酸电离有关,但与水的电离微粒无关,故微粒可能是H2SO3、HSO3–、SO32–。
考查方向
探究实验、实验设计、二氧化硫性质。
解题思路
了解基本的实验室制法与实验原理,及紧紧围绕二氧化硫的漂白性与还原性去解题。
易错点
②从实验中可知使品红的水溶液褪色的微粒;
正确答案
不正确 因为SO32–离子和HSO3–离子都会水解生成H2SO3
解析
该结论不正确,因为SO32–离子和HSO3–离子都会水解生成H2SO3。
考查方向
探究实验、实验设计、二氧化硫性质。
解题思路
了解基本的实验室制法与实验原理,及紧紧围绕二氧化硫的漂白性与还原性去解题。
易错点
无
正确答案
①2Fe3++SO2 + 2H2O→2Fe2+ + SO42–+ 4H+(1分)取少量反应混合液,加入盐酸酸化后加氯化钡,产生白色沉淀,混合液中即含有SO42-
②混合液中存在平衡FeSO3(s)
解析
①SO2与FeCl3反应的离子方程式是2Fe3++ SO2 + 2H2O→2Fe2+ + SO42–+ 4H+;检验SO42–的方法是取少量反应混合液,加入盐酸酸化后加氯化钡,若产生白色沉淀,则混合液中含有SO42-。
②实验中观察到溶液由黄色(是Fe3+)变为红棕色,静置一段时间,变为浅绿色(是Fe2+)。红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;且Fe3+可氧化SO32–。
则②中红棕色变为浅绿色的原因是:混合液中存在平衡FeSO3
考查方向
探究实验、实验设计、二氧化硫性质。
解题思路
了解基本的实验室制法与实验原理,及紧紧围绕二氧化硫的漂白性与还原性去解题。
易错点
②中红棕色变为浅绿色的原因。
27.
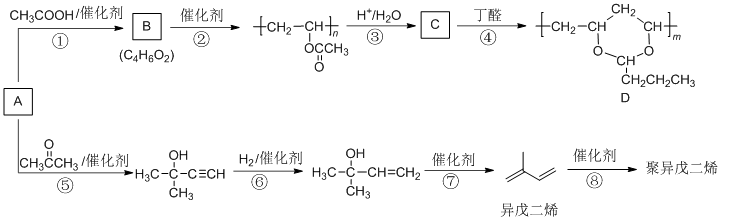
由基本有机化工原料A(C2H2)制备有机物D和聚异戊二烯的合成路线如下图所示:
完成下列填空:
上述转化步骤中与反应①的反应类型相同的是 ( )(填编号)
m与n的关系为( )
异戊二烯分子中最多有( ) 个原子共平面。
在异戊二烯的同分异构体中,与A具有相同官能团且分子中有支链的有机物的名称
是( )
参照流程图中异戊二烯的合成路线,若把步骤⑤中的反应物丙酮改为乙醛,则经过
反应⑤、⑥、⑦后得到的有机物是( )
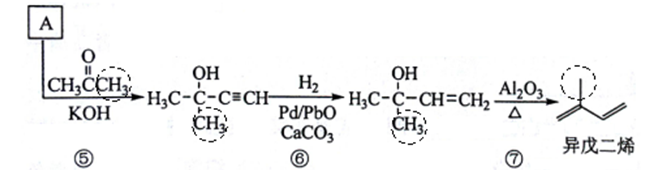
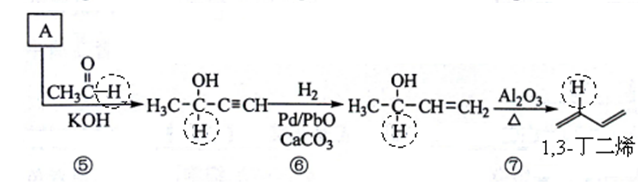
正确答案
⑤⑥
解析
上述转化步骤中与反应①的反应类型是加成反应,故还有⑤⑥。
考查方向
有机物的性质与合成。
解题思路
围绕官能团羰基加成、碳碳三键加成、醇羟基消去、酯基的水解、共轭二烯烃的加成聚合等展开答题。
易错点
m与n的关系、及异戊二烯分子中最多共平面原子。
正确答案
n = 2m
解析
D中的每个链节碳数4是前一个高聚物链节碳数2的2倍,故有n = 2m。
考查方向
有机物的性质与合成。
解题思路
围绕官能团羰基加成、碳碳三键加成、醇羟基消去、酯基的水解、共轭二烯烃的加成聚合等展开答题。
易错点
m与n的关系、及异戊二烯分子中最多共平面原子。
正确答案
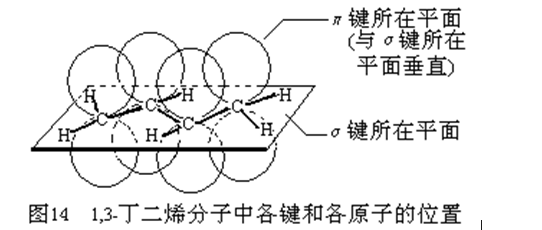
11;45.
解析
异戊二烯分子中的碳碳双键为共轭键,即4个碳原子间的两个碳碳双键,其实是除σ键之外的,另一个大π键(4中心4电子)(如下图示),碳碳之间因共轭π键而不能旋转,一个1,3-丁二烯分子最少有10个原子共平面,则一个异戊二烯分子中最多有11个原子共平面.这是因为甲基还可以通过单键旋转而使一个甲基H共面。
考查方向
11;45.
解题思路
围绕官能团羰基加成、碳碳三键加成、醇羟基消去、酯基的水解、共轭二烯烃的加成聚合等展开答题。
易错点
m与n的关系、及异戊二烯分子中最多共平面原子。
正确答案
3-甲基-1-丁炔
解析
在异戊二烯的同分异构体中,与A具有相同官能团——即两个双键异构为一个三键,且分子中有支链的有机物为: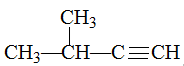
考查方向
有机物的性质与合成。
解题思路
围绕官能团羰基加成、碳碳三键加成、醇羟基消去、酯基的水解、共轭二烯烃的加成聚合等展开答题。
易错点
m与n的关系、及异戊二烯分子中最多共平面原子。
正确答案
1,3-丁二烯。
解析
参照流程图中异戊二烯的合成路线,若把步骤⑤中的反应物丙酮改为乙醛,则经过
反应⑤、⑥、⑦后得到的有机物是1,3-丁二烯。
考查方向
有机物的性质与合成。
解题思路
围绕官能团羰基加成、碳碳三键加成、醇羟基消去、酯基的水解、共轭二烯烃的加成聚合等展开答题。
易错点
m与n的关系、及异戊二烯分子中最多共平面原子。
氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业。
工业上氯化亚铜可由下列反应制备:
2CuSO4+ Na2SO3 + 2NaCl+ Na2CO3 ® 2CuCl ↓+ 3Na2SO4+ CO2↑。制备过程中需要20% 的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾 ( )g,需要水 ( )g。
实验室可用如下方法制备少量CuCl:取10 mL 0.2 mol/L CuCl2溶液,加入0.128 g铜屑和36.5%的浓盐酸(密度为1.2 g/mL)3 mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀。
已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036 mol、n(Cl–)=0.032 mol。请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量。
由CO2、O2、CO、N2组成的混合气体1.008 L,测得其密度为1.429 g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO) (假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定)。
①该混合气体的摩尔质量是 g/mol;混合气体中n(CO2): n(CO和N2) = 。
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?
正确答案
31.25 g;68.75 g
解析
由20%可知,100 g溶液中m(CuSO4)=20 g,相当于m(CuSO4·5H2O)=31.25g,则还需加水m(H2O)=100 g-31.25 g=68.75 g。
考查方向
溶液的配制与计算。
解题思路
胆矾是CuSO4·5H2O。溶质是CuSO4,溶液为CuSO4·5H2O与加水量的和。
易错点
胆矾是含有结晶水的CuSO4,即CuSO4·5H2O。计算用水量时未减去结晶水部分而错。
正确答案
①[CuCl2]–或[Cu2Cl4]2–;4×10–3 mol或2×10–3 mol
解析
①0.002 molCu2+与0.002 molCu恰好归中为0.004 molCu+,形成络合阴离子的n(Cl–)=0.004 mol+(1.2×3×36.5%/36.5 mol)-0.032 mol=0.008mol。
②由电荷守恒得:另一阴离子的量为0.004 mol,即得配离子为0.004 mol [CuCl2]–或0.002mol [Cu2Cl4]2–。
考查方向
配位化合物与计算。
解题思路
从题给信息——溶液A中只含氢离子和两种阴离子(不考虑水的电离),推知没有Cu2+或Cu+;且又有“A全部倾入水中,可得到白色的氯化亚铜沉淀”、及“n(H+)=0.036 mol、n(Cl–)=0.032 mol”之间的差值可知,Cu+结合了Cl–络合为配阴离子0.004 mol。
易错点
配离子的推断。
正确答案
①32 g/mol 1:3 ②0.28 g ③448 mL
解析
①该混合气体的摩尔质量M=ρVm=22.4 L·mol-1×1.429 g/L≈32 g·mol-1。
又有:Σm=ρV=1.008 L×1.429 g/L≈1.44 g,
由质量守恒定律得:m(N2)=Σm - m(CO2)- m(O2+CO)=1.44g-0.44 g-0.44 g=0.56 g,
再得:n(N2)=m(N2) / M(N2)=0.56 g/28 g·mol-1=0.02 mol。
还知:n(CO2)=0.44 g/44 g·mol-1=0.01mol。
依据:M=Σm/Σn=1.44 g/[n(N2)+ n(CO2)+ n(O2+CO)]=32 g·mol-1,可求得:n(O2+CO)=0.015 mol。
②O2和CO的混合气体中:32 g·mol-1·n(O2)+28 g·mol-1·n(CO)=0.44 g
n(O2)+n(CO)= 0.015 mol
联立解方程组得:n(O2)= 0.005 mol;n(CO)= 0.01 mol。
即n(CO2): n(CO和N2)=0.01 mol: (0.01mol+0.02 mol)=1:3。
混合气体中CO的质量:m(CO) = n(CO)·M(CO)=0.01 mol×28 g·mol-1=0.28 g。
③最后剩余气体的体积是:V(N2)= n(N2)·Vm=0.02 mol×22.4 L·mol-1=0.448 L。
考查方向
多组分混合物的计算。
解题思路
运用好计量公式如:M=ρVm、ρ=m/V、M=m/n、M=Σm/Σn。并注意数值的取舍。
易错点
计算的准确性,及n(CO和N2) 或混合气体中n(CO2): n(CO和N2)。
26.
X物质是 ( );Y物质是( ) 。
Z物质最适宜选择( )(选填编号)。
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
浓硫酸的作用是 ( 其优点是用量少,可能的进行,如图,产品T是(),
请说明理由 ( ) 。
废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,
再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶。
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀。加入少许淀粉溶液。
③用0.0250 mol/LNa2S2O3标准溶液滴定至终点。用去Na2S2O3溶液22.48mL。
已知:BrO3–+5Br–+6H+→3Br2 +3H2O ;写出苯酚与浓溴水反应的化学方程式 ( );第①步加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是( )。
已知:I2 +2Na2S2O3→2NaI + Na2S4O6;滴定终点的现象是( );该废水中苯酚的浓度是 ( ) mol/L(保留4位小数)。
正确答案
氧气(或空气);异丙苯
解析
.由信息方程式得:X应该是氧气(要氧化异丙苯);Y是再“回炉氧化”的物质,故为异丙苯。
考查方向
有机合成与实验、有机物的性质
解题思路
信息优先,信息与已有知识点的整合迁移。
易错点
Z物质最适宜选择、及废水中苯酚的浓度的计算。
正确答案
c
解析
Z物质最适宜选择是NaHCO3,因其不与苯酚反应。
考查方向
有机合成与实验、有机物的性质。
解题思路
信息优先,信息与已有知识点的整合迁移。
易错点
Z物质最适宜选择、及废水中苯酚的浓度的计算。
正确答案
催化剂,浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)
解析
浓硫酸的作用是催化剂。其优点是用量少,可能的缺点是浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)
考查方向
有机合成与实验、有机物的性质。
解题思路
信息优先,信息与已有知识点的整合迁移。
易错点
Z物质最适宜选择、及废水中苯酚的浓度的计算。
正确答案
苯酚与溴水的反应方程式(略),防止溴挥发
解析
苯酚与浓溴水反应的化学方程式
要迅速盖好盖子的原因是因为溴易挥发,故盖好盖子防止溴挥发。
考查方向
有机合成与实验、有机物的性质。
解题思路
信息优先,信息与已有知识点的整合迁移。
易错点
Z物质最适宜选择、及废水中苯酚的浓度的计算。
正确答案
由蓝色变为无色(或白色浑浊)且半分钟内不变色;0.0053
解析
①依据KBrO3+5KBr+6HCl→3H2O+ 3Br2+6KCl
KBr过量,由KBrO3计算溶液中产生溴的总量:
n(Br2)=3 n(KBrO3)=3×0.0100mol·L-1×20×10-3L=0.6×10-3mol。
②依据I2 + 2Na2S2O3→2NaI + Na2S4O6
Br2+2I-(过量)→I2+2Br-
得关系式:Br2~I2~2Na2S2O3,
此时消耗n(Br2)= n(Na2S2O3)/2=22.48×10-3L×0.0250 mol/L÷2=0.281×10-3mol。
③与废水中苯酚反应的溴为:n(Br2)= 0.6×10-3 mol-0.281×10-3mol=0.319×10-3 mol,
则n(C6H5OH)= n(Br2)/3,故该废水中苯酚的浓度是:
c(C6H5OH)= n(Br2)/3÷V(废水)= 0.319×10-3mol÷3÷20×10-3L≈0.0053 mol/L(保留4位小数)。
考查方向
有机合成与实验、有机物的性质。
解题思路
信息优先,信息与已有知识点的整合迁移。
易错点
Z物质最适宜选择、及废水中苯酚的浓度的计算。
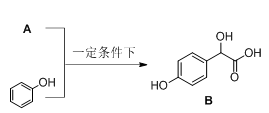
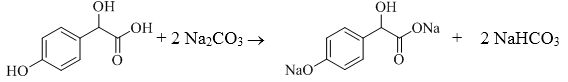
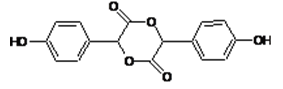
以有机物A和苯酚为原料合成一种医药中间体E的路线如下:
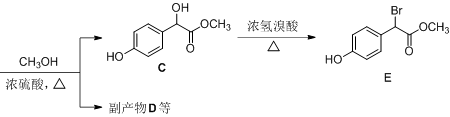
已知A的分子式为C2H2O3,可发生银镜反应,且具有酸性。写出A发生银镜反应的化学方程式( )
有机物B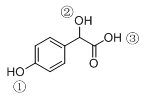
写出B与过量Na2CO3溶液反应的化学方程式( ) 。
副产物D是由2分子B生成的含有3个六元环的化合物,D的结构简式是()
已知苯酚钠和苯酚相比,不易被氧化。现由有机物B制备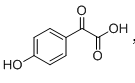
写出符合下列条件的E的所有同分异构体的结构简式 ( )(不考虑立体异构)。
①苯环上只有2个位置未被取代,且这两个位置上的氢原子化学环境相同;
②与FeCl3溶液不发生显色反应;
③能发生银镜反应。
正确答案
解析
已知A的分子式为C2H2O3,可发生银镜反应,且具有酸性。且有
考查方向
有机物性质与合成路线流程、同分异构。
解题思路
严格遵循官能团决定性质、性质反映官能团去追寻物质的结构特点。
易错点
B与过量Na2CO3溶液反应的化学方程式、D的结构简式、同分异构体。
正确答案
③>①>②
解析
有机物B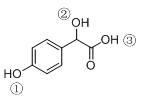
考查方向
有机物性质与合成路线流程、同分异构。
解题思路
严格遵循官能团决定性质、性质反映官能团去追寻物质的结构特点。
易错点
B与过量Na2CO3溶液反应的化学方程式、D的结构简式、同分异构体。
正确答案
解析
联想乳酸的双分子酯化为六元环,B中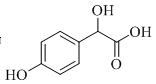
。
考查方向
有机物性质与合成路线流程、同分异构。
解题思路
严格遵循官能团决定性质、性质反映官能团去追寻物质的结构特点。
易错点
B与过量Na2CO3溶液反应的化学方程式、D的结构简式、同分异构体。
正确答案
NaOH溶液; Cu、O2、加热(合理即得分); 盐酸溶液
解析
利用信息:苯酚钠和苯酚相比,不易被氧化。推知:氧化醇羟基为羰基之前,先要让酚羟基生成酚钠而保护起来,氧化醇羟基完成后,酸化还原。故由有机物B制备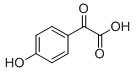
考查方向
有机物性质与合成路线流程、同分异构。
解题思路
严格遵循官能团决定性质、性质反映官能团去追寻物质的结构特点。
易错点
B与过量Na2CO3溶液反应的化学方程式、D的结构简式、同分异构体。
正确答案
解析
①苯环上只有2个位置未被取代,且这两个位置上的氢原子化学环境相同——即对称H;
②与FeCl3溶液不发生显色反应——苯环上不能有羟基;
③能发生银镜反应——有醛基。
④E有不饱和度5,苯环占有4,另一个不饱和度为醛基,且—Br也一定,基于对称考虑,官能团—CHO与—Br在苯环上只能且唯一的站在对位——即
考查方向
有机物性质与合成路线流程、同分异构。
解题思路
严格遵循官能团决定性质、性质反映官能团去追寻物质的结构特点。
易错点
B与过量Na2CO3溶液反应的化学方程式、D的结构简式、同分异构体。

正确答案
D
解析
K1 与 K2连接是原电池,A.中铁是负极,石墨是正极,电解质溶液是中性的食盐水,故为铁的吸氧腐蚀,A.正确;
B.中较活泼的锌为负极,铁为正极,相当于钢铁防护中牺牲阳极的阴极保护法,B.正确;
K1 与K3连接是电解池,C.中石墨与电源的正极相连是阳极,食盐水中的氯离子在阳极放电生成氯气,铁与电源负极相连是阴极,溶液中氢离子放电生成氢气,为电解饱和食盐水,故C正确;
D.中铁连接电源的正极,是阳极,铁放电被氧化,没有被保护,故与“钢铁防护中外加电流的阴极保护法”不符,D选项错误。
考查方向
解题思路
K1 与 K2连接是原电池、 K1 与K3连接是电解池。
易错点
K1 与 K2连接、 K1 与K3连接所形成的原电池与电解池原理。
知识点
14.利用右图所示装置进行下列实验,能得出相应实验结论的是
正确答案
C
解析
A. SO2使KMnO4溶液褪色是其还原性而不是漂白性,故A.错误;
B.通氯气到FeBr2溶液中,优先被氧化的是亚铁离子,生成的铁离子溶液呈黄色,后被氧化的才是溴离子,生成的溴单质(低浓度时)也是黄色,因此无法确定是否置换出溴,也就不能得出氧化性:Cl2 > Br2,故B.错误;C.正确;
D.浓硫酸与蔗糖所产生的气体使溴水褪色,是浓硫酸的强氧化性(被还原为SO2)的体现,还有脱水性,这里没有吸水性,故D.错误。
考查方向
解题思路
依据物质性质去判断实验现象。
易错点
FeBr2溶液变为黄色。
知识点
18.向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是
正确答案
解析
向饱和食盐水中滴加一定浓度的盐酸,若盐酸浓度较高,则会使食盐的溶解平衡向着结晶的方向移动,故A.可能;若盐酸浓度较低,反而是稀释饱和食盐水,则C.可能。
考查方向
解题思路
一定浓度的盐酸的加入,可能破坏饱和食盐水中的溶解平衡。
易错点
预测可能的现象,易漏选。
知识点
20.对有关NaClO和NaCl混合溶液的叙述正确的是
正确答案
解析
A.该溶液中,H++ClO–=HClO,不可以大量共存,A.错误;
B. S2–易被ClO–氧化而不能大量共存,故B正确;
C.滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO–+H2O+4OH-→Cl–+2Fe(OH)3↓,故C.错误;
D.向该溶液中加入浓盐酸,发生ClO–与Cl–归中反应产生Cl2,有每产生1molCl2,转移电子约为6.02×1023个,是正确选项。
考查方向
解题思路
离子反应的条件及氧化还原反应。
易错点
忽视弱电解质HClO而错选A。
知识点
19.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W 处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外)。Z与W、W与Q的原子
正确答案
解析
“题眼”——Z元素原子半径在短周期中最大,可推知在短周期中、且“只有一种金属元素”得到Z就是Na,依“Z与W、W与Q的原子
考查方向
解题思路
从“题眼”——Z元素原子半径在短周期中最大(稀有气体除外),即可依次推理。
易错点
找不到“题眼”——Z元素原子半径在短周期中最大(稀有气体除外)。
知识点
22.有两份组成及质量都相等的Na2O2和Na2CO3的混合物,向第一份中加入足量的稀硫酸,放出的气体共4.48 L。将此气体通入第二份混合物,充分反应后,气体体积变为4.032 L(均为标准状况下体积)。则原混合物中Na2O2和Na2CO3的物质的量之比为
正确答案
解析
依据“共4.48 L。将此气体通入第二份混合物,充分反应后,气体体积变为4.032 L(均为标准状况下体积)”可知: 2Na2O2+2CO2=2 Na2CO3+O2 △V 2 mol 2 mol 1 mol 22.4 L①Na2O2过量时: 0.04 mol 4.48 L-4.032 L=0.448 L 选D.②Na2O2不足时: 0.04 mol 4.48 L-4.032 L=0.448 L 选A.
考查方向
解题思路
依据方程式2Na2O2+2H2O=4NaOH+O2↑、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O、
2Na2O2+2CO2=2 Na2CO3+O2。
易错点
忽视Na2O2的过量与不足而漏选。