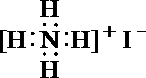- 真题试卷
- 模拟试卷
- 预测试卷
2.化学学
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.下列关于化石燃料的说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.捕碳技术是指从空气中捕获CO2的技术。目前NH3已经被用作工业捕碳剂。下列物质中不能作为捕碳剂的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列有关钠的叙述中,错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.依据原电池原理,设计番茄电池并检测电流的产生,其中合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下列离子方程式中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.氮化钠(Na3N)晶体熔融时能导电。下列描述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.描述硅原子核外电子运动说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.工业上制备下列金属,采用的化学反应原理正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂。下列关于物质X的说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.交警对驾驶员是否饮酒进行检测用酒精分析器,其原理是酒精与CrO3反应生成蓝绿色的Cr3+。根据颜色变化能判断是否饮过酒及饮酒量的多少。下列对乙醇性质的描述与此测定原理无关的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3+ 7O2
(2)2Na2CrO4+ H2SO4→Na2SO4 + Na2Cr2O7+ H2O
下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.下列实验现象描述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.化学与社会、生产、生活密切相关。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5. 化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若1.12LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③加入数滴氯水时,溶液无色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
21.将0.5 mol·L-1的Na2CO3溶液与amol·L-1的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1~2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.常温下向盛水烧杯中加2g生石灰(如下图)。搅拌后再恢复到原温,在此过程中,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
22.下列各项表述与示意图一致的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.肼(N2H4)又称联氨,其液体可燃,燃烧热较大且燃烧产物对环境无污染,可以用作火箭燃料。肼溶于水是一种二元碱。
完成下列填空:
(1)写出肼的电子式____________。 肼的晶体类型___________ 。
(2)工业上可用次氯酸钠和氨反应制肼,若只有一种氧化产物。写出该方法制备肼的化学方程式。________________________________________。
(3)0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。写出该反应的热化学方程式________________________________________。
(4)室温下,N2H5Cl的水溶液显______________(填酸、碱、中)性。
其原因是_________________________________________。
已知:H2O 
N2H4 + H2O 
[N2H5]+ + H2O 
(5)肼可以和氧气反应N2H4+O2→N2+2H2O。为除去高压锅炉用水中溶解的O2,常用N2H4或Na2SO3。除去等物质的量的O2,所消耗的N2H4和Na2SO3的质量之比为_______________。与N2H4相比较,使用Na2SO3会对锅炉造成不良的影响,其原因是_______________________。
正确答案
(1)
(2)NaClO + 2NH3 → N2H4 + NaCl + H2O
(3)N2H4(l)+2H2O2(l) → N2(g)+4H2O(g)+641.5kJ
(4)酸 ; [N2H5]+结合水解电离出OH- (K2 = 8.4×10-15)程度小于[N2H5]+ 结合水解电离出H+程度(K =Kw/K1 = 1.2×10-8)
(5)8︰63 ; N2H4的氧化产物为N2,而亚硫酸钠的氧化产物是硫酸钠是电解质,易在锅炉中形成电化腐蚀。
解析
解析已在路上飞奔,马上就到!
知识点
24.烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点。可以通过氧化还原反应或酸碱反应进行脱硫和脱硝。
完成下列填空:
(1)烟气中含有一定量的氮氧化物(NOx),可以利用甲烷与NOx一定条件下反应,产物为空气中含有的无害成分,从而消除污染。
写出CH4与NOx反应的化学方程式。________________________________________。
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO(g)
前1S内平均反应速率v(N2)。__________________________________.
第2S时的X值范围。_______________________________.
(3)为了除去烟气有害气体SO2并变废为宝,常用熟石灰的悬浊液洗涤废气,反应最终产物为石膏。而不采用澄清石灰水或熟石灰固体替代熟石灰悬浊液来吸收废气。
说明理由:____________________________________。
(4)用标准浓度的酸性KMnO4溶液可以测定空气中SO2含量。写出此测定方法的离子方程式。
(5)双碱法是一种低成本高效率的脱硫方法。先用第一碱作为吸收剂,与含SO2的烟气在吸收塔中接触发生反应,烟气中的SO2被吸收掉,然后脱硫废液在另一反应器中再与第二碱反应,使溶液得到再生,再生后的吸收液循环利用。
可用作第一碱______________。可用作第二碱 ______________。(选填编号)
a.NaOH b.Mg(OH)2
c.石灰石 d.石灰
正确答案
(1)4NOx+xCH4→2N2+xCO2+2xH2O
(2)2.7×10-4mol/(L·s);26<X<30.6
(3)熟石灰悬浊液吸收SO2速度快且脱硫率高。澄清石灰水中Ca(OH)2浓度较小,吸收SO2的量少。熟石灰固体与气体接触面小吸收速度慢且脱硫率低。
(4)5SO2+2MnO4-+2H2O→5SO42-+2Mn2++4H+
(5)a ; c d
解析
解析已在路上飞奔,马上就到!
知识点
25.工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质。为测定碱中各成分的百分含量可采用滴定法、气体法等。
完成下列填空:
(1)滴定法测定工业烧碱样品:配制250mL待测液,所用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒、_____________。
(2)测定工业烧碱的总碱量n Na2O(或总耗酸量):进行滴定时,先向盛待测液的锥形瓶中加______________作为指示剂。
判断滴定终点的现象是___________________________。
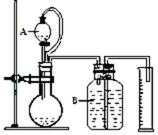
(3)气体法测定工业烧碱的Na2CO3含量(如图):
装置中B部分盛放的试液_______________。
装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是__________________________。
(4)用中和滴定的氯化钡法测定工业烧碱中NaOH的含量时,可先在混合液中滴加过量的BaCl2溶液,再以酚酞作指示剂,然后用标准盐酸滴定。
滴加过量的BaCl2溶液目的____________________________________。
向混有碳酸钡沉淀的氢氧化钠溶液中滴入盐酸,为什么不会使碳酸钡溶解而能测定氢氧化钠的含量。_________________________________________________。
(5)用中和滴定的氯化钡法测定工业纯碱中NaHCO3的含量时,使用与测定烧碱相同的实验操作,过程稍作改变即可。
简述该操作过程_________________________________________________。
正确答案
(1)250mL容量瓶、电子天平(药匙)。
(2)甲基橙; 溶液由黄色变为橙色且半分钟不变色
(3)饱和NaHCO3溶液
平衡气体压强便于酸液流下,消除添加酸的体积影响。
(4)使Na2CO3完全变成BaCO3沉淀; 在混合液中滴加盐酸,氢氧化钠与先盐酸反应。滴定终点时溶液呈弱碱性,碳酸钡无法反应。
(5)混合液中加入过量NaOH标准溶液,然后加过量的BaCl2,以酚酞作指示剂用HCl标准溶液滴定过剩的NaOH。
解析
解析已在路上飞奔,马上就到!
知识点
26.乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应。
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤。
将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右。
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5. 12 g。
已知:
完成下列填空:
(1)下图装置中长导管有冷凝回流作用,它可以由分水回流装置代替。分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后, 有机层会自动流回到反应器中,将生成的水从分水器中放出去。
①分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用。
②使用分水器装置进行回流的可逆反应反应,一般应具备什么条件。
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水。预先加水的目的是_____________________。
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,其可能的原因是___________________。
(4)水洗的目的是_____________。碱洗的目的是____________。
测pH值的操作。_______________________。
(5)本次实验乙酸正丁酯的产率_____________ 。
正确答案
(1)
①可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高。
②有水生成;回流有机物位于水上层(反应温度100℃左右)。
(2)回流的有机物能及时返回反应体系。
(3)乙酸、正丁醇大量挥发,发生副反应。
(4)
除去水溶性杂质。
除去酸性杂质。
pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值。
(5)54.5%
解析
解析已在路上飞奔,马上就到!
知识点
27.乙烯在不同的条件下可被氧化生成不同产物。如下图所示:
已知:取0.62g A与过量的金属钠完全作用后,生成224mL(标准状况)气体。B的沸点低(10.7℃),B不能发生银镜反应而C能。D有酸性、强氧化性,可用于消毒杀菌。
完成下列填空:
(1)写出结构简式。
A_______;D_______
(2)写出C发生银镜反应的化学方程式。
(3)在C的溶液中加入溴水实验现象:___________________________________。
解释产生该实验现象可能原因:___________________________________。
(4)D可以和乙烯反应产生B, 写出该反应的化学方程式。
正确答案
(1)A:
(2)CH3CHO+2[Ag(NH3)2]OH
(3)溴水褪色。乙醛具有还原性,被溴水氧化;溴与甲基上的氢原子进行取代;溴在不饱和键上发生加成反应。
(4)

解析
解析已在路上飞奔,马上就到!
知识点
28.药物M主要用于防治骨质疏松症和乳腺癌,其结构式为
旧路线
新路线
已知:
①半缩醛可水解:
②卤代烃(RX)与镁于室温下在干燥乙醚中反应,生成格氏试剂(RMgX):
RX+Mg
格氏试剂很活泼,能与许多物质发生反应。如:
完成下列填空:
(1)写出反应类型。
①____________ ②____________
(2)写出结构简式。
A____________ D____________
(3)旧法中的原料
(4)写出B→C反应的化学方程式。
(5)设计一条以

(合成路线常用的表示方法为:A反应试剂反应条件B……反应试剂反应条件目标产物)
正确答案
(1)取代反应;消除反应
(2) 
(3) 6;
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
29.铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O__________g ,CaO__________mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2
日均需精辉铜矿。__________t
日均产SO2标准状况下体积。__________L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2g Cu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O
Cu(NO3)2·3H2O 125g /100g H2O
正确答案
(1)385 ; 8.8
(2)66.5 ; 7.17×106
(3)
剩余不溶物Cu 共溶解Cu: 11.2-4.8=5.6g 6.4 /64=0.1mol
Fe: 11.2g 11.2 /56=0.2mol
C(FeCl3)=0.6mol/0. 2L=3.0mol/L
(4)混合后反应Cu+NO3-+H+−−Cu2++H2O+N O x↑
剩余硝酸根量少且Cu(NO3)2·3H2O溶解度大,析出的是CuC12晶体
设晶体化学式为CuC12·xH2O
无水CuC12 20℃溶解度 为
生成CuC12 5.12•135/64= 10.8g,剩余水54.32—42=12.32g
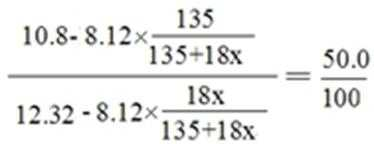
解析
解析已在路上飞奔,马上就到!