- 真题试卷
- 模拟试卷
- 预测试卷
2. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
正确答案
解析
A.水电离的c( H+)= 1xl0-13 mol/L的溶液,既可能显酸性,也可能显碱性,酸性溶液中SiO32-和氢离子反应生成H2SiO3,A错误;
B.1.0 mol/L的CH3COOH溶液中,CH3COOH和K+、Fe3+、NO3﹣、Cl﹣不反应,可以大量共存,B正确;
C.在c(OH﹣)/c(H+)=1×1012的溶液是碱性溶液,OH-和NH4+结合生成一水合氨,C错误;
D.能使甲基橙显黄色的溶液是PH>4.4,故若为碱性则可能大量共存,若显酸性,CO32﹣和SO32﹣和H+结合生成H2CO3和H2SO3,故酸性条件下不能大量共存,D错误。
故选B。
考查方向
解题思路
A.水电离的c( H+)= 1xl0-13 mol/L的溶液,既可能显酸性,也可能显碱性;
B.CH3COOH和K+、Fe3+、NO3﹣、Cl﹣不反应;
C. 在c(OH﹣)/c(H+)=1×1012的溶液是碱性溶液;
D.能使甲基橙显黄色的溶液是PH>4.4。
易错点
本题考查离子共存,明确离子性质及离子反应条件是解本题关键,注意隐含条件的挖掘。
知识点
4.下列图示且与对应的叙述不相符的是( )
正确答案
解析
A.根据图象知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强,则相同浓度的钠盐溶液中,NaA溶液的pH小于同浓度的NaB溶液的pH,A正确;
B.KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,B正确;
C.图象表示的是反应物能量高于生成物能量,反应是放热反应,加入催化剂可以降低化学反应的活化能,C正确;
D.依据化学方程式可知,相同时间下,二氧化氮消耗速率是四氧化二氮消耗速率的2倍时,二氧化氮的正逆反应速率相同,说明反应达到平衡,A点是说明二氧化氮和四氧化二氮的消耗速率相同,不能说明反应达到平衡,D错误。
故选D。
考查方向
解题思路
A.根据图象知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强;
B.溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液;
C.加入催化剂可以降低化学反应的活化能;
D.物质浓度在改变,不是平衡状态。
易错点
本题考查了图象分析判断,主要是化学平衡移动原理分析应用,物质溶解度与质量分数的关系判断,弱电解质溶液pH大小比较及盐类水解的判断方法,题目难度中等。
知识点
5.下表中的实验操作能达到实验目的的是( )
正确答案
解析
A.碳与浓硫酸反应生成的二氧化碳、二氧化硫均能使石灰水变浑浊,则不能说明二氧化碳的存在,应先检验二氧化硫并排除二氧化硫的干扰,A错误;
B.溴乙烷与NaOH的乙醇溶液共热发生消去反应,生成乙烯气体,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色,乙醇也可以使酸性高锰酸钾溶液褪色,不能证明溴乙烷的消去反应有乙烯生成,B错误;
C.先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀,可能含有亚硫酸根,被氧化成硫酸根离子,不能用于检验溶液中是否含有SO42-,C错误;
D.等浓度的HCl与CH3COOH,HCl完全电离,电离出的氢离子浓度大,所以pH小,D正确。
故选D。
考查方向
解题思路
A.碳与浓硫酸反应生成的二氧化碳、二氧化硫均能使石灰水变浑浊;
B.乙醇也可以使酸性高锰酸钾溶液褪色;
C.先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀,可能含有亚硫酸根;
D.等浓度的HCl与CH3COOH,HCl完全电离,电离出的氢离子浓度大。
易错点
本题考查化学实验方案的评价,涉及卤代烃的消去反应及水解产物、沉淀的生成、pH的比较、气体的检验及物质的性质,注重基础知识的考查,选项B为解答的难点,题目难度中等。
知识点
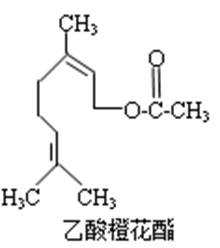
6. 乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中不正确的是()
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
正确答案
解析
①根据有机物的结构可知,其分子式为C12H20O2,故正确;
②该分子中含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性KMnO4溶液褪色,也能使溴水褪色,故错误;
③该分子中含有碳碳双键和酯基,所以能发生加成、取代、氧化、加聚反应,故正确;
④乙酸橙花酯的不饱和度为3,而芳香族化合物至少含有一个苯环,不饱和度至少为4,不存在属于芳香族化合物的同分异构体,故错误;
⑤1mol该有机物水解只能生成1mol羧基,所以只能消耗1molNaOH,故正确;
⑥该分子中含有两个碳碳双键能与氢气发生加成反应,酯基不能与氢气发生加成反应,所以1mol该有机物在一定条件下和H2反应,共消耗H2为2mol,故错误。
故选C。
考查方向
解题思路
①根据有机物的结构确定分子式;
②含有碳碳双键,具有烯烃的性质;
③该分子中含有碳碳双键和酯基,所以能发生加成、取代、氧化、加聚反应;
④乙酸橙花酯的不饱和度为3,而芳香族化合物至少含有一个苯环,不饱和度至少为4;
⑤酯基与氢氧化钠反应;
⑥碳碳双键与氢气发生加成反应,酯基不能与氢气发生加成反应。
易错点
本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查烯烃、酯的性质,题目难度不大。
知识点
1.下列有关说法中正确的是( )
正确答案
解析
A.乙醇消毒液消毒是因为可以使蛋白质变性,而并非是将病毒氧化,而次氯酸钠溶液可以将病毒氧化而达到消毒的目的,A错误;
B.绿色化学是指化学反应过程中以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”.不仅充分利用资源,而且不产生污染,B错误;
C.晶体管材料应具有导电性,锗电子迁移率比硅强,可用于半导体材料,C正确;
D.纤维素在人体中不能水解生成葡萄糖,需要浓硫酸催化剂作用发生水解,D错误。
故选C。
考查方向
解题思路
A.乙醇使蛋白质变性;
B.绿色化学的核心内容之一是“原子经济性”;
C.晶体管材料应具有导电性;
D.纤维素在人体中不能水解生成葡萄糖。
易错点
本题考查了生活中的化学知识应用,物质的存在和分析判断,掌握基础是关键,题目较简单。
知识点
7. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
正确答案
解析
A.高温条件下微生物会变性,故A错误;
B.负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故B正确;
C.原电池内部阳离子应向正极移动,故C正确;
D.正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D正确。
故选A。
考查方向
解题思路
A.从蛋白质的性质分析;
B.负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+;
C.原电池内部阳离子应向正极移动;
D.根据正负极电极反应式进行计算。
易错点
本题从两个角度考查①原电池反应(反应原理、电极方程式的书写、离子的移动方向);②有关化学方程式的计算。
知识点
3. 短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。下列说法正确的是( )
正确答案
解析
A.Y的单质是氧气,Z的单质是金属镁,金属镁的沸点大于氧气的沸点,故A错误;
B.C、O、Mg三种元素可以形成离子化合物MgCO3,故B错误;
C.非金属性S>C,因此最高价氧化物对应的水化物的碳酸的酸性小于硫酸的酸性,故C错误;
D.Y分别与Z、W形成的化合物分别为MgO、SO2或SO3,MgO中含有离子键,SO2或SO3中含有共价键,化学键类型不同,D正确。
故选D。
考查方向
原子结构与元素周期律的关系。
解题思路
X原子的最外层电子数是其内层电子数的2倍,因此X是C,Y是地壳中含量最高的元素O,Z2+与O2-具有相同的电子层结构,因此Z为Mg。X、Y、Z、W原子的最外层电子数之和为18,W是S,据此解答。
易错点
本题考查了短周期元素种类推断,涉及元素周期律中非金属性的比较以及化合键的判定等知识,难度不大,熟悉短周期元素的原子结构是解题的必备知识。
知识点
醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+ 2HCl(aq)= ZnCl2(aq)+ H2(g)
2CrCl3(aq)+ Zn(s) = 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO-(aq)+ 2H2O(l)= [Cr(CH3COO)2]2·2H2O(s)
请回答下列问题:
8.仪器1的名称是 。
9.往仪器2中加盐酸和三氯化铬溶液的顺序最好是 (选下面的A、B或C);目
的是 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
10.为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门 (填“A”或“B”,下同),打开阀门 。
11.本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 。
12.已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48g,则该实验所得产品的产率为 (不考虑溶解的醋酸亚铬水合物)。
正确答案
分液漏斗
解析
由图可知,仪器1的名称是分液漏斗。
考查方向
解题思路
根据仪器结构特征,判断仪器1的名称。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
C
让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化
解析
二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,故选C。
考查方向
解题思路
二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
B A
解析
为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,Zn和HCl反应生成氢气,压强增大,CrCl2溶液从容器2进入容器3。
考查方向
解题思路
利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
使锌与CrCl3充分反应得到CrCl2
解析
本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是使锌与CrCl3充分反应得到CrCl2
考查方向
解题思路
过量的锌与CrCl3充分反应得到CrCl2
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
84.0%
解析
CrCl3的物质的量为:


考查方向
解题思路
CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为0.15mol,由方程式可知CH3COONa足量,根据CrCl2计算22H2O 的理论产量,进而计算其产率。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:请回答下列问题:
13.步骤①所得废渣的成分是 (写化学式),操作I的名称 。
14.步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
15.⑤的离子方程式为 。
16.25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
17.该工艺流程中,可以循环利用的物质有 和 。
正确答案
SiO2 ;过滤
解析
废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅,故答案为:SiO2,过滤
考查方向
解题思路
废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅。
易错点
本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等。
正确答案
加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等]
H2SO4
解析
②中萃取时必须加入适量碱,分析平衡,Rn+(水层)+nHA(有机层)⇌RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;
③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,故答案为:加入碱中和产生的酸,平衡右移提高了钒的萃取率;硫酸
考查方向
解题思路
②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;
③中反萃取时加入的X试剂是抑制平衡正向进行。
易错点
本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等。
正确答案
NH3·H2O+VO3- =NH4VO3↓+OH-
解析
VO2+被KClO3氧化生成VO3- ,氨水与VO3- 反应的离子方程式为:NH3·H2O+VO3- =NH4VO3↓+OH-,故答案为:NH3·H2O+VO3- =NH4VO3↓+OH-
考查方向
解题思路
依据氨水与VO3-反应配平得到离子方程式。
易错点
本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等。
正确答案
1.7~1.8(或1.7、1.8其中一个)
2.6×10-3mol·L-1
解析
根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7~1.8,此时钒沉淀率达到最大,需要氨水量较小;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时PH=2,c(H+)=10-2mol/L,c(OH-)=10-12mol/L,则溶液中c(Fe3+)浓度依据溶度积计算,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.6×10-39,计算得到c(Fe3+)=2.6×10-3mol/L,不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol/L,故答案为:1.7~1.8;2.6×10-3mol/L
考查方向
解题思路
根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7~1.8,此时钡沉淀率达到最大,需要氨水量较小;依据沉淀溶度积计算分析。
易错点
本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等。
正确答案
氨气(或氨水)
有机萃取剂
解析
分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,故答案为:有机萃取剂;氨气。
考查方向
解题思路
分析流程图,物质参加反应,反应过程中又生成可以循环利用。
易错点
本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等。
含氮化合物的研发与绿色反展、经济可持续发展有着密切关联。
18.氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为: 。
19.氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)
每隔一定时间测定容器内各物质的物质的量,数据如下表:
①当反应在150℃达到平衡时,该反应平衡常数K=________。(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为______________。
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物___________g。
20.氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)=CO( NH2)2(s)+H2O(g)右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:
①b应控制在____; A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是_____________________。
正确答案
CH4(g)+H2O(g)= CO(g)+3H2(g) △H=+171.1KJ/mol
解析
分别根据图象1、2、3可知热化学方程式为:
①CO(g)+1/2O2(g)=CO2(g)△H=﹣282kJ/mol
②H2(g)+1/2O2 (g) =H2O(g) △H=﹣241.8kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=﹣836.3kJ/mol
将③﹣①﹣②×3可得:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+171.1kJ/mol
考查方向
解题思路
分别根据图象1、2、3写出热化学方程式,然后根据盖斯定律来分析.
易错点
本题主要考查了盖斯定律的应用,化学平衡移动、化学平衡常数的计算等,难度不大,培养了学生分析问题的能力。
正确答案
(i)①2.8 ②0.10mol/L
(ii)76g
解析
(i)①根据方程式中物质间的计量数关系、利用三段式可知,n1=0.3mol,n2=0.07mol,n3=0.24mol,n4=0.24mol,故在60min时反应达平衡,NO2的平衡浓度为0.12mol/L、N2O4的平衡浓度为0.04mol/L,故反应的平衡常数K=

②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,即与通入0.4molNO2达等效平衡,而在恒温恒容条件下,按照等量加料,则达等效平衡,故应加入0.2molN2O4,即0.1mol/L;
(ii)由题目信息可知,NO、NO2二者混合物与水反应生成亚硝酸,反应方程式为NO+NO2+H2O=2HNO2;亚硝酸再与尿素反应生成CO2和N2,反应方程式为CO(NH2)2+2HNO2=CO2+2N2+3H2O.
NO+NO2 ~2HNO2 ~CO(NH2)2
(30+46)g 1mol
1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为76g
考查方向
解题思路
(i)①根据方程式可知,n1=0.3mol,n2=0.07mol,n3=0.24mol,n4=0.24mol,根据NO2的平衡浓度为0.12mol/L、N2O4的平衡浓度为0.04mol/L来计算;
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,即与通入0.4molNO2达等效平衡,据此分析;
(ii)根据题目信息写出方程式,建立关系式,然后依据关系式进行计算。
易错点
本题主要考查了盖斯定律的应用,化学平衡移动、化学平衡常数的计算等,难度不大,培养了学生分析问题的能力。
正确答案
①C
②a等于4.0, CO2转化率迅速提高到最大值;而a在4.0之后增大,c(NH3)转化率无明显增大
解析
①氨碳比a[n(NH3)/n(CO2)]相同时,水碳比b[n(NH3)/n(CO2)]为0.6~0.7时,二氧化碳转化率最大,故选C;
②氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小。
考查方向
解题思路
①根据氨碳比a[n(NH3)/n(CO2)]相同时,水碳比b[n(H2O)/n(CO2)]为0.6~0.7时,二氧化碳转化率最大;
②根据氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小。
易错点
本题主要考查了盖斯定律的应用,化学平衡移动、化学平衡常数的计算等,难度不大,培养了学生分析问题的能力。
【化学选修——化学与生活】
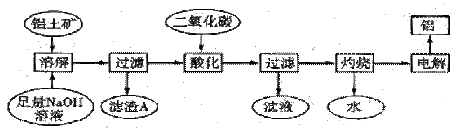
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为: 2Na2SiO3+2NaAlO2+4H2O=Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
21.溶解铝土矿时,发生反应的离子方程式为 、 ________。
22.滤渣A的主要成分是 ;硅铝酸盐沉淀写成氧化物的形式是 。
23.在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 。
24.若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 。
25.若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
26.电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 ,配位数为 。
正确答案
2OH-+Al2O3=2AlO2-+H2O
SiO2+2OH-=SiO32-+H2O
解析
铝土矿中氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,离子方程式:2OH﹣+Al2O3═2AlO2﹣+H2O;
二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH﹣═SiO32﹣+H2O
考查方向
解题思路
铝土矿中氧化铝、二氧化硅能够与氢氧化钠反应
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
Fe2O3、Na2Al2Si2O8
Na2O·Al2O3.·2SiO2
解析
依据铝土矿主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,铝土矿中氧化铝、二氧化硅能够与氢氧化钠反应分别生成偏铝酸钠和硅酸钠,氧化铁不与氢氧化钠反应,依据2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物,所以Na2Al2Si2O8改写为氧化物为Na2O•Al2O3•2SiO2
考查方向
解题思路
依据铝土矿主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,结合氧化铝、二氧化硅性质判断滤渣成分;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率(或合理答案)
解析
反应后溶液含有大量偏铝酸钠溶液,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,若选用盐酸,则生成的氢氧化铝会溶于过量的盐酸,所以第三步中选用二氧化碳作酸化剂。
考查方向
解题思路
依据氢氧化铝能够溶于强酸,不溶液弱酸的性质解答。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
5100n/27m% 或1700n/9m%
解析
设铝土矿中氧化铝为xkg,
2Al~~~~Al2O3
27×2 102
nkg xkg
则x=
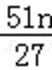
铝土矿中Al2O3的质量分数为
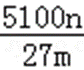
考查方向
解题思路
根据铝元素守恒由Al的质量计算出氧化铝的质量,再求出质量分数。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
B
解析
浓硫酸、浓硝酸具有强的氧化性,能够使铝钝化,不能用来溶解铝,铝与稀硝酸反应生成硝酸铝和一氧化氮和水,一氧化氮有毒,铝与稀硫酸反应生成硫酸铝和氢气,可以用来溶解铝,故选B
考查方向
解题思路
浓硫酸、浓硝酸具有强的氧化性,能够使铝钝化,铝与稀硝酸反应生成硝酸铝和一氧化氮和水,与稀硫酸反应生成硫酸铝和氢气。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
[AlF6]3-
6
解析
中心离子和配体组成內界,其余部分为外界,则Na3AlF6中Na+为外界,[AlF6]3-为內界;配原子的数目即是配位数,所以配位数为6
考查方向
解题思路
中心离子和配体组成內界,其余部分为外界;配原子的数目即是配位数。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。