- 真题试卷
- 模拟试卷
- 预测试卷
1.化学与生产、生活密切相关,下列说法正确的是()
正确答案
解析
淀粉与纤维素的分子式为(C6H10O5)n ,属于天然高分子化合物,A正确。碱石灰中含有氢氧化钠腐蚀性很强,不能做食品干燥剂,B错误。煤的液化是化学变化,C错误。聚醋纤维属新型有机高分子材料,D错误。
考查方向
解题思路
加强对一些物质基本性质的了解与记忆,适当看一些课外书籍扩大知识面。
易错点
一些基本概念不清,导致判断错误
知识点
2.分子式为C4H10O且能和钠反应放出氢气的物质的同分异构体的数目为(不考虑立体异构体)()
正确答案
解析
由分子式C4H10O且能和钠反应放出氢气,可以判断该物质属于醇,有四种同分异构体:




考查方向
解题思路
先认真审题,明白所书写哪一类型的同分异构体,再按一定的顺序去书写,这样就不会产生遗漏。
易错点
同分异构体书写
知识点
5.下列实验操作、现象和结论均正确的是 ()
正确答案
解析
因为Cu(OH)2与Mg(OH)2的Ksp表达式相同,加入的Mg观察K的焰色,要透过蓝色钴玻璃,B错误。C实验只能说明酸性HCl>H2SiO3,但比较非金属性看的是最高价的含氧酸的酸性,C错误。蔗糖中加入浓硫酸后,浓硫酸表现出脱水性、强氧化性使蔗糖碳化,并且生成了二氧化碳、二氧化硫气体,D错误。
考查方向
解题思路
要了解实验原理,对实验现象才能更好地解释。例如浓硫酸滴入蔗糖中,蔗糖变黑是被脱水碳化了,产物再与浓硫酸反应产生了刺激性气味的气体,表现了其强氧化性。
易错点
实验原理把握不准,得出错误结论。
知识点

(LiI)和微量水,工作原理如图,总反应为:O2+4LiI+2H2O
正确答案
解析
放电时,负极发生氧化反应,I-在此过程中被氧化,A正确。充电时,相当于电解池,电解质中的阳离子向阴极区移动,B正确。充电时,阴极发生还原反应,反应前后Li+的化合价并未变化,正确的反应为:I2+2e-=2I-,C错误。电池放电时,正极发生还原反应,从总反应方程可以看出,反应中O2的化合价降低,D正确。
考查方向
解题思路
先分清电池处于什么过程中,放电是作为原电池,充电是作为电解池,再判断电池的二极分别发生什么类型的反应。
易错点
电池放电与充电二个过程中电极反应的判断,与电极方程式的书写
知识点
4.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下
正确答案
解析
X、Y、Z、W属前三周期元素,又从其在周期表结构看,X、W 是前第二周期元素,Y、Z是第三周期元素。再由Z所处的族序数是周期序数的2倍,推知为S,所以最终结果为:X(C)、Y(P)、Z(S)、W(F)。最高正价等于其最外层电子数,A正确。原子半径应当是:P>S>C,B错误。非金属性F>S,非金属性越强气态氢化物越稳定,C正确。非金属性越强,最高价的含氧酸的酸性也越强,D正确。
考查方向
解题思路
先由各元素在周期表中的位置关系推断出各元素,充分熟悉各种判断依据,如原子半径大小判断依据,氢化物的稳定性是由非金属性的强弱决定的等。
易错点
周期表结构不熟,物质性质判断依据混淆
知识点
6.已知:含碳碳双键的物质一定条件下能与水发生加成反应生成醇,有机物A—D间存在图示的转化关系。下列说法不正确的是 ()
正确答案
解析
由C经催化氧化得到乙酸,可以推断出A为乙烯,B为乙醇,D为乙酸乙酯。乙烯能被高锰酸钾氧化,使其褪色,A正确。因为酒精与水可以互溶,所以不能用它碘水中的碘单质,B错误。乙醇与乙酸发生的酯化化反应也是取代反应中的一种类型,C正确。乙酸乙酯的结构简式为:C
考查方向
解题思路
本题比较简单,从C被氧化成乙酸进行突破,再推出其它物质,得到正确结论。
易错点
有机知识记忆不清
知识点
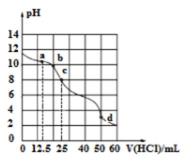
7.在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3 溶液,所得滴定曲线如下图所示。下
正确答案
解析
在a点处,加入的HCl是Na2CO3量的一半,因此混合后的溶液中溶质为NaHCO3、NaCl、Na2CO3且三者等物质的量,再就是NaHCO3的水解程度没有Na2CO3的强,因此离子浓度大小关系为:c( HCO3-)>c(Cl-)>c(CO32-),A正确。b点溶液中的溶质仍为NaHCO3、NaCl、Na2CO3根据电荷守恒得到:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-),B错误。c点加入的HCl与Na2CO3等物质的量,溶液中的溶质为NaHCO3、NaCl,此时利用电荷守恒与物料守恒得出c(OH-)+c(CO32-)=c(H+)+c(H2CO3),C正确。d点溶液中的溶质全为NaCl,c(Cl-)=c(Na+),D正确。
考查方向
解题思路
先理清溶液中发生的反应,由滴加的HCl的量,判断出溶液的溶质及溶质的量,再利用水解,及三大守恒得到正确选项。
易错点
图形的解读能力不够、以及电解质溶液中的三大守恒运用不好
知识点
为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
8.碘在周期表中的位置为__________________;
9.碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
10.混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
11.试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
12.如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
正确答案
(1)第五周期 第ⅦA族
解析
(1)I属于卤族元素,在周期表中的位置为第五周期 第ⅦA族。
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
解析
(2)反应中I由0价升高到+5价,Cl由+5价降到0价与-1价。利用得失电子守恒,可得到正确答案。
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(3)促进氯气从反应混合物中逸出 稀盐酸盐酸能还原已生成的碘酸氢钾
解析
(3)由(2)中的反应可知反应过程中会产生氯气,用酸酸化能降低氯气在混合液中的溶解,有利于氯气从混合液中逸出。由信息可知生成的碘酸氢钾具有很强的氧化性,由于盐酸是一种有还原性的酸,二者混合会发生反应。
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(4)KOH KH(IO3)2+KOH=2KIO3+H2O
解析
(4)加入氢氧化钾是将反应中生成的KH(IO3)2转变成KIO3,反应方程式为KH(IO3)2+KOH=2KIO3+H2O
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(5)反应产生的氯气能与氢氧化钾溶液反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾
解析
(5)如没有“酸化”、“逐氯”、“结晶①、过滤”这三步操作反应产生的氯气能与氢氧化钾溶液反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
氨在生活、生产、科研中有广泛用途。
13.已知
反应Ⅰ:2NH3(g) +CO2(g) =NH2CO2NH4(s) △H=−159.5 kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2 (s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在____________条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
14.用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应
4NH3(g)+6NO(g

催化剂,反应产生N2的量随时间变化如图所示。
①0~4分钟在A催化剂作用下,反应速率
υ(N2)=_______________;
②下列说法正确的是_________
15.查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10。
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
K稳=______________________;
②计算得到可逆反应AgCl (s)+2NH3(aq)
K=_________,1 L 1 mol/L氨水中最多可以溶解AgCl________mol(保留2位有效数字);
16.工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH—CN),该反应的化学方程式为 。
正确答案
(1)2NH3(g) +CO2(g) = CO(NH2)2 (s)+ H2O(l) △H=-87 kJ/mol 低温
解析
(1)Ⅰ+Ⅱ-Ⅲ便可得到2NH3(g) +CO2(g) = CO(NH2)2 (s)+ H2O(l) △H=-87 kJ/mol,判断反应的自发性看的是自由能变: ,已知,要使,需要T在较小时,即低温自发。
考查方向
解题思路
逐题分析,由题干信息联想到所涉及的知识,并提取相关知识正确解答。如第(1)题是有关化学反应中热化学反应方程的书写,通过将几个已知反应相加或相减得到新方程式,新方程式的反应热是原几个反应的代数和。稳定平衡常数也是化学平衡常数中的一种,有关表达方式与化学平衡常数相同,这样在心理上就不会胆怯,平时也注得加强审题与解题心理素质的训练。
易错点
对稳定平衡常数不理解,导致本题失分,对图形的解读能力不足。
正确答案
(2)①0.3125mol·L-1·min-1 ②CD
解析
(2)①0.3125mol·L-1·min-1。②反应速度越快,所需的活化能越小,A错误。催化剂不能改变N2的产率,B错误。一个NH3中有三根N-H键,一个H2O中有二根O-H键。当单位时间内氢氧键与氮氢键断裂的数目相等时,意味着相同时间内,消耗的NH3与消耗的H2O的速率比为4:6,说明反应已经达到平衡。
考查方向
解题思路
逐题分析,由题干信息联想到所涉及的知识,并提取相关知识正确解答。如第(1)题是有关化学反应中热化学反应方程的书写,通过将几个已知反应相加或相减得到新方程式,新方程式的反应热是原几个反应的代数和。稳定平衡常数也是化学平衡常数中的一种,有关表达方式与化学平衡常数相同,这样在心理上就不会胆怯,平时也注得加强审题与解题心理素质的训练。
易错点
对稳定平衡常数不理解,导致本题失分,对图形的解读能力不足。
正确答案
(3)①c [Ag(NH3)2+]/c(Ag+)·c2(NH3) ②2.5×10-3 0.047
解析
(3)①由化学方程式可得:c [Ag(NH3)2+]/c(Ag+)·c2(NH3)。②,,将二式相乘得到AgCl (s)+2NH3(aq)
考查方向
解题思路
逐题分析,由题干信息联想到所涉及的知识,并提取相关知识正确解答。如第(1)题是有关化学反应中热化学反应方程的书写,通过将几个已知反应相加或相减得到新方程式,新方程式的反应热是原几个反应的代数和。稳定平衡常数也是化学平衡常数中的一种,有关表达方式与化学平衡常数相同,这样在心理上就不会胆怯,平时也注得加强审题与解题心理素质的训练。
易错点
对稳定平衡常数不理解,导致本题失分,对图形的解读能力不足。
正确答案
(4)2CH2=CH—CH3+2NH3+3O2
解析
(4)由相关信息再结合原子守恒得到反应方程式为:2CH2=CH—CH3+2NH3+3O2
考查方向
解题思路
逐题分析,由题干信息联想到所涉及的知识,并提取相关知识正确解答。如第(1)题是有关化学反应中热化学反应方程的书写,通过将几个已知反应相加或相减得到新方程式,新方程式的反应热是原几个反应的代数和。稳定平衡常数也是化学平衡常数中的一种,有关表达方式与化学平衡常数相同,这样在心理上就不会胆怯,平时也注得加强审题与解题心理素质的训练。
易错点
对稳定平衡常数不理解,导致本题失分,对图形的解读能力不足。
NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。
Ⅱ.产品纯度的检测:
Ⅲ.有毒废水的处理:
17.将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
18.pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为_________________;
19.从上述生成物混合液中获得较高产率Na2S2O3·5H2O的歩骤为
为减少产品的损失,操作①为趁热过滤,其目的是______________________________;
操作②是___________________________________;操作③是抽滤、洗涤、干燥。
20.已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL,则该样品纯度是______________________;
21.滴定过程中可能造成实验结果偏低的是___________________;
22.兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________
正确答案
解析
(1)制取SO2时,为减少SO2在水的溶解,且使反应速度较快常用70%的硫酸。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
(2)Na2S2O3 +SO2+H2O=2NaHSO3+S↓
解析
(2)由信息提示可知如通入过量的二氧化硫将会与Na2S2O3发生氧化还原反应得到S单质,反应方程为:Na2S2O3 +SO2+H2O=2NaHSO3+S↓。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
(3)趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质蒸发浓缩,冷却结晶;
解析
(3)过滤是为了除去活性炭、硫等不溶性杂质。趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;从流程中可以看到滤液经②③2步后,得到了晶体,所以步骤②是将晶体从溶液中结晶出来,考虑到Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水,所以应当采用降温结晶的方法。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
(4) ×100%
解析
(4)利用关系式: 2Na2S2O3——I2 n(I2)=,则n(Na2S2O3)=,再算出其质量后便可求出其纯度为。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
解析
(5)锥形瓶本身就不能用Na2S2O3溶液润洗,润洗了会使结果偏高,A错误。锥形瓶中溶液变蓝后需等30s,溶液不褪色才能判断滴定终点,如果立刻停止滴定进行读数,会使所滴加的碘水体积偏小,造成结果偏低,B错误。滴定终点时仰视读数,使体积偏大,结果偏大,C错误。滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,使滴定过程中碘水的体积读数偏小,结果偏低,D正确。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
CN-+S2O32-= SCN-+SO32-
解析
(6)从信息加入FeCl3溶液变红分析得出,产物中一定会有SCN-,结合化合价变化利用得失电子守恒得出反应为:CN-+S2O32-= SCN-+SO32-。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
【化学一选修5:有机化学基础】
化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是
回答下列问题:
23.A的名称为________________________;
24.D的结构简式是__________________,分子中最多有_________个碳
25.①的反应方程式是_______________________________________,④的反应类型是_______;
26.关于物质C的下列说法正确的是___________________;
27.B满足苯环上有两个取代基且能发生银镜反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6∶2∶2∶l∶l的是_________(写结构简式);
28.参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备
正确答案
(1)乙苯
解析
(1)由反应①分析可知A与乙酰基氯发生了取代反应得到:

考查方向
解题思路
充分把握信息由A为单取代芳烃的同系物,再结合①对A的结构进行判断,再利用顺推与逆推相结合的方法,推出相关物质的结构简式。对于同分异构体数目的判断则要进行有序思维,按照一定的方式去推,否则很容易出现遗漏。有机合成路线采用逆推的方法是不错的选择,将产物先进行拆解,再逐步推断。
易错点
分子共面问题与同分异构体数目的计算
正确答案
(2)
解析
(2)经反应③得到D,D物质能与溴的四氯化碳反应,得到E,E在KOH的乙醇溶液中发生消去反应得到炔烃因此D、E、F的结构简式分别为:


考查方向
解题思路
充分把握信息由A为单取代芳烃的同系物,再结合①对A的结构进行判断,再利用顺推与逆推相结合的方法,推出相关物质的结构简式。对于同分异构体数目的判断则要进行有序思维,按照一定的方式去推,否则很容易出现遗漏。有机合成路线采用逆推的方法是不错的选择,将产物先进行拆解,再逐步推断。
易错点
分子共面问题与同分异构体数目的计算
正确答案
(3)
解析
(3)反应①是乙苯与乙酰基氯发生取代反应,并且得到HCl,反应方程式见答案。
考查方向
解题思路
充分把握信息由A为单取代芳烃的同系物,再结合①对A的结构进行判断,再利用顺推与逆推相结合的方法,推出相关物质的结构简式。对于同分异构体数目的判断则要进行有序思维,按照一定的方式去推,否则很容易出现遗漏。有机合成路线采用逆推的方法是不错的选择,将产物先进行拆解,再逐步推断。
易错点
分子共面问题与同分异构体数目的计算
正确答案
解析
(4)物质C中无酚羟基,A错误。羟基所在的碳上要有二个或二个以上的氢,才能被氧化得到醛,B错误。苯环侧链上还有H,也能发生取代,C错误。醇在一定条件下能与HBr发生取代反应,D正确。
考查方向
解题思路
充分把握信息由A为单取代芳烃的同系物,再结合①对A的结构进行判断,再利用顺推与逆推相结合的方法,推出相关物质的结构简式。对于同分异构体数目的判断则要进行有序思维,按照一定的方式去推,否则很容易出现遗漏。有机合成路线采用逆推的方法是不错的选择,将产物先进行拆解,再逐步推断。
易错点
分子共面问题与同分异构体数目的计算
正确答案
(5)15
解析
(5)








考查方向
解题思路
充分把握信息由A为单取代芳烃的同系物,再结合①对A的结构进行判断,再利用顺推与逆推相结合的方法,推出相关物质的结构简式。对于同分异构体数目的判断则要进行有序思维,按照一定的方式去推,否则很容易出现遗漏。有机合成路线采用逆推的方法是不错的选择,将产物先进行拆解,再逐步推断。
易错点
分子共面问题与同分异构体数目的计算
正确答案
解析
(6)合成


考查方向
解题思路
充分把握信息由A为单取代芳烃的同系物,再结合①对A的结构进行判断,再利用顺推与逆推相结合的方法,推出相关物质的结构简式。对于同分异构体数目的判断则要进行有序思维,按照一定的方式去推,否则很容易出现遗漏。有机合成路线采用逆推的方法是不错的选择,将产物先进行拆解,再逐步推断。
易错点
分子共面问题与同分异构体数目的计算