- 真题试卷
- 模拟试卷
- 预测试卷
1.中国“十二五”规划明确提出到2015年单位GDP的二氧化碳排放比2010年要降低17%,下列措施不符合该规划要求的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.下列有关化学用语表示正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列表示对应化学反应的离子方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.设NA为阿伏加德罗常数的值。下列说法正确是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.图6为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列有关物质的性质和用途的说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列有关实验原理或操作正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见图5),下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列有关说法正确的是( )
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
知识点
15. 已知反应:2CH3OH(g)
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
知识点
12. 由原料X经过多步反应可合成阿维A酯,阿维A酯是一种常见皮肤病用药,流程如下:
下列叙述正确的是( )
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
知识点
13.下列实验操作、现象与结论对应关系正确的是( )
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
知识点
14.在常温下,等物质的量的Na2S和NaHS的混合溶液中,微粒物质的量浓度关系正确的是( )
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
知识点
18.把含有Fe3+的溶液中,将pH值调整到1.6~1.8左右,并将溶液加热至85~95℃时,加入硫酸钠,就会有浅黄色的黄钠铁矾晶体[NaxFey(SO4)m(OH)n]析出,该晶体颗粒粗大,沉淀速度快,容易过滤。某研究小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)工业废水中的Fe3+常常会被转化成黄钠铁矾除去,而不采取转变成Fe(OH)3沉淀的方法,可能原因是Fe(OH)3 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
正确答案
(1)沉淀颗粒小、沉淀速率慢、不容易过滤等。
(2)淀粉溶液;溶液蓝色恰好褪去,且半分钟内不再恢复
(3)n(Fe3+)=2n(I2) =n(Na2S2O3)=0.2500 mol·L-1×30.00 mL×10-3 L·mL-1=7.50×10-3 mol
n(SO42-)=1.165 g ÷233 g·mol-1=5.00×10-3 mol
100 mL溶液中含有n(Fe3+)=0.03 mol,n(SO42-)=0.02 mol
n(Na+)=0.01 mol,n(OH-)=0.06 mol
x∶y∶m∶n=n(Na+)∶n(Fe3+)∶n(SO42-)∶n(OH-)=1∶3∶2∶6
化学式为NaFe3(SO4)2(OH)6
解析
解析已在路上飞奔,马上就到!
知识点
19.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
已知:几种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤时主要玻璃仪器有 。
(2)检验反应I是否进行完全的方法是: 。
(3)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,由Mg(ClO3)2溶液制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;
②趁热过滤;
③ ;
④过滤、洗涤、干燥。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和24mL1.0000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.1000mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+,发生的反应为:6Fe2+ + Cr2O72- +14H+ =6Fe2+ +2Cr3+ +7H2O
达滴定终点时,记录消耗K2Cr2O7的体积。再重复三次相同实验,得到数据分别为20.04mL、20.00mL、16.92mL、19.96mL。
①步骤2中发生反应的离子方程式为: 。
②若标定过程中没有误差,实际测定Mg(ClO3)2·6H2O的含量偏高,原因可能是________________。
(5)计算Mg(ClO3)2·6H2O的质量分数。
正确答案
(1)漏斗、玻璃棒、烧杯
(2)取少量溶液于小试管中,向其中滴加几滴酸性KMnO4溶液,若紫色褪去,则Fe2+未反应完全,反之则反应完全。
(3)蒸发浓缩 冷却结晶
(4)
①ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
②Mg(ClO3)2·6H2O 可能失去了结晶水
(5) ClO3- ~ 6Fe2+ ~ Cr2O72-
n(ClO3-) 0.02*0.1=0.002 mol
n(ClO3-) =0.002mol
n[ Mg(ClO3)2·6H2O]=0.001mol
w[ Mg(ClO3)2·6H2O]=
解析
解析已在路上飞奔,马上就到!
知识点
21.【选做题】
本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
(1)固氮酶是一种能够将分子氮还原成氨的酶,是生化反应中的重要催化剂。
①固氮酶不仅能将N2催化还原成NH3,还能将乙炔催化还原成乙烯,下列说法正确的有 。
a. 温度越高,固氮酶的催化性能越好,反应速率越快
b. C2H2、C2H4分子中σ键之比为1:2
c. 碳负离子CH3-呈三角锥形
d.NH3沸点比N2高,主要是因为前者是极性分子
e.NH3的稳定性大于CH4
②钒可合成固氮酶。V2+基态时核外电子排布式为 。
(2)对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)是一种多功能材料,具有良好的光学性能。
①晶体中四种基本元素的电负性由大到小的顺序是 ;对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是 。
②科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是 ,其中心原子N的杂化方式是 。
B.[实验化学]
4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下:
实验装置图如下:
主要实验步骤:
步骤1.向三口烧瓶中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL(0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗品
步骤3.粗品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪品名称:a___________,b___________。
(2)浓H2SO4需要冷却至0℃以下的原因是____________________。
(3)反应需要搅拌12h,其原因是____________________。
(4)确定最终产品是4,7-二甲基香豆素的实验或方法是____________________。
(5)本次实验产率为______。
正确答案
A(1)
①be
②1s22s22p63s23p63d3或[Ar]3d3
(2)
① O>N>C>H;氢键
②
B
(1)恒压滴液漏斗;吸滤瓶。
(2)防止浓硫酸将有机物氧化和炭化
(3)使反应物充分接触反应,提高反应产率
(4)测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等
(5)89.0%
解析
解析已在路上飞奔,马上就到!
知识点
17.有机物F是一种治疗关节炎止痛药,合成F的一种传统路线如下:
(1)B中含氧官能团的名称为 ,1molB最多可以消耗 molH2.。
(2)A→B,D→E的反应类型分别为 、 。
(3)X是F的同系物,摩尔质量为150g·mol—1。写出一种满足下列条件的X的结构简式: 。
①核磁共振氢谱只有四组峰
②与新制的Cu(OH)2悬浊液共热能产生砖红色沉淀
(4)写出F和乙醇溶液反应的化学方程式: 。
(5)已知:
①
②
合成F的一种改良法是以2—甲基—1—丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
正确答案
(1)羰基;4mol
(2)取代反应 ;消去反应
(3)
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
20.甲醇是极为重要的有机化工原料,在化工、医药、轻工、纺织及运输等行业都有广泛的应用。可以用CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g)
II:CO(g) + 2H2(g)
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:______________________________。
(2)在压强为0.1MPa、温度为300℃条件下,使1molCO与2molH2在催化剂作用下在恒温恒容的容器中发生反应II生成甲醇,下列有关说法正确的是 (填字母序号)。
A.移走CH3OH,平衡正向移动,正反应速率加快
B.反应达平衡后,再加入1molCO与2molH2,CO转化率增大
C.混合气体的密度不变时,说明反应达到平衡
D.平衡后,将容器体积压缩至原来一半,平衡常数K增大
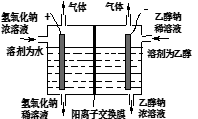
(3)某科研组设计见如图装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过)。电解时阳极产成的气体是 ,阴极发生的电极反应式为 。
(4)甲醇对水质会造成一定的污染,可利用Co2(SO4)3氧化除去甲醇,得到CoSO4和一种常见气体。请写出除去甲醇的离子方程式 。
正确答案
(1)CH4(g)+H2O(g) =CH3OH(g) +H2(g)△H=+77.0 kJ/mol
(2)B
(3)O2;CH3CH2OH+2e-=2CH3CH2O-+H2↑
(4)6Co3+ + CH3OH + H2O = CO2↑+ 6Co2+ + 6H+
解析
解析已在路上飞奔,马上就到!
知识点
16.锌精矿经过焙烧后得到锌焙砂(主要含ZnO、ZnFe2O4、ZnSO4, 还有少量的FeO、CuO、NiO等氧化物),工业上可利用锌焙砂制取金属锌,其流程如下图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为 。
(2)向酸浸后的溶液Ⅰ中加入H2O2的作用是什么?请用离子方程式表示:
。
(3)①加入X的作用是调节pH值,X可以是 。
A.NaOH B.ZnO
C.Zn D.ZnCO3
②25℃时,若要除尽Fe3+,需要调节pH= 。(离子浓度低于10﹣5mol•L﹣1时可认为已经除尽。已知25℃,Ksp[Fe( OH)3]=1.0×10﹣38)
(4)电解溶液Ⅳ还能得到一种气体,该气体是 。
(5)本流程中可以循环利用的物质除锌外还有 。
正确答案
(1)ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
(2)H2O2+2Fe2++2H+═2Fe3++2H2O
(3)BD; 3
(4)O2
(5)H2SO4
解析
解析已在路上飞奔,马上就到!