- 真题试卷
- 模拟试卷
- 预测试卷
2.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.用NA表示阿伏伽德罗常数的值。下列叙述正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.在水溶液中能大量共存的一组离子是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列有关原电池和电解池的叙述中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.如图X、Y、A、B、C均为短周期主族元素,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列溶液中,微粒的物质的量浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.实现反应CH4(g)+CO2(g)
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0=_________kJ·mol-1
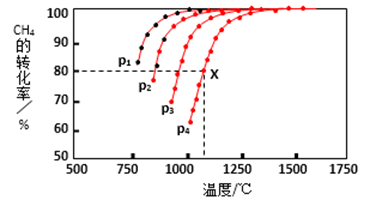
(2)在密闭容器中,通入2.5mol的CH4与2.5molCO2,一定条件下发生反应:CH4(g)+CO2(g)
据图可知,p1、p2、 p3、p4由大到小的顺序_________ 。
(3)CO和H2还可以通过反应C(s)+H2O(g)
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是_________
A.体系压强不再变化
B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变
D.每消耗1mol H2O(g)的同时生成1mol H2
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K=_________。
若此时增大压强,平衡将向_________(填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
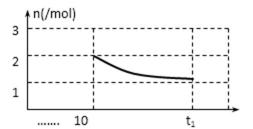
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。
正确答案
(1)+248 ;
(2)P4> P3> P2> P1;
(3)① AC;
② 1mol/L;逆
③
解析
解析已在路上飞奔,马上就到!
知识点
9.用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为加快浸取速率,无法达到目的的是_________
A. 延长浸取时间
B. 将辉铜矿粉碎
C.充分搅拌
D.适当增加硫酸浓度
(2) 浸取反应中氧化剂的化学式为_________;滤渣Ⅰ的成分为MnO2、S和_________(写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是_________。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法__________________。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式__________________。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是__________________(写化学式)。
正确答案
(1)A;
(2)MnO2 SiO2;
(3)Fe3+可催化Cu2S被MnO2氧化(或答:Fe2O3在浸取时起媒介作用)
(4)CuO[Cu(OH)2;将溶液加热
(5)Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+
(6)(NH4)2SO4
解析
解析已在路上飞奔,马上就到!
知识点
10.铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
(1)B装置中反应的化学方程式___________________________。
(2)A中溶液变红的原因是___________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_________
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+ 与SCN-生成红色Fe(SCN) 3的反应_________可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为_________个。
② 若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.①高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产
物为FeOOH,该极电极为_________极,电极反应式为________________。
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化.请说明其原理__________________
正确答案
Ⅰ. (1) 2NaOH + Cl2 =NaCl + NaClO + H2O
(2) Fe2+ 被Cl2氧化产生Fe3+,Fe3+与SCN-反应生成Fe(SCN)3呈红色
(3)① Fe3+ ② 是
(4) ① 8×6.02×1023
②氯化钡溶液、盐酸
Ⅱ.①正 FeO42-+3e-+3H2O=FeOOH+ 5OH-
② Na2FeO4 具有强氧化性,能够杀菌消毒,还原产物Fe3+ 水解生成氢氧化铁胶体能够凝聚水中的悬浮物并能够吸附色素达到净水的目的
解析
解析已在路上飞奔,马上就到!
知识点
11.化合物III可通过如下反应制得:
化合物I可通过下列路径合成:
①化合物I的分子式为__________________。化合物Ⅱ中含氧官能团的名称_________。
②化合物III与NaOH溶液共热反应的方程式__________________。
③化合物IV的结构简式为_________,生成化合物IV的反应类型为_________。
④化合物I 能发生消去反应,其中一种有机产物的结构简式_________。
⑤一定条件下,1 mol化合物Ⅱ和H2反应,最多可消耗H2_________ mol。
⑥CH3CH2MgBr和
正确答案
⑴C10H14O,羧基
⑵
⑶ 
⑷ 

⑸ 1
⑹
解析
解析已在路上飞奔,马上就到!