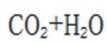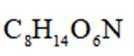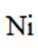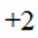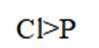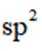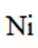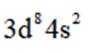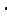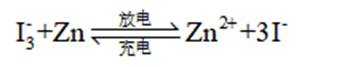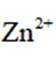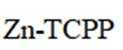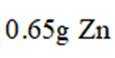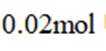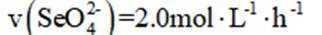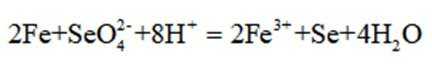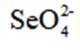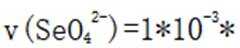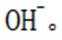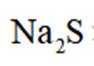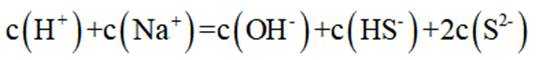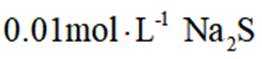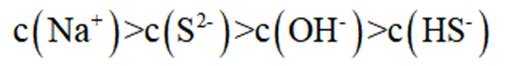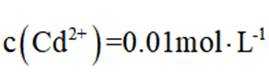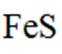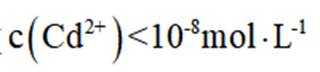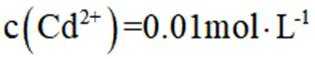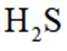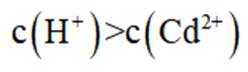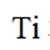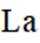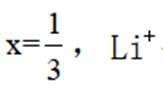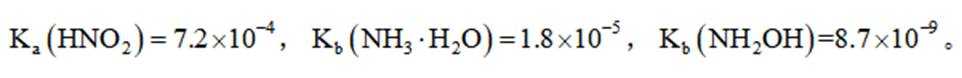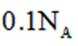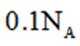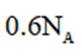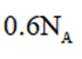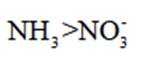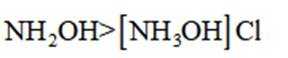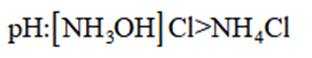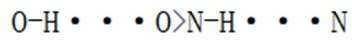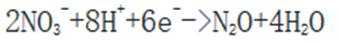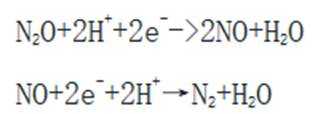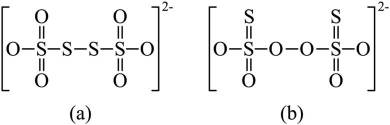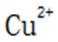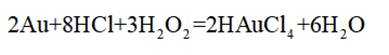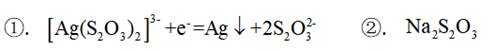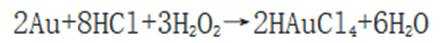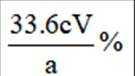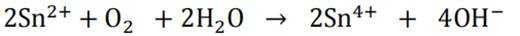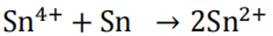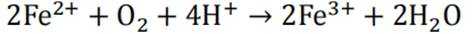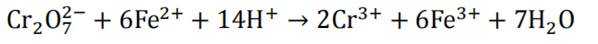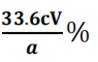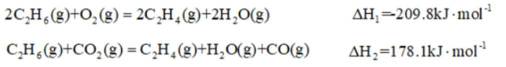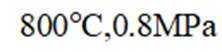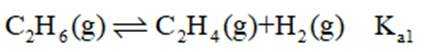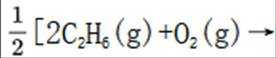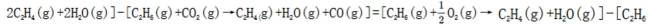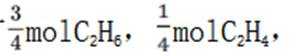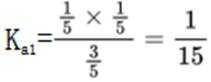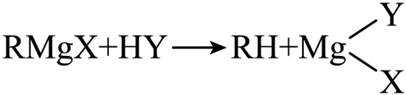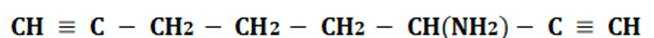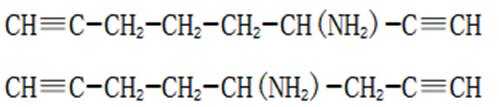- 真题试卷
- 模拟试卷
- 预测试卷
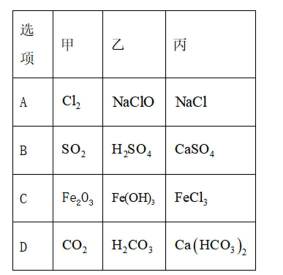
下列资源利用中,在给定工艺条件下转化关系正确的是
正确答案
解析
本题考查有机化学转化的知识点。
各个选项:
A.煤——干馏——>煤油煤干馏是一种热解过程,它可以将煤转化为焦炭、煤焦油、煤气等。煤焦油中包含煤油,但煤干馏的直接产物并不是煤油,而是煤焦油,然后煤焦油需要经过分馏才能得到煤油。因此,选项A中的转化关系不正确。
B.石油——分馏——>乙烯石油分馏是将石油按照沸点的不同分离成不同组分的过程,主要产物包括汽油、煤油、柴油、润滑油等。乙烯是一种通过石油的裂解过程得到的低分子烃,而不是通过分馏过程得到的。因此,选项B中的转化关系不正确。
C.油脂——皂化——>甘油油脂的皂化是一种化学反应,通常在碱性条件下进行,将油脂中的脂肪酸与碱反应生成肥皂(即高级脂肪酸盐)和甘油。这是正确的转化关系,因为皂化反应确实会产生甘油。
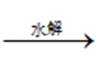
D.淀粉——水解——>乙醇淀粉的水解通常是指淀粉在酶的作用下水解成葡萄糖。葡萄糖可以通过发酵过程转化为乙醇,但这需要额外的微生物(如酵母)参与,而题目中没有提到发酵过程。因此,选项D中的转化关系不完整,没有包括发酵步骤。综上所述,选项C是正确的,因为它描述了一个完整的化学反应过程,油脂经过皂化反应可以产生甘油。其他选项的转化关系要么不完整,要么描述的是不同过程的组合。故选C
下列各组物质的鉴别方法中,不可行的是
正确答案
解析
本题考查物质特征鉴别的知识点。
A.过氧化钠和硫黄:加水,振荡过氧化钠
B.水晶和玻璃:X射线衍射实验水晶是晶体,具有特定的晶体结构,而玻璃是非晶态固体,没有晶体结构。X射线衍射实验可以检测物质的晶体结构,因此可以区分水晶和玻璃。
C.氯化钠和氯化钾:焰色试验氯化钠和氯化钾在火焰中产生的颜色不同。氯化钠在火焰中产生黄色火焰,而氯化钾在火焰中产生紫色火焰。因此,焰色试验可以区分氯化钠和氯化钾。
D.苯和甲苯:滴加溴水,振荡苯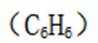
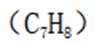
青少年帮厨既可培养劳动习惯,也能将化学知识应用于实践。下列有关解释合理的是
正确答案
解析
本题考查化学常识。分析歌个选项:
A.清洗铁锅后及时擦干,能减缓铁锅因发生吸氧腐蚀而生锈。铁在潮湿空气中会发生吸氧腐蚀,形成铁锈。如果清洗后及时擦干,可以减少铁锅与空气的接触,从而减缓生锈的过程。因此,选项A是合理的。
B.烹煮食物的后期加入食盐,能避免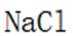
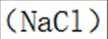
C.将白糖熬制成焦糖汁,利用蔗糖高温下充分炭化为食物增色。蔗糖在高温下会发生脱水反应,生成焦糖,从而使食物颜色加深。但是并不是碳化反应,焦糖呈深棕色,一旦焦糖化完成,立即停止加热,否则会继续碳化分解变黑。
D.制作面点时加入食用纯碱,利用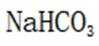
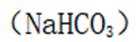
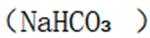
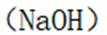
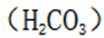
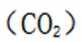
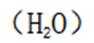
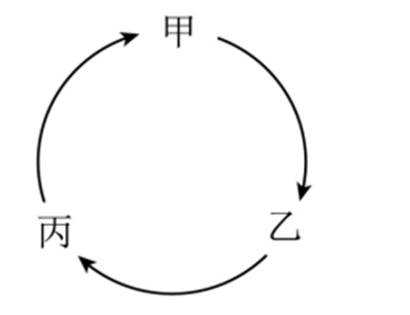
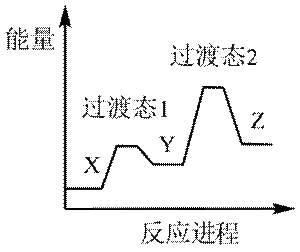
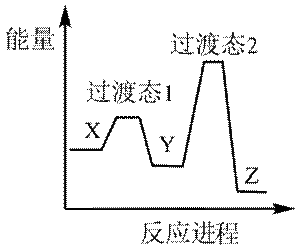
下列选项中的物质能按图示路径在自然界中转化。且甲和水可以直接生成乙的是
正确答案
解析
本题考查化学物纸转化反应式的知识点。
观察图,甲乙丙两两可以在自然界互相转化,由此排除B、C。又甲和水反应生成乙,考虑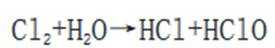
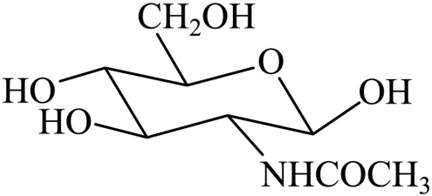
D-乙酰氨基葡萄糖(结构简式如下)是一种天然存在的特殊单糖。下列有关该物质说法正确的是
正确答案
解析
本题考查有机物结构式。
根据结构简式,其化学分子式为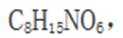
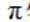
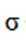
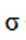
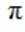
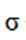
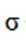
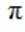
故选B
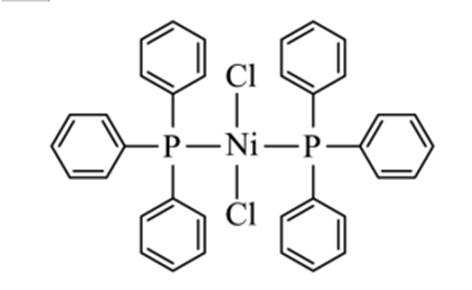
某催化剂结构简式如图所示。下列说法错误的是
正确答案
解析
本题考查Ni催化剂轨道杂化的知识点。分析各个选项:
A.该物质中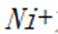
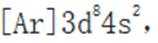
B.基态原子的第一电离能: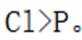
C.该物质中C和P均采取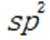
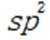
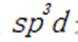
D.基态Ni原子价电子排布式为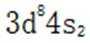
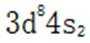
故选C.
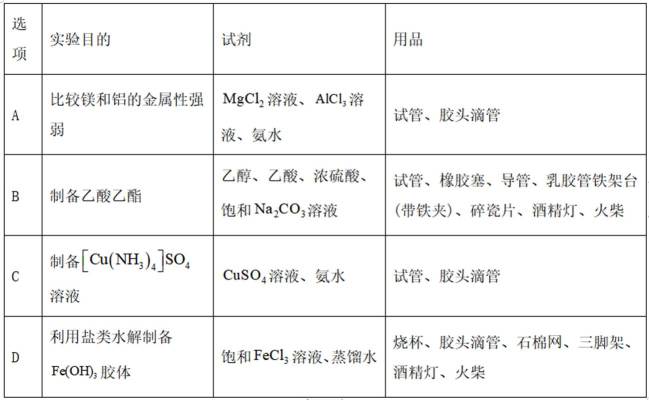
仅用下表提供的试剂和用品,不能实现相应实验目的的是
正确答案
解析
本题考查常规溶液化学反应的知识点。
要求选择不能达到实验目的的选项。
A因为氨水是碱性的,向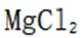
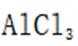
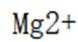
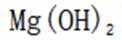
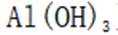
B由在浓硫酸的催化作用下,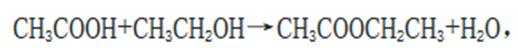
C由硫酸铜溶液和氨水制备铜氨络合物的化学反应式如下: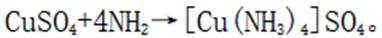
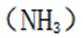
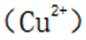
D氯化铁水解制备氢氧化铁的化学方程式如下: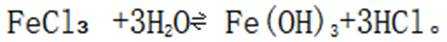
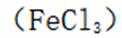
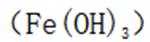
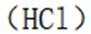
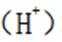
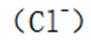
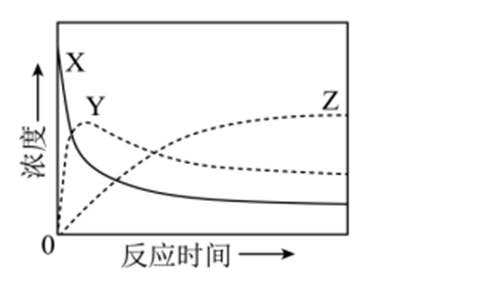
某温度下,在密闭容器中充入一定量的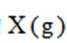
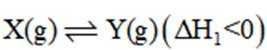
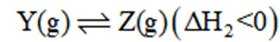
正确答案
解析
本题考查化学反应平衡的知识点。
考虑公式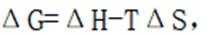
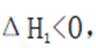
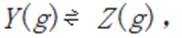
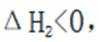
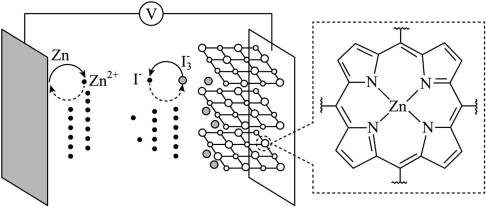
我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以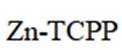
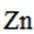
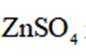
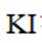
正确答案
解析
本题考查电池化学原理的知识点。逐一分析各项:
A.标注框内所示结构中存在共价键和配位键。观察
B.电池总反应为: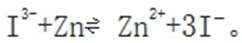
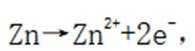
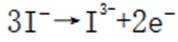
C.充电时,阴极被还原的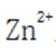
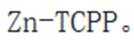
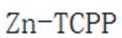
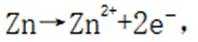
D.放电时,消耗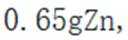
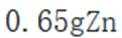
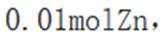
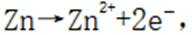
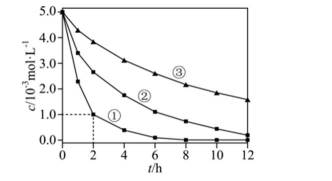
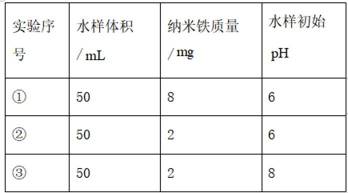
室温下,为探究纳米铁去除水样中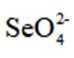
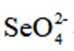
下列说法正确的是
正确答案
解析
本题考查化学反应平衡速率的知识点。分析各个选项:
A选项错误,因为从图中可以看出,实验①中0~2小时内平均反应速率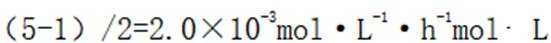
B选项错误,因为根据图片信息实验③PH=8为碱性,必然反应的离子方程式不能有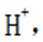
C选项正确,因为从表格中可以看出,实验②和实验①的其他条件相同,实验①的纳米铁质量较大结果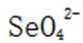
D选项错误,因为从表格中可以看出,实验②和实验③的其他条件相同,但实验②的水样初始pH较小,③的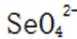
环境保护工程师研究利用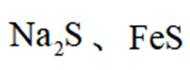
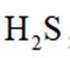
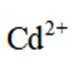
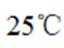
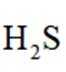
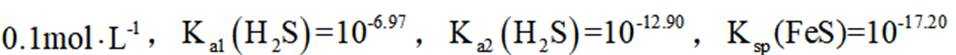
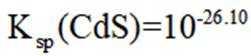
正确答案
解析
本题考查溶液中的化学平衡知识点。逐个分析每个选项的正确性:
A.这个说法是正确的。在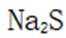
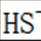
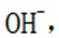
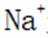
B.这个说法是错误的。硫化钠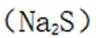
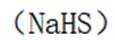
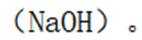
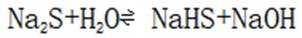
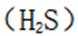
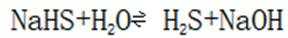
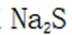
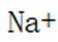
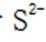
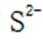
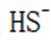
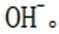
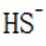
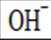
C.向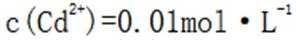
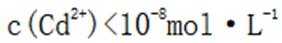
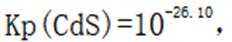
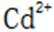
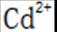
D.向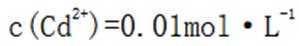
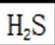
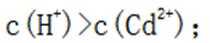
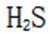
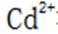
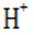
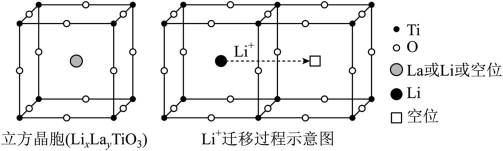
研究人员制备了一种具有锂离子通道的导电氧化物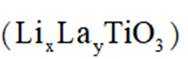
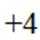
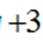
正确答案
解析
本题考查氧化物导电机制的知识点。分析各个选项:
A.导电时,Ti和La的价态不变在导电过程中,Ti和La的价态通常是稳定的,因为它们在导电氧化物中通常以+4和+3的价态存在。因此,选项A是正确的。
B在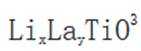
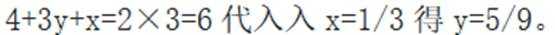
C.与体心最邻近的O原子数为12。在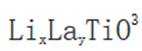
D.导电时,空位移动方向与电流方向相反在导电过程中,空位的移动方向通常与电流方向相反,因为空位是在电场作用下移动的,而电流的方向是由正电荷(如自由电子)的移动方向决定的。因此,选项D是正确的。故选B
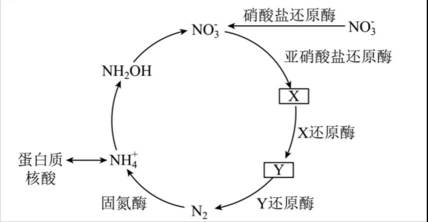
地球上的生物氮循环涉及多种含氮物质,转化关系之一如下图所示(X、Y均为氮氧化物),羟胺(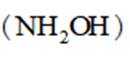
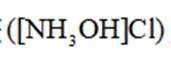
已知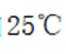
第一小题:
A.标准状况下,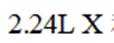
B.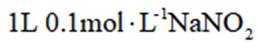
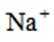
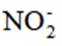
C.
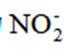
D.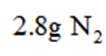
第二小题:下列有关物质结构或性质的比较中,正确的是
A.键角:
B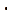
C.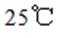
D.羟胺分子间氢键的强弱:
正确答案
第一小题正确答案
A
第二小题正确答案
D
解析
第一小题:本题考查生物氮循环。
考虑硝酸根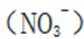
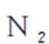
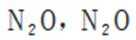

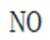
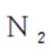
故X是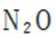
在标准状况下,1摩尔气体的体积是22.4L。因此,2.24L混合气体的物质的量是2.24L除以22.4L/mol,即0.1摩尔。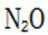
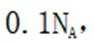
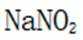
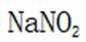
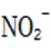
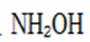
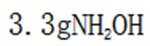
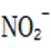
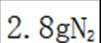
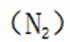
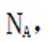
故选A.
第二小题:本题考查化学结构性质的比较。逐个分析各个选项:
A.键角:氨气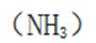
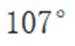
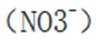
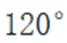
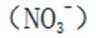
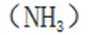
B.熔点: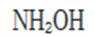
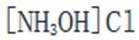
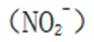
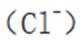
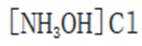
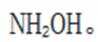
C.在相同浓度和温度下,氯化铵和氯化羟胺溶液的pH值都会低于7,但是图中箭头方向铵根离子可以制备羟胺,说明氯化铵溶液的pH值大于氯化羟胺溶液的pH值。所以选项C是错误的。
D.羟胺分子间氢键的强弱: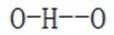
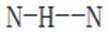
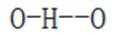
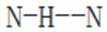
综上所述,正确答案是D。故选D
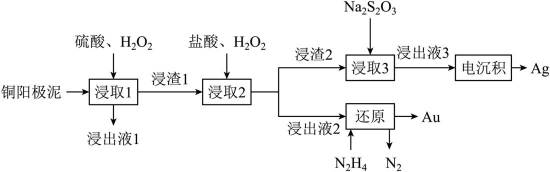
精炼铜产生的铜阳极泥富含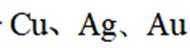
回答下列问题:
(1)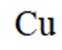
(2)“浸出液1”中含有的金属离子主要是_______。
(3)“浸取2”步骤中,单质金转化为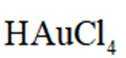
(4)“浸取3”步骤中,“浸渣2”中的_______(填化学式)转化为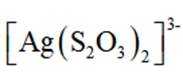
(5)“电沉积”步骤中阴极的电极反应式为_______。“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为_______(填化学式)。
(6)“还原”步骤中,被氧化的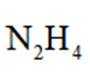
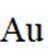
(7)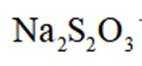
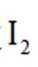
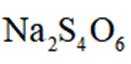
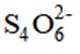
正确答案
(1)四;IB
(2)
(3)
(4)AgCl
(5)
(6)3:4
(7)(a)结构中电子云分布较均衡,结构较为稳定,(b)结构中正负电荷中心不重合,极性较大,较不稳定,且存在过氧根,过氧根的氧化性大于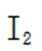
解析
(1)显然,铜(C)在元素周期表中位于第四周期第IB族。
(2)铜阳极泥含有Cu、Ag、Au等贵金属,第一步加硫酸和双氧水,只有Cu会与之发生反应,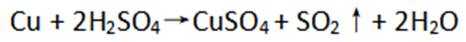
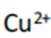
(3)注意配平化学方程式两边即可。金(Au)与盐酸(HCl)和双氧水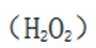
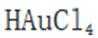
(4)注意浸液1已不含Cu离子,只有Ag和Au,通过浸取液2,Au变为可溶的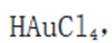
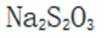
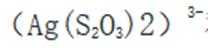
(5)由(4)知浸出液3含有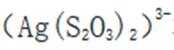
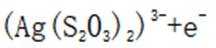
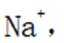
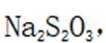
(6)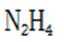
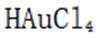
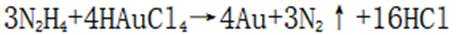
(7)在(a)分子中,电子云的分布呈现高度的对称性,因此分子结构具有较高的稳定性。由于分子(b)中正负电荷中心的不对称性,导致分子极性显著,稳定性较低。此外,((b)分子内存在过氧根离子,其氧化性较碘分子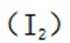
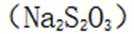
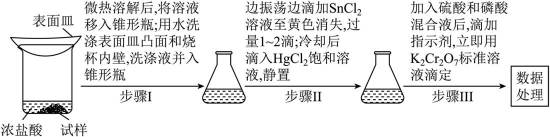
测定铁矿石中铁含量的传统方法是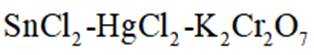
【配制溶液】
①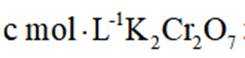
②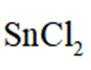
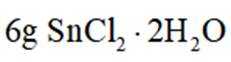
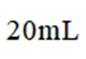
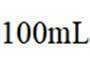
【测定含量】按下图所示(加热装置路去)操作步骤进行实验。
已知:氯化铁受热易升华;室温时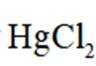
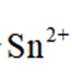
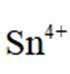
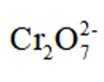
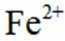
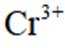
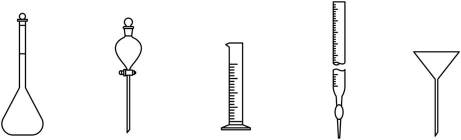
(1)下列仪器在本实验中必须用到的有_______(填名称)。
(2)结合离子方程式解释配制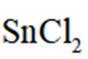
(3)步骤I中“微热”的原因是_______。
(4)步琛Ⅲ中,若未“立即滴定”,则会导致测定的铁含量_______(填“偏大”“偏小”或“不变”)。
(5)若消耗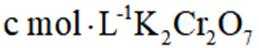
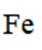
(6)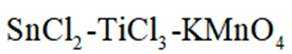
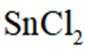
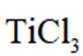
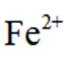
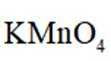
①从环保角度分析,该方法相比于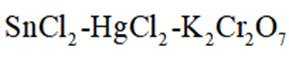
②为探究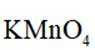
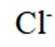
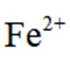
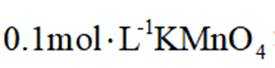
表中试剂X为_______;根据该实验可得出的结论是_______。
正确答案
(1)量筒、容量瓶
(2)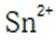
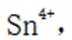
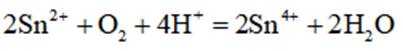
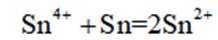
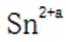
(3)增大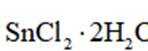
(4).偏小
(5)
(6)①.更安全,更环保对环境更友好②.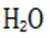
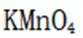
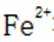
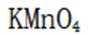
解析
(1)滴定实验必定需要容量瓶和量筒。
(2)在配置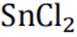
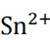
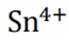
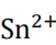
但是因为时溶于稀盐酸溶液,生成的氢氧根离子会与氢离子结合生成水,所以应为:
为了防止这种氧化反应的发生,通常会加入一些具有还原性的物质,如金属锡(Sn)粒。金
属锡可以提供电子,将已经被氧化的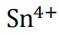
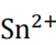
这样,加入Sn粒可以保持溶液中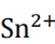
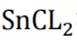
(3)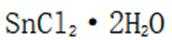
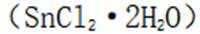
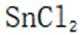
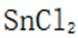
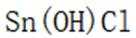
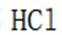
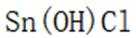
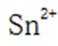
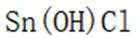
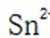
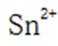
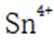
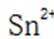
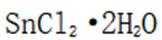
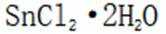
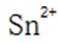
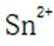
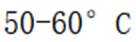
(4)传统的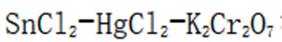
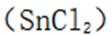
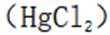
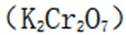
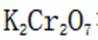
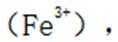
如果发生这种氧化,那么在滴定时,由于铁(Ⅲ)离子与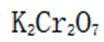
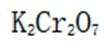
(5)重铬酸钾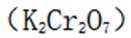
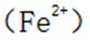
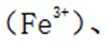
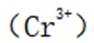
故考虑配平,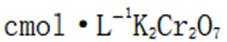
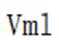
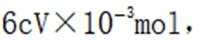
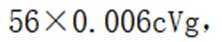
(6)③.酸性越强,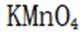
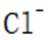
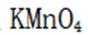
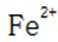
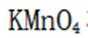
乙烯是一种用途广泛的有机化工原料。由乙烷制乙烯的研究备受关注。回答下列问题:
【乙烷制乙烯】
(1)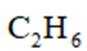
计算:
(2)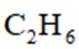
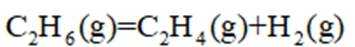
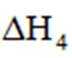

a.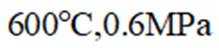
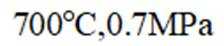
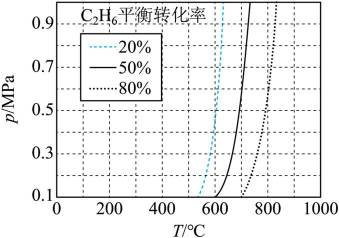
(3)一定温度和压强下、反应i
反应ⅱ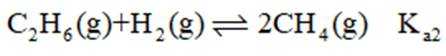
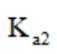
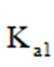
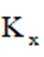
①仅发生反应i时。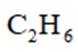
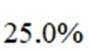
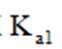
②同时发生反应i和ⅱ时。与仅发生反应i相比,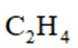
【乙烷和乙烯混合气的分离】
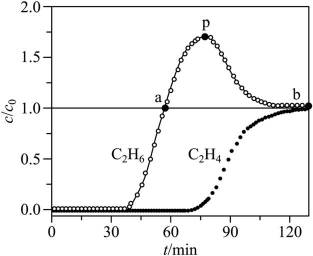
(4)通过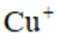
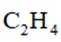
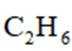
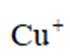
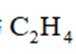
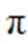
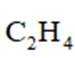
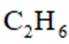
(5)常温常压下,将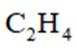
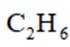
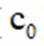
A.前30min,两种气体均未被吸附
B.p点对应的时刻,出口气体的主要成分是C2H4
C.a-b对应的时间段内,吸附的C2H6逐渐被C2H4替代
正确答案
(1)-566(2)>,b(3)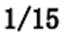
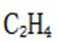
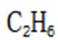
解析
(1)考虑设【式1】为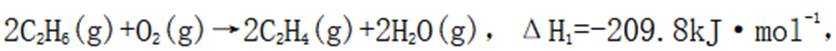
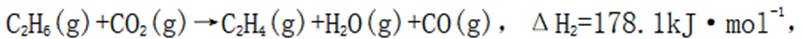
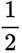
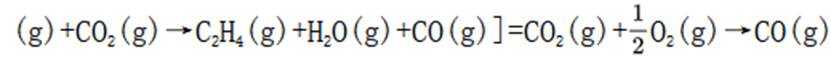
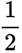
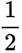
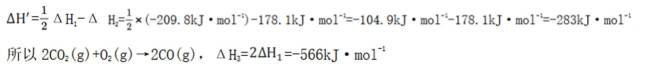
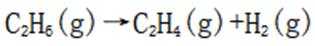
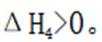
(3)(i)仅发生反应i时,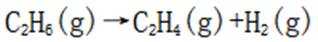
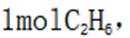
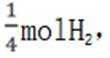
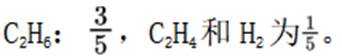
(ii)考虑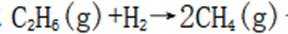
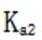
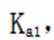
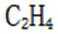
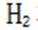
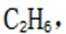
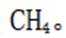
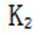
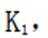
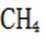
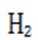
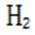
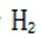
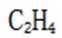
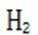
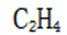
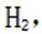
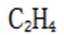
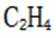
(4)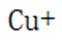
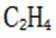
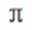
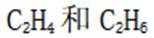
高选择性:Y分子筛的微孔结构允许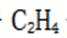
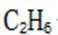
高纯度:由于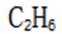
可再生性:分子筛在吸附过程中不会发生化学变化,因此可以通过降低压力或改变温度来脱附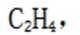
操作条件温和:吸附-脱附过程通常在室温或接近室温的条件下进行,不需要高温或高压,因此操作简便且能耗低。
综上所述,通过
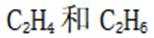

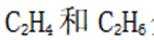
(5)逐个分析各个选项。
A.前30分钟,两种气体均未被吸附。因为图所示为两种气体出口浓度(c)与进口浓度(co)之比随时间变化关系,根据图表,前0分钟这个比值接近于0,代表两种气体都被吸附,所以A不正确。
B.p点对应的时刻,出口气体主要成分是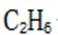
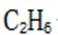
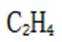
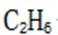
C.a-b对应的时间段内,吸附的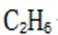
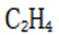
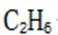
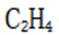
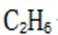
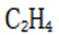
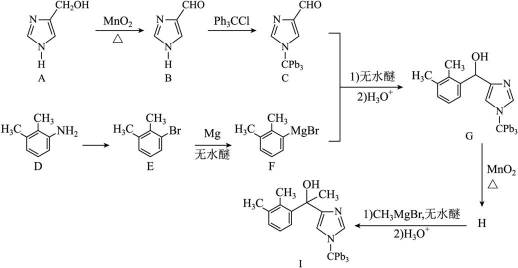
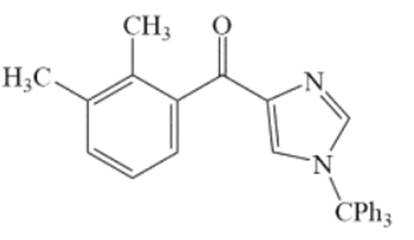
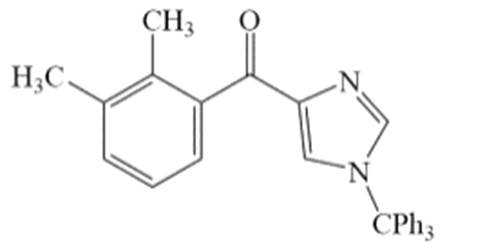
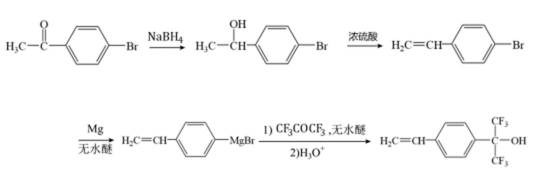
化合物1是一种药物中间体,可由下列路线合成(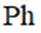
已知:
i)
ii)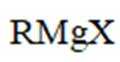
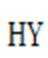
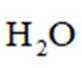
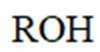
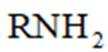
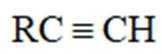
(1)A、B中含氧官能团名称分别为_______、_______。
(2)E在一定条件下还原得到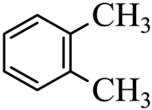
(3)H的结构简式为_______。
(4)E→F反应中、下列物质不能用作反应溶剂的是_______(填标号)。
a.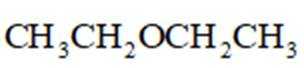
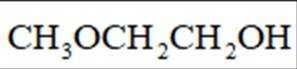
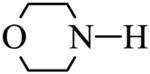
(5)D的同分异构体中,同时满足下列条件的有_______种(不考虑立体异构),写出其中一种同分异构体的结构简式_______。
①含有手性碳②含有2个碳碳三键③不含甲基
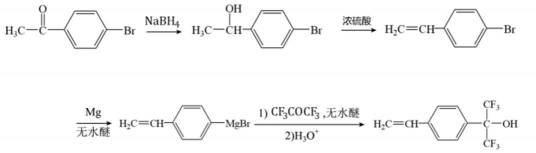
(6)参照上述合成路线,设计以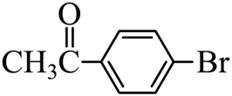
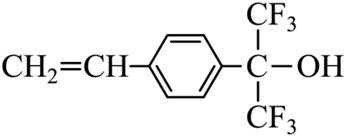
正确答案
(1)羟基醛基(2)1,2-二甲基苯
(3)
(4)bc(5)4𝐂
(6)
解析
(1)送分题。图中的A和B分别含有羟基(-OH)和醛基(-CHO)。醇基是由羟基(-OH)与烃基(R)连接而成,而醛基则是羰基(-CO)与烃基(R)连接而成。
(2)根据结构式及有机物命名法则,该物质为1,2-二甲基苯。该物质在苯环上连接了两个甲基,位于碳链的第1个和第2个碳原子上,因此其名称为为1,2-二甲基苯。
(3)
只需分析G→H,二氧化锰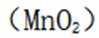
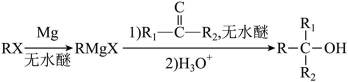
(4)由已知(ii),E→F生成的RMgX易与含活泼氢化合物HY反应,HY包括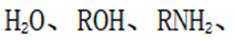
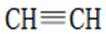
(5)首先,容易知道其化学式为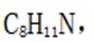
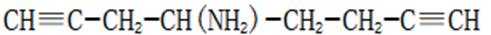
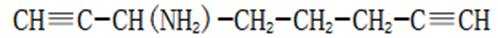
(6)利用已知的(i)、(ii),模仿该物质的合成路线,那么容易得出: