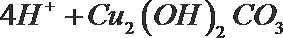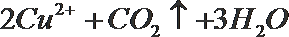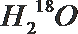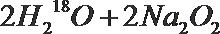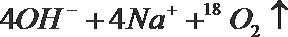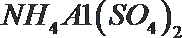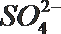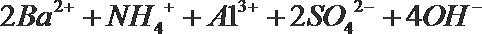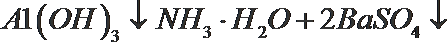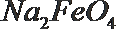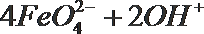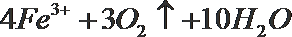- 真题试卷
- 模拟试卷
- 预测试卷
6.下列陈述I、II正确并且有因果关系的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列说法不正确的是( )
①将BaSO4放入水中其溶液不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列叙述中正确的是( )
①标准状况下,lL HCl和lL H2O的物质的量相同
②标准状况下,lg H2和14g N2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体的物质的量越大。则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列有关常见有机物说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.对下列化学用语的理解和描述均正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.下列有关物质的性质或应用说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.科学家发现了利用泪液检测糖尿病的方法,其原理是用氯金酸钠(NaAuCl4)溶液与泪液中的葡萄糖反应生成纳米金单质颗粒(直径为20~60nm)。下列有关说法中错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定。结合所学知识,判断下列反应中(反应条件略)正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
①CO、O2
②C12、CH4
③NO2、O2
④N2、H2
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.有如下装置.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.工业上消除氮氧化物的污染,可用如下反应:

在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.下列离子方程式不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.某溶液中可能含有
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列措施不合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
22.黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
将
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲装置的作用是___________________;鼓入空气的作用是______________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是__________________________ (用化学方程式表示)。
(3)该黄铁矿石中硫元素的质量分数为_______________________(列出表达式即可)。
【实验二】测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量______________ (填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=________________。
正确答案
(1)除去空气中的CO2,使装置乙中的溶液只吸收黄铁矿燃烧产生的SO2
提供反应物O2,排出装置中生成的SO2,使之完全被乙吸收。
(2)
(3)
(4)偏大
(5)250ml 容量瓶
(6)0.5000mol·L
解析
解析已在路上飞奔,马上就到!
知识点
21.化学是一门以实验为基础的学科,试回答以下问题。
(1)实验室中制取并收集少量氨气,可选用上述____________(填装置序号)装置,氨气应从收集装置的____________(填字母序号)导管进气。
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中盛满稀NaOH溶液,正确的连接顺序为___________________(用接口字母表示),装置乙的作用是____________,丙中产生NO的离子方程式为____________________________。
(3)二氧化氯(C1O2)是一种常用高效消毒剂,某研究小组利用丁装置制备C1O2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和K2SO4,则该反应中氧化产物与还原产物物质的量之比为_________;
②温度过高时,二氧化氯的水溶液有可能发生爆炸。在反应开始前将烧杯中的水加热到80%,然后停止加热,并使其保持在60℃~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是_______________________;
③将二氧化氯溶液加入到硫化氢溶液中,然后加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式________________。
正确答案
(1)甲、戊 e
(2)abce
利用碳酸钙与盐酸产生的CO2排尽装置中的空气
(3)①1:1
②温度计
③
解析
解析已在路上飞奔,马上就到!
知识点
23.对合成氨的研究具有很高的应用价值。
在三个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:

(1)下列能说明该反应已达到平衡状态的是___________(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t_________5min(填“>”、“<”或“=”)。
(3)乙中从反应开始到平衡时N2的化学反应速率为__________________。
(4)分析上表数据,下列关系正确的是_________(填字母序号)。
a.
b.
c.
(5)该温度下,反应的化学平衡常数K=______________(用分数表示)。
正确答案
(1)c
(2)>
(3)0.2 mol·L-1·min-1
(4)c
(5)
解析
解析已在路上飞奔,马上就到!
知识点
20.电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电—锂碘电池的材料。该电池反应如下:
则△H=_____________________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。请回答下列问题:
①直流电的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
正确答案
(1)
(2)①B
②
③不变 7.2
解析
解析已在路上飞奔,马上就到!
知识点
24.(1)常温下,已知0.1 mol·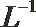
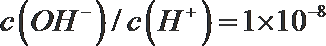
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mo·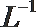
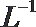
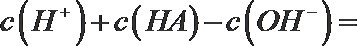
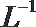
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·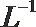
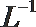
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
正确答案
(1)
①3 , HA+OH-=A-+H2O c(A-)>c(Na+)>c(H+)>c(OH-)
②0.05
(2)10-13
①12
② pHa+pHb=12
解析
解析已在路上飞奔,马上就到!
知识点
19.短周期元素X、Y、Z、W在周期表中的位置关系如图所示。已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置是____________________。
(2)X、Y、Z元素的氢化物均有两种或两种以上。
①液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为____________ ___________________________;
②在一定条件下X2H4与H2Z可发生反应,化学方程式为__________________________, 反应类型为_____________________________。
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为____________________________________________。
(4)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为_________________________________。
正确答案
(1)第二(或2)周期ⅣA 族
(2)①
②
(3)
(4)
解析
解析已在路上飞奔,马上就到!