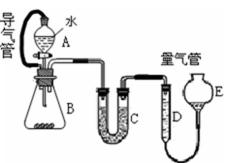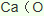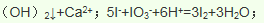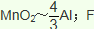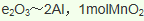- 真题试卷
- 模拟试卷
- 预测试卷
2.下列物质分类正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列离子方程式正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列分子或离子在指定的分散系中能大量共存的一组是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列解释事实的方程式不准确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。则下列判断不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.以NA表示阿伏伽德罗常数的数值,下列说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.随着科技的进步,研究和制备物质的手段和途径越来越多,C60、H3、O2+、N5+等已被发现。下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.下列实验中,所采取的分离方法与对应原理都正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰13,则x的值是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.氯气用途广泛,可用于生产半导体硅,生产的流程如下,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
21.学校附近的湖水中浮萍疯长,助长水质恶化。湖水水样中可能含有Fe3+、Ba2+、K+、H+、NO3-、Cl-、CO32-、SO42-离子。为了进一步确认,取样进行实验检测:
①取水样仔细观察,呈透明、均一状态。
②用pH试纸测定污水的pH,试纸显红色。
③向水样中滴入KSCN溶液,呈红色。
④向水样中滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(1)由此可知,该污水中肯定含有的离子是_______,肯定没有的离子是_______。
(2) 浮萍疯长的可能原因是水中含有较多的________离子。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.硫及其化合物在自然界普遍存在、容易转化。
Ⅰ.火山喷发、生物质降解时产生的有毒气体H2S、SO2等进入大气后,因一些自然转化而得以消除。如
(1)H2S和SO2分子碰撞时,污染会降低。反应方程式为________________________。
(2)H2S在常温下,会被空气逐渐氧化,反应方程式为_____________________________。
(3)SO2在飘尘催化下,会被空气氧化为SO3,遇水生成硫酸,硫酸遇石灰岩转化为稳定的石膏矿物(CaSO4·2H2O)。SO2被氧化的化学方程式为_________________________。
在环保措施上,这会给我们带来“师法自然”的启示。
Ⅱ.人为过度排放二氧化硫等,会超出自然净化吸收能力,带来严重环境污染。“石灰-石膏法”和“烧碱法”是工业上常用的工业烟气脱硫法。
(4)“石灰-石膏法”吸收二氧化硫的流程为:
由SO2等生成石膏的总化学方程式为____________________________________。
(5)“烧碱法”是用氢氧化钠浓溶液吸收含二氧化硫的烟气,其优点是氢氧化钠碱性强、吸收快、效率高。化学方程式为___________________________。但烧碱的价格较贵(石灰0.36元/kg,烧碱2.90元/kg)。
(6)若将“石灰-石膏法” 和“烧碱法”结合起来对烟气脱硫,则会产生快速高效低成本无污染的好效果,最终仍得到石膏产品。请在下列流程图的①~④处填写物质的化学式:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是__________(选填①游离态 ②化合态 ③不确定)
(2)以下变化属于化学变化的是______________________:
①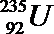
②重氢(2H)发生核聚变
③LiH做野外生氢剂
④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式______________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式_________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为__________________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_________________________。
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为______________。
正确答案
(1)氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中主要是以离子的形式存在,即是以化合态存在的,故答案为:②;
(2)LiH做野外生氢剂是有新物质生成的变化,属于化学变化,
 )发生核聚变、海水晒盐没有新物质生成,是物理变化,故答案为:③;
)发生核聚变、海水晒盐没有新物质生成,是物理变化,故答案为:③;(3)氯气具有氧化性,能将溴离子氧化为溴单质卤水制取液溴的离子方程式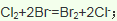
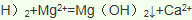
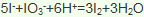
(4)金属钠是活泼金属,电解熔融的氯化钠可以制取金属钠:
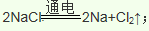
(5)质量比约为m(Mn):m(Fe)=55:448的合金钢中Mn元素和Fe元素的物质的量之比是1:8,根据原子守恒,投料MnO2、Fe2O3的物质的量之比是1:4,根据铝热反应实质,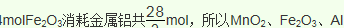
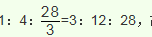
解析
解析已在路上飞奔,马上就到!
知识点
19.在金属冶炼和电子工业中,钙常作为空气的除气剂,以除去微量的氮氧。一化学兴趣小组对金属钙在空气中燃烧的产物做了以下探究实验。取一定量的钙在空气中加热,使其充分燃烧,燃烧时火焰呈砖红色,燃烧后得白色固体M。将M研细后称取 4.84g放入锥形瓶B中,滴加适量水使固体完全反应,通过右图测量生成的气体体积,进而推算白色固体的成分。
(1)用洁净铂丝蘸取CaCl2溶液在无色灯焰上灼烧,现象为___________。连接A和B的导气管的作用是__________________________,C中所加颗粒状固体是______________。
(2)量气管D、E中应加的液体是_____________。
A.水
B.四氯化碳
C.乙醇
D.盐酸
(3)实验中,B瓶壁发热。B中反应结束后,读取量气管中气体体积时,正确的操作为_________________。
(4)读取D中气体体积时,B、C中仍有少量产物气体,是否影响应该测得的气体体积____________________。
(5)若在D中得到气体 448mL(已换算为标况),该气体有刺激性气味、能够使湿润的红色石蕊试纸变蓝,则4.84g固体M中的成分(填化学式)及其质量为______________。
正确答案
(1)火焰呈砖红色;便于分液漏斗中的水顺利滴下来,提高氨气体积的测量精度;碱石灰。
(2)B
(3)冷至室温,D和E中液面相平,平视读数(答出两点即可)
(4)不影响
(5)
解析
解析已在路上飞奔,马上就到!
知识点
20. X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的最高正价与最低负价的代数和为2,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为______ 、_______、______。
(2)选用以上元素组成一种离子化合物,该化合物为___________________。
(3)X和Y组成的化合物Q中,既含有极性共价键又含有非极性共价键,Q的分子式是_______。Q在空气中点燃时,迅速而安全的燃烧,其反应产物没有任何污染,燃烧时的化学方程式为__________________________;Q还可将酸性工业废水中的Cr2O72- 还原为Cr3+,氧化产物为常见气体。相应的离子方程式为__________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
22.我校化学兴趣小组的学生对某品牌的消毒液的成分和性质进行实验探究:
①该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸);
②用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色;
③取适量消毒液,滴加稀硫酸后,有黄绿色气体生成;
④用洁净铂丝蘸取消毒液,在无色灯焰上灼烧,火焰呈黄色。
⑤取适量消毒液,通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。
请回答以下问题:
(1)该消毒液的主要成分是____________________________________。
(2)pH试纸颜色的变化说明消毒液溶液具有的性质是_____________________________。
(3)实验③中的离子方程式为_____________________________。
(4)实验⑤中,有“浅黄色沉淀”生成时的离子方程式为_______________________,又“澄清”时的离子方程式为______________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!