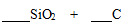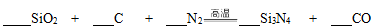- 真题试卷
- 模拟试卷
- 预测试卷
highway
正确答案
hilly
正确答案
his
正确答案
hit
正确答案
hobby
正确答案
hire
正确答案
hive
正确答案
homeland
正确答案
hometown
正确答案
homework
正确答案
holiday
正确答案
institution
正确答案
instruction
正确答案
insurance
正确答案
insure
正确答案
honey
正确答案
interpreter
正确答案
interrupt
正确答案
interval
正确答案
interview
正确答案
intend
正确答案
intention
正确答案
8.以下六种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③Na2SiO3 ④NaAlO2 ⑤Na2CO3 ⑥ NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.下列图示与对应的叙述相符的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。右图为RFC工作原理示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.按要求完成下列填空
Ⅰ.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) ΔH=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的ΔH=( )
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.υ正(
c.混合气体的平均相对分子质量不发生变化
d.
②在某温度下,反应物的起始浓度分别为:c(CO)= 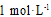
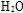

(3)熔融碳酸盐燃料电池的电解质为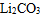
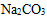
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: 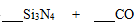
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30mol氮气,反应生成了5mol一氧化碳,则此时混合气体的平均摩尔质量是( )。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(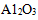
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
正确答案
Ⅰ.
(1)-2219.9 kJ/mol
(2)b d 0.5
(3)CO-2e_+CO32-=2CO2
Ⅱ.
(1)3 6 2 1 6
(2)28 g/mol
(3) AC
解析
解析已在路上飞奔,马上就到!
知识点
27.固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_____________;Ⅳ中发生反应的化学方程式为__________________________;
Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ——Ⅳ—II—Ⅴ——Ⅵ,此时Ⅱ 中
现象为______________________,原因是____________________________________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M,则A的化学式为
_______________________。
正确答案
(1)分液漏斗
(2)碱石灰; 3CuO+ 2NH3 3Cu +N2+3H2O; 浓H2SO4
(3)试纸变蓝,CuO与氨气反应生成的水和未反应的氨气形成氨水,使试纸变蓝
(4) Mg3N2
解析
解析已在路上飞奔,马上就到!
知识点
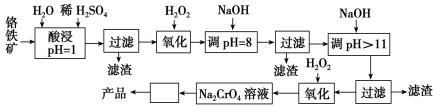
28.以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤不能省略,为什么?____________。
(4)流程图中“
正确答案
(1) 2Fe2++H2O2+2H+===2Fe3++2H2O
2CrO+3H2O2+2OH-===2CrO+4H2O
(2)Fe3+、Al3+ Mg2+
(3) Al(OH)3会溶解
(4)蒸发浓缩、冷却结晶
解析
解析已在路上飞奔,马上就到!
知识点
29.部分中学化学常见元素原子结构及性质如下表所示:
(1)A元素在周期表中的位置为_______________________________________。
(2)B与C形成的化合物的化学式为________,写出此化合物与水反应的化学方程式( )
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,请写出用电子式表示Y形成过程的式子______________________________________。
②F与C组成的两种化合物M和N所含的电子
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:
_________________________________________________________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写): ________________。
正确答案
(1)第四周期第Ⅷ族
(2)Mg3N2 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)
①
② 碱
(4)4NH3+3O2 
(5)Al-3e-+4OH-=AlO2-+2H2O
解析
解析已在路上飞奔,马上就到!
知识点
30.现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO、CO、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。



(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀

(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________。
正确答案
(1)K2CO3 Ba(OH)2
(2)B
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O ; 0.4mol
(4)2Fe3++2I- =2Fe2++I2
解析
解析已在路上飞奔,马上就到!