- 真题试卷
- 模拟试卷
- 预测试卷
6. 下列装置或操作不能达到实验目的的是( )
正确答案
解析
A.熟石灰和氯化铵反应生成氨气,氨气易溶于水,该装置可以防止倒吸,A正确;
B.如果负极跟所在烧杯的电解质发生反应那么就不是个原电池结构,无法形成电子的转移,铁可以与氯化铁溶液反应,因此不能形成原电池,B错误
C.关闭止水夹,从长颈漏斗加水,观察液面差高度在一段时间不变,可判断气密性良好,C正确;
D.实验室制备乙烯,用乙醇和浓硫酸迅速加热至170℃,D正确。
故选B。
考查方向
解题思路
A.熟石灰和氯化铵反应生成氨气,氨气易溶于水,该装置可以防止倒吸;
B.如果负极跟所在烧杯的电解质发生反应那么就不是个原电池结构,无法形成电子的转移,铁可以与氯化铁溶液反应,因此不能形成原电池;
C.关闭止水夹,从长颈漏斗加水,观察液面差高度在一段时间不变,可判断气密性良好;
D.实验室制备乙烯,用乙醇和浓硫酸迅速加热至170℃。
易错点
本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯及实验基本操作等,把握物质的性质、实验技能为解答的关键,侧重性质与实验的考查,注意实验的可行性、评价性分析,题目难度不大。
知识点
2.下列叙述正确的是( )
①装置甲可防止铁钉生锈 ②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
正确答案
解析
①在装置中,金属Fe做电解池的阳极,电极本身失电子,更易生锈,故①错误;
②高锰酸钾具有氧化性,可以将乙烯氧化为二氧化碳,带入了新的杂质二氧化碳,故②错误;
③氯化氢极易溶于水,挤压胶头滴管,则集气瓶中压强减小,所以气球鼓起来,可以使用该装置验证HCl气体在水中的溶解性,故③正确;
④乙酸乙酯可以用饱和碳酸钠来吸收,不能用氢氧化钠,乙酸乙酯在氢氧化钠中水解,故④错误;
⑤装置可以收集气体,当集气瓶来用,导管长进短出时,可以收集密度大于空气的气体,如:CO2、Cl2、HCl、NO2等气体,如果当洗气瓶,导管应长进短出,故⑤正确。
故选C。
考查方向
解题思路
①金属做电解池的阳极时,更易被腐蚀;
②高锰酸钾具有氧化性,可以将乙烯以及乙炔氧化为二氧化碳;
③氯化氢极易溶于水,根据大气压强原理来分析;
④乙酸乙酯可以用饱和碳酸钠来吸收;
⑤装置可以收集气体,当集气瓶来用,也可以当洗气瓶,但是要注意导管的连接情况。
易错点
本题考查较为综合,涉及化学原电池、物质的制备、性质以及气体收集等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大
知识点
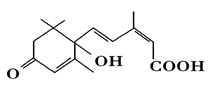
7.国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是
正确答案
解析
A.C能形成4个化学键,由结构可知分子式为C15H19O4,A错误;
B.连有4个不同基团的C原子为手性碳原子,则与-OH相连的C为手性碳原子,分子中含有1个手性碳原子,B错误;
C.含C=C,能发生加聚反应,含-OH、-COOH,能发生缩聚反应,C正确;
D.不存在酚-OH,则不能与FeCl3溶液发生显色反应,含C=C及-OH均能被酸性KMnO4氧化,能使酸性KMnO4溶液褪色,D错误;
故选C。
考查方向
解题思路
A.由结构可确定分子式,C能形成4个化学键;
B.连有4个不同基团的C原子为手性碳原子;
C.含C=C、-OH、-COOH,结合烯烃及酯化反应来分析;
D.不存在酚-OH,C=C及-OH均能被酸性KMnO4氧化
易错点
本题考查有机物的结构与性质,注意把握有机物的官能团与性质的关系来解答,手性碳原子的判断为解答的易错点,题目难度不大。
知识点
1.下列有关常见有机物说法正确的是 ( )
正确答案
解析
A.糖中单糖、低聚糖、油脂不是高分子化合物,多糖是高分子化合物,蛋白质是天然高分子化合物,A错误;
B.生石灰能和酸反应生成乙酸钙,乙醇和生石灰不反应,所以要除去乙醇中少量的乙酸,可以加入足量生石灰,蒸馏,B正确;
C.乙醇可以使酸性KMnO4溶液褪色,C错误。
D.甲烷可利用石油的分馏得到,石油裂化可得到乙烯,D错误。
故选B。
考查方向
解题思路
A.糖中单糖、低聚糖、油脂不是高分子化合物,多糖是高分子化合物,蛋白质是天然高分子化合物;
B.生石灰能和酸反应生成乙酸钙,乙醇和生石灰不反应,所以要除去乙醇中少量的乙酸,可以加入足量生石灰,蒸馏;
C.乙醇可以使酸性KMnO4溶液褪色。
D.甲烷可利用石油的分馏得到,石油裂化可得到乙烯。
易错点
本题考查有机物的结构与性质,为高考常见题型,涉及石油的裂化、除杂、蛋白质的性质、同系物判断等,把握常见的有机物的性质即可解答,题目难度不大。
知识点
4. 下列溶液中微粒浓度关系一定正确的是 ( )
正确答案
解析
A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+),A错误;
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-),B错误;
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S),C错误;
D.氢氧化钠与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+)+c(Na+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+)+c(Na+),D正确。
故选D。
考查方向
解题思路
A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+);
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-);
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S);
D.氢氧化钠与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+)+c(Na+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+)+c(Na+)。
易错点
本题考查离子浓度大小比较,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握盐类水解的特点,结合电荷守恒、物料守恒解答该题,难度中等。
知识点
3.有机物C4H8Cl2的结构中只含有一个甲基的同分异构体有几种(不考虑立体异构)( )
正确答案
解析
C4H8Cl2的同分异构体可以采取“定一移二”法
故选B。
考查方向
解题思路
二氯代物的同分异构体可以采用“定一移二”法解题,先找出所有的同分异构体,再找出只含一个“﹣CH3”的。
易错点
本题考查有机物的同分异构体的书写,难度不大,注意二氯代物的同分异构体可以采用“定一移二”法解题。
知识点
5.过量的下列溶液与水杨酸(
正确答案
解析
A.水杨酸与NaHCO3溶液反应时只是-COOH作用转化为-COONa,产物的分子式为C7H5O3Na,A正确;
B.水杨酸与Na2CO3溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2,B错误;
C.水杨酸与NaOH溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2,C错误;
D.与NaCl溶液不反应,D错误;
故选A。
考查方向
解题思路
A.水杨酸与NaHCO3溶液反应时只是-COOH作用转化为-COONa,产物的分子式为C7H5O3Na;
B.水杨酸与Na2CO3溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2;
C.水杨酸与NaOH溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2;
D.与NaCl溶液不反应;
易错点
本题考查有机物的结构和性质,题目难度不大,注意酚羟基、羧基与碳酸酸性的强弱比较,为解答该题的关键。
知识点
用含有Al2O3及少量Fe3O4和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定
10. Fe3O4与H2SO4反应的离子方程式是___________。
11.步骤I中过滤时用到的玻璃仪器是____________,得到的滤渣成分是________(填化学式)。
12.步骤II中增大n(Fe3+)的离子方程式是_________。
13.铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
正确答案
Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
解析
硫酸溶解四氧化三铁生成硫酸铁、硫酸亚铁和水,离子方程式:Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
考查方向
解题思路
硫酸溶解四氧化三铁生成硫酸铁、硫酸亚铁和水;
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
正确答案
普通漏斗、玻璃棒、烧杯 SiO2
解析
步骤I中过滤时用到的玻璃仪器是普通漏斗、玻璃棒、烧杯;Fe3O4 与硫酸反应生成铁离子、亚铁离子,Al2O3与硫酸反应生成铝离子,而SiO2不与硫酸发生反应,故过滤后的滤渣为SiO2;
考查方向
解题思路
步骤I中过滤时用到的玻璃仪器是普通漏斗、玻璃棒、烧杯;
Fe3O4 与硫酸反应生成铁离子、亚铁离子,Al2O3与硫酸反应生成铝离子,而SiO2不与硫酸发生反应;
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
正确答案
H2O2+2Fe2++2H+=2H2O+2Fe3+;
解析
FeSO4被双氧水在酸性溶液中氧化生成Fe3+,离子方程式是:H2O2+2Fe2++2H+=2H2O+2Fe3+;
考查方向
解题思路
FeSO4被双氧水在酸性溶液中氧化生成Fe3+;
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
正确答案
2Al-6e-+3H2O =Al2O3+6H+。
解析
以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,阳极Al失电子生成Al2O3,电极反应式2Al-6e-+3H2O =Al2O3+6H+。
考查方向
解题思路
(4).以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜。
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
近年来,碳和碳的化合物在生产生活实际中应用越来越广泛。
8.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。已知某反应的平衡常数表达式为:K=
9.甲醇是一种重要的化工原料,在日常生活中有着广泛的应用。工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
反应Ⅱ:CO2(g)+3H2(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因是_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
在“图甲”中,曲线______(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率 。
③对于反应Ⅱ,在一定温度时,将lmol CO2 和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产量的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
正确答案
C(S)+H2O(g)
解析
化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数的表达式可知,该反应的化学方程式是C(S)+H2O(g)
考查方向
解题思路
化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数的表达式可知,该反应的化学方程式是C(S)+H2O(g)
易错点
本题考查化学反应速率、化学平衡及影响因素,解题的关键是反应I符合“原子经济性”的原则即原子利用率为100%,难度中等。
正确答案
①反应I符合“原子经济性”的原则即原子利用率为100%,所以反应Ⅰ优于反应Ⅱ。
②b 放热 0.15mol/(L·min);
③
选bd。
解析
①根据反应I和反应Ⅱ的生成物可知,反应I中生成物只有一种,而反应Ⅱ中还有水生成,即反应I符合“原子经济性”的原则即原子利用率为100%,所以反应Ⅰ优于反应Ⅱ。
②根据图像甲可知,曲线b的活化能低于曲线a的活化能,所以曲线b表示使用了催化剂;同样根据图像甲可知,反应物的总能量高于生成物的总能量,所以反应是放热反应;根据图像乙可知,反应进行到10min是反应达到平衡状态,此时生成的甲醇浓度是0.75mol/L,则根据反应I可知,消耗氢气的浓度是1.5mol/L,所以氢气表示的反应速率是1.5mol/L÷10min=0.15mol/(L·min);
③ CO2(g)+3H2(g)
则根据压强之比是相应的物质的量之比可知
容器内的平衡压强与起始压强之比为
a.因正反应放热,升高温度可使平衡向逆反应方向移动,不能增加甲醇产率,故a不正确;
b.增加CO2的量,平衡向正反应方向移动,所以可以增加甲醇产率,故b正确;
c.充入He,使体系总压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,甲醇产率不变,故c错误;
d.按原比例再充入CO2和H2,压强增大,平衡向正反应方向移动,可以增加甲醇产率,故d正确。
考查方向
解题思路
①反应I符合“原子经济性”的原则即原子利用率为100%。
②根据图像甲可知,曲线b的活化能低于曲线a的活化能,所以曲线b表示使用了催化剂;
同样根据图像甲可知,反应物的总能量高于生成物的总能量,所以反应是放热反应;
根据图像乙可知,反应进行到10min是反应达到平衡状态,此时生成的甲醇浓度是0.75mol/L,则根据反应I可知,消耗氢气的浓度是1.5mol/L,所以氢气表示的反应速率是1.5mol/L÷10min=0.15mol/(L·min);
③ 根据压强之比是相应的物质的量之比可知;
a.因正反应放热,升高温度可使平衡向逆反应方向移动,不能增加甲醇产率;
b.增加CO2的量,平衡向正反应方向移动,所以可以增加甲醇产率;
c.充入He,使体系总压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,甲醇产率不变;
d.按原比例再充入CO2和H2,压强增大,平衡向正反应方向移动,可以增加甲醇产率。
易错点
本题考查化学反应速率、化学平衡及影响因素,解题的关键是反应I符合“原子经济性”的原则即原子利用率为100%,难度中等。
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH
反应物和产物的相关数据列表如下:
实验步骤如下:将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95。C,在E中收集90。C以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77。C馏分,产量2.0g。
回答下列问题:
14.实验中,能否将 Na2Cr2O7溶液加到浓硫酸中?____________(填“能”或“不能”)
说明理由________________________ 。
15.加入沸石的作用是____________。
16.分液漏斗使用前必须进行的操作是____________(填正确答案标号)。
a.润湿
b.干燥
c.检漏
d.标定
17.将正丁醛粗产品置于分液漏斗中分水时,水在____________层(填“上”或“下”
18.反应温度应保持在90—95。C,其原因是______________________________。
19.本实验中,正丁醛的产率为____________ %。
正确答案
不能 将Na2Cr2O7溶液加到浓硫酸中容易飞溅
解析
不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅。
考查方向
解题思路
不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅。
易错点
本题解题的关键是注意正丁醇的转化率就是正丁醛的产率。
正确答案
防止暴沸
解析
加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加。
考查方向
解题思路
加入沸石的作用是防止暴沸。
易错点
本题解题的关键是注意正丁醇的转化率就是正丁醛的产率。
正确答案
C
解析
分液漏斗使用前必须进行的一项操作是检漏,故选c;
考查方向
解题思路
分液漏斗使用前必须进行的一项操作是检漏;
易错点
本题解题的关键是注意正丁醇的转化率就是正丁醛的产率。
正确答案
下
解析
正丁醛密度为0.8017 g·cm-3,小于水的密度,水在下层;
考查方向
解题思路
正丁醛密度为0.8017 g·cm-3,小于水的密度;
易错点
本题解题的关键是注意正丁醇的转化率就是正丁醛的产率。
正确答案
既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
解析
根据题目所给反应物和产物的沸点数据可知,反应温度保持在90—95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
考查方向
解题思路
根据题目所给反应物和产物的沸点数据可知,反应温度保持在90—95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
易错点
本题解题的关键是注意正丁醇的转化率就是正丁醛的产率。
正确答案
51或51.4
解析
设正丁醛的产率为x %,根据关系式
C4H10O ——C4H8O
74 72
4x 2
解得:x=51或51.4
考查方向
解题思路
根据关系式C4H10O ——C4H8O进行计算。
易错点
本题解题的关键是注意正丁醇的转化率就是正丁醛的产率。
以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
20.写出反应Ⅰ的化学方程式_________________________________。
21.生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是__________________。
22.下列有关说法正确的是__________________。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应V中的副
23.反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是__________________。
24.(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式__________________。
正确答案
2CaCO3+2SO2+O2=2CaSO4+2
解析
碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
考查方向
解题思路
碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
防止亚硫酸铵被氧化
解析
对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
考查方向
解题思路
对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
acd
解析
a.过量的空气把亚硫酸钙氧化为硫酸钙,故a正确;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故b错误;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物,故c正确;
d、氯化铵含N元素,是一种氮肥,故d正确;
故答案为:acd;
考查方向
解题思路
a.过量的空气把亚硫酸钙氧化为硫酸钙;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物;
d、氯化铵含N元素,是一种氮肥;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
K2SO4在40%的乙二醇溶液中溶解度小,能充分析出
解析
反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
考查方向
解题思路
反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
4(NH4)2SO3+2NO2=4(NH4)2SO4+N2
解析
(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2,
故答案为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2。
考查方向
解题思路
(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气。
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。