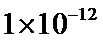- 真题试卷
- 模拟试卷
- 预测试卷
3.对于常温下pH=1的硝酸溶液,有关叙述: ()
① 该溶液1 mL稀释至100 mL后, pH=3
② 向该溶液中加入等体积、 pH=13的氢氧化钡溶液恰好完全中和
③ 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为
④ 向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
正确答案
解析
pH=1的硝酸溶液c(H+)=0.1mol/L,①据c=n/v计算;②pH=13的溶液c(OH-)=0.1mol/L;③根据Kw=c(H+)×c(OH-)=10-14计算;④氨水为弱电解质,不能完全电离,生成强酸弱碱盐.
考查方向
解题思路
pH=1的硝酸溶液c(H+)=0.1mol/L,①c=n/v=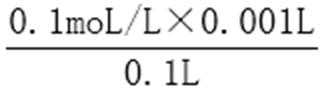
②pH=13的溶液c(OH-)=0.1mol/L,等体积混合恰好完全中和,故②正确;
③硝酸电离出的c(H+)=0.1mol/L,由Kw=c(H+)×c(OH-)=10-14可知,水电离出的c(H+)=10-13mol/L,该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1012,故③错误;
④氨水为弱电解质,不能完全电离,生成强酸弱碱盐,反应后溶液呈酸性,故④错误.
易错点
酸碱混合时的定性判断及有关ph的计算。
知识点
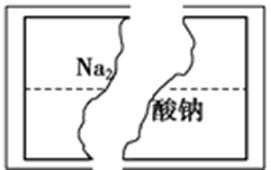
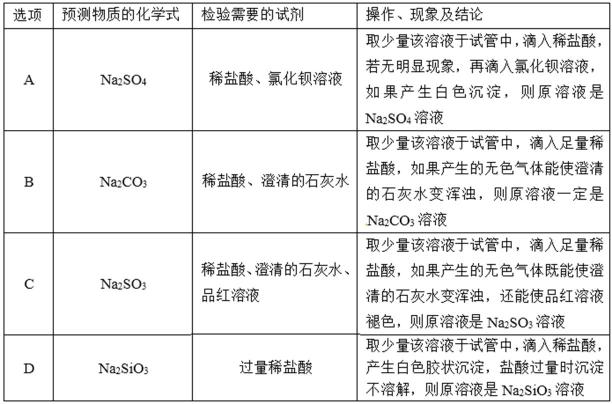
6.某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论) ()
正确答案
解析
A.取少量该溶液于试管中,滴入稀盐酸,盐酸可排除其它离子的干扰,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,沉淀为硫酸钡,则原溶液是Na2SO4溶液,故A正确;
B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫,则溶液可能为Na2CO3溶液,故B错误;
C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫,所以则原溶液是Na2SO3溶液,故C正确;
D.取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,硅酸不溶于盐酸,则原溶液是Na2SiO3溶液,故D正确。
考查方向
解题思路
A.盐酸可排除其它离子的干扰,再滴加氯化钡产生白色沉淀,则沉淀为硫酸钡;
B.无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫;
C.无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫;
D.硅酸不溶于盐酸.
易错点
离子的检验及气体的检验。
知识点
7.向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为()
正确答案
解析
由题意知反应后溶液中溶质只有Fe(NO3)2,n(HNO3)=0.12×4=0.48mol,由N守恒有2n[Fe(NO3)2]+n(NO)=n(HNO3)代入数据2n[Fe(NO3)2]+1.344/22.4=0.48,n(Fe)=n[Fe(NO3)2]=0.21mol;
考查方向
解题思路
由题意知反应后溶液中溶质只有Fe(NO3)2 ,由N守恒有2n[Fe(NO3)2]+n(NO)=n(HNO3);
易错点
最后kscn不变红,说明完全生成了硝酸铁。
知识点
1.分子式为C6H13Cl的有机物分子中,所含的甲基数不可能为()
正确答案
解析
C6H14的同分异构体有:CH3(CH2)4CH3、CH3CH2CH2CH(CH3)2、CH3CH2CH(CH3)CH2CH3、CH3CH2C(CH3)3、CH3CH(CH3)CH(CH3)CH3,则其一氯代物C6H13Cl可能含有1个甲基、2个甲基、3个甲基、4个甲基、不可能含有5个甲基。
考查方向
解题思路
书写C6H14的所有同分异构体体,然后再C6H1失去41个氢原子的烷烃同分异构体数量分析。
易错点
烷烃同分异构体的书写。
知识点
2.在实验室中从苯酚中分离出苯,可选用下列装置中的 ()
正确答案
解析
苯酚与碱反应,而苯不反应,则向混合液中加NaOH溶液反应后,分层,且苯在上层,利用分液来得到苯,所以选②装置;从苯酚中分离出苯,因二者混溶,但沸点不同,可利用蒸馏方法来分离,所以选①装置。
考查方向
解题思路
①蒸馏装置,②萃取、分液装置,③过滤装置,④蒸发装置
易错点
苯酚与碱反应,而苯不反应,加NaOH溶液反应后分层。
知识点
5.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是()
正确答案
解析
A.根据有机物的结构简式可判断有机物的分子式为C16H12O7;
B.由结构简式可知分子中含有2个苯环;
C.维生素P结构中含有两个苯环、一个碳碳双键、一个碳氧双键;酚羟基能与氢氧化钠反应,1mol维生素P结构中含有4mol酚羟基,所以1mol该物质可与4molNaOH反应,消耗H2最大量为8 mol,;
D.酚羟基的邻、对位上的氢原子均可被溴原子取代,需5molBr2.
考查方向
解题思路
由维生素P的结构可知酚羟基的邻、对位上的氢原子均可被溴原子取代;1mol维生素P中含有4mol酚羟基,故能与4molNaOH发生中和反应生成酚钠;其结构中只含有两个苯环,结合苯环的结构特点判断有机物的空间结构.
易错点
本题注意判断有机物的官能团的数目和种类,是影响有机物化学性质的决定因素,易错点为B,注意从苯和乙烯的空间结构出发分析。
知识点
生铁中含碳和硫等元素。化学兴趣小组
I.生铁中碳和硫元素的定性检验
8.将以下装置进行连接以完成实验(夹持仪器已略去,填接口字母代号)
a→( ) →( ) →( ) →( ) →( ) →( ) →( )
9.将样品研磨成粉末的目的是 。
10.确认样品中含有碳元素的现象是 。
II.生铁中碳、硫质量分数的测定
11.甲同学认为,以上装置可以粗略测定样品中碳的含量。称取样品m1g进行实验,充分反应后,测得C中生成的沉淀为m2g,该样品中碳的
12.乙同学认为,待一定量样品充分反应后,向E装置中加入过量氯化钡溶液,根据
沉淀质量可以计算样品中硫的质量分数,此方案是否合理? (填“是”或“否”);说
明理由____ 。
13.丙同学提议:为测定样品中硫的含量,可将c装置中试剂改为足量的30%双氧水,并按A→C→B→C装置连接进行实验,充分反应后,请你简述后续的实验方案 。
正确答案
h;i;b或c;c或b;f;g;e;
解析
分析装置图和试剂结合实验目的是生铁中碳和硫元素的定性检验,A装置是生成氧气的发生装置,气体中含有水蒸气,需要通过G装置干燥,通过B装置使生铁中的碳元素和硫元素变化为二氧化碳和二氧化硫气体,再通过DEF,分别检验二氧化硫的生成,除去二氧化硫检验二氧化硫是否除净,最后通过C装置检验生成的二氧化碳气体的存在。
考查方向
解题思路
分析装置图和试剂结合实验目的是生铁中碳和硫元素的定性检验,A装置是生成氧气的发生装置,气体中含有水蒸气,需要通过G装置干燥,通过B装置使生铁中的碳元素和硫元素变化为二氧化碳和二氧化硫气体,再通过DEF,分别检验二氧化硫的生成,除去二氧化硫检验二氧化硫是否除净,最后通过C装置检验生成的二氧化碳气体的存在。
易错点
物质探究组成的实验设计和实验分析判断,二氧化硫和二氧化碳的检验和性质。
正确答案
增大反应物接触面积,使反应更快更充分
解析
依据增大反应物的接触面积会增大化学反应速率分析判断。
考查方向
解题思路
依据增大反应物的接触面积会增大化学反应速率分析判断。
易错点
物质探究组成的实验设计和实验分析判断,二氧化硫和二氧化碳的检验和性质。
正确答案
F中品红不褪色,C装置中氢氧化钡溶液中出现白色沉淀
解析
分析装置的作用,需要先检验二氧化硫再除去二氧化硫后再检验二氧化碳的存在,反应现象应是F中品红不褪色,C装置中氢氧化钡溶液中出现白色沉淀。
考查方向
解题思路
分析装置的作用,需要先检验二氧化硫再除去二氧化硫后再检验二氧化碳的存在,反应现象应是F中品红不褪色,C装置中氢氧化钡溶液中出现白色沉淀。
易错点
物质探究组成的实验设计和实验分析判断,二氧化硫和二氧化碳的检验和性质。
正确答案

解析
二氧化碳和氢氧化钡溶液反应生成碳酸钡沉淀,依据碳元素守恒计算得到,称取样品m1g进行实验,充分反应后,测得C中生成的沉淀为m2g,沉淀为碳酸钡,物质的量=




考查方向
解题思路
二氧化碳和氢氧化钡溶液反应生成碳酸钡沉淀,依据碳元素守恒计算得到,称取样品m1g进行实验,充分反应后,测得C中生成的沉淀为m2g,沉淀为碳酸钡,物质的量=m/197mol,求出碳元素质量分数;装置中含有未被赶出二氧化碳。
易错点
物质探究组成的实验设计和实验分析判断,二氧化硫和二氧化碳的检验和性质。
正确答案
否;气体进入D装置时,部分二氧化硫被品红溶液吸收,部分被氧气氧化为SO42-
解析
依据二氧化硫具有还原性和漂白性,在装置中被氧气氧化,被D装置中品红吸收损耗,不能通过被高锰酸钾溶液氧化为硫酸的硫酸根测定硫元素含量,故答案为:否;气体进入D装置时,部分二氧化硫被品红溶液吸收,部分被氧气氧化为SO42-
考查方向
解题思路
依据二氧化硫具有还原性和漂白性,在装置中被氧气氧化,被品红吸收损耗,不能通过被高锰酸钾溶液氧化为硫酸的硫酸根测定硫元素含量。
易错点
物质探究组成的实验设计和实验分析判断,二氧化硫和二氧化碳的检验和性质。
正确答案
向C装置中加入足量的氯化钡溶液,并测定生成的白色沉淀的质量
解析
为测定样品中硫的含量,可将c装置中试剂改为足量的30%双氧水,并按A→G→B→C装置连接进
考查方向
解题思路
为测定样品中硫的含量,可将c装置中试剂改为足量的30%双氧水,并按A→G→B→C装置连接进行实验,利用过氧化氢氧化二氧化硫为硫酸,遇到氯化钡溶液发生反应生成硫酸钡沉淀,过滤称量沉淀质量计算得到。
易错点
物质探究组成的实验设计和实验分析判断,二氧化硫和二氧化碳的检验和性质。
臭氧是一种强氧化剂,常用于消毒、灭菌等。
20.已知O3与KI溶液反应的生成物中有两种单质是 和 。
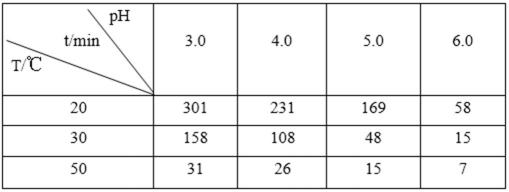
21.O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是___________.
②在30°C、pH=4.0条件下,O3的分解速率为__________ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号)
a. 40°C、pH=3.0
b. 10°C、pH=4.0
c. 30°C、pH=7.0
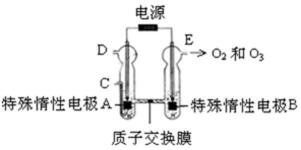
22. O3 可由臭氧发生器(原理如下图)电解稀硫酸制得。
①图中阴极为_____(填“A”或“B”),其电极反应式为 。
②若C处通入O 2 ,则A极的电极反应式为 
正确答案
I 2 O 2
解析
O3与KI溶液反应生成的两种单质只能为O 2 、I 2 ,故答案为:O2 ;I2
考查方向
解题思路
O3与KI溶液反应生成的两种单质只能为O2、I2
易错点
对表中数据的分析和处理。
正确答案
①OH - ;②1.00×10 -4 ;③bac
解析
①pH增大,则OH - 浓度增大,pH增大能加速O 3 分解,表明对O 3 分解起催化作用的是OH -;
②v= 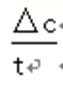
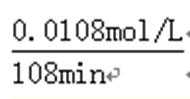
③由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231nin;
30°C、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c
考查方向
解题思路
①pH增大,则OH-浓度增大;
②根据v=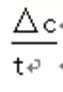
③根据pH和温度判断达到平衡所用的时间的范围,可判断分解速率.
易错点
对表中数据的分析和处理。
正确答案
①A;2H + +2e - =H 2↑
②O 2+4H ++4e - =2H 2O
解析
观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H + +2e - =H 2 ↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O 2 +4H + +4e - =2H 2O
考查方向
解题思路
观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H + +2e - =H 2 ↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O 2 +4H + +4e - =2H 2O
易错点
对表中数据的分析和处理。
PETG是一种新型材料,可回收利用,对环境不构成任何威胁,其结构简式如下:
已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
试回答下列问题:
23.上述各步反应中,属于取代反应的有__________(填写编号)。
24.写出结构简式:B__________________________、I_________________________。
25.写出化学方程式:
反应④ 、
反应⑤ 。
26.合成时应控制的单体的物质的量n (D)∶n (F)∶n (H)=______________(用m、n表示)。
27.写出同时符合下列要求的物质H的所有同分异构体的结构简式:①属于芳香族化合物且苯环上有两个取代基;②能与NaHCO3溶液反应,并有气体放出;③能发生水解反应。
_______________________________________。
正确答案
②③⑦
解析
由以上分析结合题给转化关系可知②③⑦属于取代反应,①④为加成反应,其他为氧化反应,故答案为:②③⑦
考查方向
解题思路
由以上分析结合题给转化关系可知②③⑦属于取代反应,①④为加成反应,其他为氧化反应,故答案为:②③⑦
易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案

解析
由以上分析可知B为


考查方向
解题思路
由PETG的结构简式可知对应的单体有HOCH2CH2OH、






易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案
解析
反应④的反应为

故答案为:
考查方向
解题思路
由PETG的结构简式可知对应的单体有HOCH2CH2OH、







易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案
m:n:(m+n)
解析
合成时应控制的单体的物质的量n (D):n (F):n (H)=m:n:(m+n),
故答案为:m:n:(m+n)
考查方向
解题思路
合成时应控制的单体的物质的量n (D):n (F):n (H)=m:n:(m+n),
故答案为:m:n:(m+n)
易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
正确答案
解析
H为


考查方向
解题思路
H为
易错点
1.根据高聚物的结构简式判断单体为解答该题的突破口。
2. 对于以框图题或变相框图题的形式出现考题,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。
从废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)中回收V2O5的一种生产工艺流程示意图如下:
回答下列问题:
14.①中废渣的主要成分是____。
15.②、③中的变化过程可简化为(下式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂
的主要成分):
Rn+(水层)+nHA(有机层)
②中萃取时必须加入适量碱,其原因是 。③中反萃取时加入的X试剂是 。
16.完成④中反应的离子方程式:ClO3-+ VO2++ H+= VO3++ Cl-+ ______
17.25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下:
根据上表数据判断,⑤中加入氨水,调节溶液pH最佳值为 ;若钒沉淀率为90%
时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Kap[Fe(OH)3]=2.6×10-29)
18.在整个工艺流程中,可以循环利用的物质是水、 和 。
19.写出废液Y中除H+之外的两种阳离子 。
正确答案
SiO2
解析
废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅,故答案为:SiO2
考查方向
解题思路
根据物质的水溶性确定,V2O5和SiO2难溶于水,亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,过滤得到滤渣为二氧化硅。
易错点
将工艺流程转化为物质的流程分析。
正确答案
加入碱中和产生的酸,平衡右移提高了钒的萃取率
硫酸
解析
②中萃取时必须加入适量碱,分析平衡,Rn+(水层)+nHA(有机层)=RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,故答案为:加入碱中和产生的酸,平衡右移提高了钒的萃取率;硫酸
考查方向
解题思路
根据Rn+(水层)+nHA(有机层)
易错点
将工艺流程转化为物质的流程分析。
正确答案
ClO3-+6VO2++6H+=6VO3++Cl-+3H2O
解析
依据氧化还原反应元素化合价变化和电子守恒原子守恒分析配平,ClO3-中氯元素化合价从+5价变化为-1价,得到电子6,VO2+变化为VO3+、元素化合价从+4价变化为+5价失电子1,依据电子守恒、原子守恒配平得到离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,故答案为:3H2O
考查方向
解题思路
依据氧化还原反应元素化合价变化和电子守恒原子守恒分析配平,ClO3-中氯元素化合价从+5价变化为-1价,得到电子6,VO2+变化为VO3+、元素化合价从+4价变化为+5价失电子1,依据电子守恒、原子守恒配平得到离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O。
易错点
电子守恒原子守恒配平。
正确答案
1.7 2.6×10-3
解析
从沉淀率和pH关系可知,随pH增大,沉淀率先增大后减小,故沉淀率最大的pH即为最佳pH,pH=1.7时钒的沉淀率最大为98.8%,加入氨水调节溶液的最佳pH为1.7,若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,此时溶液PH=2,计算氢氧根离子浓度c(OH-)=10-12mol/L,k[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)=
考查方向
解题思路
从沉淀率和pH关系可知,随pH增大,沉淀率先增大后减小,故沉淀率最大的pH即为最佳pH,pH=1.7时钒的沉淀率最大为98.8%,加入氨水调节溶液的最佳pH为1.7,若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,此时溶液PH=2,计算氢氧根离子浓度c(OH-)=10-12mol/L,k[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)=
易错点
计算错误
正确答案
有机萃取剂 氨水(或氨气)
解析
从流程图可知,③中有机萃取剂用于②中萃取,⑥中
考查方向
解题思路
从流程图可知,③中有机萃取剂用于②中萃取,⑥中
易错点
将工艺流程转化为物质的流程分析。
正确答案
F
解析
依据流程反应分析,加入的试剂在反应过程中生成的离子为,除H+之外的阳离子为Fe3+、VO22+、NH4+、K+,故答案为:F
考查方向
解题思路
依据流程反应分析,加入的试剂在反应过程中生成的离子为,除H+之外的阳离子为Fe3+、VO22+、NH4+、K+
易错点
将工艺流程转化为物质的流程分析。