- 真题试卷
- 模拟试卷
- 预测试卷
1.下列物质直接参与的反应与氧化还原反应无关的是
正确答案
解析
A.维生素C具有还原性,可以防止二价铁元素被氧化,用作贫血患者补铁剂的搭档,错误;
B.二氧化硫与生石灰结合生成亚硫酸钙,与氧化还原反应无关,正确;
C.三价铁离子有氧化性,可与金属铜反应,氯化铁溶液可用于腐蚀印刷电路板,错误;
D.高铁酸盐中铁元素化合价为+6价,具有强氧化性,所以可用于杀菌、消毒,错误;故选B。
考查方向
解题思路
A.维生素C具有还原性,可以防止二价铁元素被氧化;
B.二氧化硫与生石灰结合生成亚硫酸钙,与氧化还原反应无关;
C.三价铁离子有氧化性,可与金属铜反应;
D.高铁酸盐中铁元素化合价为+6价,具有强氧化性;
易错点
高铁酸盐中铁元素化合价为+6价,具有强氧化性;
知识点
2.下列说法正确的是
正确答案
解析
A.16O和17O含有相同的质子数,属于同位素,错误;
B.金属氧化物大都是碱性氧化物,七氧化二锰属于酸性氧化物,错误;
C.烟是固体颗粒,雾是小液滴,都可发生丁达尔现象,都属于胶体,正确;
D.合成纤维是有机高分子材料,光导纤维是无机非金属材料,错误;故选C。
考查方向
解题思路
A.16O和17O含有相同的质子数,属于同位素;
B.金属氧化物大都是碱性氧化物,七氧化二锰属于酸性氧化物;
C.烟是固体颗粒,雾是小液滴,都可发生丁达尔现象;
D.合成纤维是有机高分子材料;
易错点
烟和雾都是胶体。
知识点
3.下列关于有机物的叙述正确的是
正确答案
解析
A.单糖、二糖、油脂属于小分子化合物,相对分子质量小于10000,错误;
B.单质溴可以和乙烯发生加成反应,可以利用溴的四氯化碳溶液除去甲烷中的乙烯,正确;
C.煤中不含苯和甲苯,煤干馏后从煤焦油中能分离出来苯和甲苯,错误;
D.将苯滴入溴水中,振荡后水层接近无色是因为苯萃取了溴水中的溴单质,属于物理变化,错误;故选B。
考查方向
解题思路
A.单糖、二糖、油脂属于小分子化合物,相对分子质量小于10000;
B.单质溴可以和乙烯发生加成反应;
C.煤中不含苯和甲苯,煤干馏后从煤焦油中能分离出来苯和甲苯;
D.将苯滴入溴水中,振荡后水层接近无色是因为苯萃取了溴水中的溴单质,属于物理变化;
易错点
煤中不含苯和甲苯,煤干馏后从煤焦油中能分离出来苯和甲苯。
知识点
5.下列有关实验的叙述正确的是
正确答案
解析
A.过滤时,不可用玻璃棒搅拌漏斗中的液体,防止弄破滤纸,错误;
B.用湿润的pH试纸测溶液的pH,酸溶液测量值变大,碱溶液测量值变小,错误;
C.酸碱滴定管、容量瓶、分液漏斗是带有旋塞和瓶塞的仪器,使用前需要检查是否漏水,正确;
D.酸碱滴定实验中,用待滴定溶液润洗锥形瓶会使得标准液消耗过多,增大实验误差,错误;故选C。
考查方向
解题思路
A.过滤时,不可用玻璃棒搅拌漏斗中的液体,防止弄破滤纸;
B.用湿润的pH试纸测溶液的pH,酸溶液测量值变大,碱溶液测量值变小;
C.酸碱滴定管、容量瓶、分液漏斗是带有旋塞和瓶塞的仪器,使用前需要检查是否漏水;
D.酸碱滴定实验中,用待滴定溶液润洗锥形瓶会使得标准液消耗过多,增大实验误差;
易错点
酸碱滴定实验中,用待滴定溶液润洗锥形瓶会使得标准液消耗过多,增大实验误差;
知识点
6.下列反应中,反应后固体质量一定减少的是
正确答案
解析
A.水蒸气通过Na2O2固体生成氢氧化钠和氧气,2Na2O2+2H2O = 4NaOH+O2↑,固体质量增加,错误;
B.镁粉投入FeCl3溶液中,在FeCl3溶液中存在 FeCl3+3H2O
C.铝粉与Fe2O3发生铝热反应,Fe2O3+2Al=Al2O3+2Fe,固体质量不变,错误;
D.焦炭在电炉中还原二氧化硅,SiO2+2C
故选D。
考查方向
解题思路
A.2Na2O2+2H2O = 4NaOH+O2↑,固体质量增加;
B.镁粉投入FeCl3溶液中,在FeCl3溶液中存在 FeCl3+3H2O
C.铝粉与Fe2O3发生铝热反应,Fe2O3+2Al=Al2O3+2Fe,固体质量不变;
D.焦炭在电炉中还原二氧化硅,SiO2+2C
易错点
正确书写化学反应方程式。
知识点
7.NA为阿伏伽德罗常数的值。下列说法正确的是
正确答案
解析
A.一个丙烷分子含有10个共用电子对,标准状况下,2.24L丙烷中含有的共用电子对数为NA,正确;
B.盐酸和醋酸溶液的体积未知,所含H+数无法计算,错误;
C.利用双氧水制氧气,每生成1molO2转移电子数为2NA,错误;
D.浓盐酸降低时,与MnO2加热也不反应,生成C12分子数小于0.3 NA,错误;故选A。
考查方向
解题思路
A.一个丙烷分子含有10个共用电子对;
B.盐酸和醋酸溶液的体积未知,所含H+数无法计算;
C.利用双氧水制氧气,每生成1molO2转移电子数为2NA;
D.浓盐酸降低时,与MnO2加热也不反应;
易错点
浓盐酸降低时,与MnO2加热也不反应。
知识点
4.醇类物质中,具有“-CH2OH”结构的才能被氧化成相应的酸。分子式为C5Hl2O可被氧化成酸的醇共有
正确答案
解析
醇类物质中,具有“-CH2OH”结构的才能被氧化成相应的酸,分子式为C5Hl2O可被氧化成酸的醇:
故选A。
考查方向
解题思路
醇类物质中,具有“-CH2OH”结构的才能被氧化成相应的酸,分子式为C5Hl2O可被氧化成酸的醇;
易错点
分子式相同,结构不同的化合物互称为同分异构体。在中学阶段结构不同有以下三种情况:类别不同,碳链不同,位置不同(环上支链及官能团)。因此同分异构体书写的一般思路为:类别异构→碳链异构→位置异位。
知识点
8.X、Y、Z、W、M五种短周期元素,X、Y同周期,X、Z同主族,Y形成化合物种类最多,X2-、W3+具有相同的电子层结构,M为短周期主族元素中原子半径最大的元素。下列说法正确的是
正确答案
解析
X、Y、Z、W、M五种短周期元素,X、Y同周期,X、Z同主族,Y形成化合物种类最多,X2-、W3+具有相同的电子层结构,M为短周期主族元素中原子半径最大的元素。Y形成化合物种类最多,Y是碳元素;M为短周期主族元素中原子半径最大的元素,M是钠元素;X、Y同周期,X2-带两个单位负电荷,X是氧元素,Z是硫元素;;X2-、W3+具有相同的电子层结构,W是铝元素;即X-O、Y-C、Z-S、W-Al、M-Na;
A.同周期自左而右原子半径减小,电子层越多原子半径越大,原子半径大小顺序为W>Z>Y>X,错误;
B.W元素形成的可溶性盐溶液,可能是氯化铝或者偏铝酸钠,可能显酸性或者碱性,错误;
C.M、X形成离子化合物有氧化钠或者过氧化钠,过氧化钠中含离子键和共价键,错误;
D.W的最高价氧化物是氧化铝,Z的最高价氧化物的水化物是硫酸,M的最高价氧化物的水化物是氢氧化钠,氧化铝和硫酸、氢氧化钠均能反应,正确;故选D。
考查方向
解题思路
X、Y、Z、W、M五种短周期元素,X、Y同周期,X、Z同主族,Y形成化合物种类最多,X2-、W3+具有相同的电子层结构,M为短周期主族元素中原子半径最大的元素。Y形成化合物种类最多,Y是碳元素;M为短周期主族元素中原子半径最大的元素,M是钠元素;X、Y同周期,X2-带两个单位负电荷,X是氧元素,Z是硫元素;;X2-、W3+具有相同的电子层结构,W是铝元素;即X-O、Y-C、Z-S、W-Al、M-Na;
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.W元素形成的可溶性盐溶液,可能是氯化铝或者偏铝酸钠,可能显酸性或者碱性;
C.过氧化钠中含离子键和共价键;
D.氧化铝和硫酸、氢氧化钠均能反应;
易错点
过氧化钠中含离子键和共价键
知识点
9.下列各组离子在溶液中能大量共存,通入足量括号中气体后仍能大量共存的是
正确答案
解析
A.NH4+、Mg2+、SO42-、Cl-该组离子之间不反应,可大量共存,通入氨气生成氢氧化镁沉淀,错误;
B.Na+、Ba2+、Cl-、NO3- 该组离子之间不反应,可大量共存,通入二氧化硫仍不反应,能在硝酸的氧化作用下,生成硫酸钡白色沉淀,错误;
C.Na+、Ca2+、ClO-、NO3-该组离子之间不反应,可大量共存,通入氯化氢生成氯气,错误;
D.K+、Fe3+、NO3-、SO42-该组离子之间不反应,可大量共存,通入氯气仍不反应,能大量共存,正确;故选D。
考查方向
解题思路
A.NH4+、Mg2+、SO42-、Cl-该组离子之间不反应,可大量共存,通入氨气生成氢氧化镁沉淀;
B.Na+、Ba2+、Cl-、NO3- 该组离子之间不反应,可大量共存,通入二氧化硫仍不反应,能在硝酸的氧化作用下,生成硫酸钡白色沉淀;
C.Na+、Ca2+、ClO-、NO3-该组离子之间不反应,可大量共存,通入氯化氢生成氯气;
D.K+、Fe3+、NO3-、SO42-该组离子之间不反应,可大量共存,通入氯气仍不反应,能大量共存;
易错点
在酸性条件下,硝酸根离子有氧化性
知识点
10.下列实验装置正确且能达到实验目的的是
正确答案
解析
A.标准氢氧化钠溶液应该使用碱式滴定管,错误;
B.硫酸和碳酸钠反应生成二氧化碳,碳酸和硅酸钠反应生成硅酸,能验证H2SO4、H2CO3、H2SiO3酸性的强弱,正确;
C.实验室制备乙酸乙酯时反应温度不宜过高,要保持在60℃~70℃左右,应水浴加热,C错误;
D.比较碳酸钠和碳酸氢钠的热稳定性,碳酸钠放在大试管中,碳酸氢钠放在小试管中,D错误;故选B。
考查方向
解题思路
A.标准氢氧化钠溶液应该使用碱式滴定管;
B.硫酸和碳酸钠反应生成二氧化碳,碳酸和硅酸钠反应生成硅酸;
C.实验室制备乙酸乙酯时反应温度不宜过高,要保持在60℃~70℃左右,应水浴加热;
D.比较碳酸钠和碳酸氢钠的热稳定性,碳酸钠放在大试管中,碳酸氢钠放在小试管中;
易错点
实验室制备乙酸乙酯时反应温度不宜过高,要保持在60℃~70℃左右,应水浴加热
知识点
11.下列离子方程式正确的是
正确答案
解析
A.氯化铝溶液中加入过量氨水,生成氢氧化铝白色沉淀,沉淀不溶解,错误;
B.MgSO4溶液中加入Ba(OH)2溶液,生成硫酸钡白色沉淀、氢氧化镁白色沉淀,错误;
C.硫化钠溶液显碱性,主要发生一级水解,错误;
D.NaHCO3溶液加入少量Ca(OH)2溶液,会产生碳酸钙白色沉淀、碳酸根离子,正确;故选D。
考查方向
解题思路
A.氯化铝溶液中加入过量氨水,生成氢氧化铝白色沉淀,沉淀不溶解;
B.MgSO4溶液中加入Ba(OH)2溶液,生成硫酸钡白色沉淀、氢氧化镁白色沉淀;
C.硫化钠溶液显碱性,主要发生一级水解;
D.NaHCO3溶液加入少量Ca(OH)2溶液,会产生碳酸钙白色沉淀、碳酸根离子;
易错点
NaHCO3溶液加入少量Ca(OH)2溶液,会产生碳酸钙白色沉淀、碳酸根离子
知识点
12.下列说法正确的是
正确答案
解析
A.锡、铁和电解质溶液构成原电池,铁易失电子而作负极,锡作正极,作负极的金属加速被腐蚀,所以镀层不再对铁制品起保护作用,错误;
B.用铜作电极电解稀硫酸时,阳极:Cu-2e-=Cu2+,阴极:2H+ +2e-=H2↑,总反应Cu+H2SO4 
C.某原电池的电极材料分别为Mg和Al,若电解质溶液为氢氧化钠,则Mg做正极,错误;
D.某可逆反应升高温度,活化能大的方向,活化分子百分数增加更多,化学反应速率增大程度大,错误;故选B。
考查方向
解题思路
A.锡、铁和电解质溶液构成原电池,锡作正极,作负极的金属加速被腐蚀,所以镀层不再对铁制品起保护作用;
B.用铜作电极电解稀硫酸时,阳极:Cu-2e-=Cu2+,阴极:2H+ +2e-=H2↑;
C.Mg和Al,若电解质溶液为氢氧化钠,则Mg做正极;
D.某可逆反应升高温度,活化能大的方向,活化分子百分数增加更多,化学反应速率增大程度大;
易错点
某可逆反应升高温度,活化能大的方向,活化分子百分数增加更多,化学反应速率增大程度大
知识点
14.在恒温恒容的密闭容器中,充入4 mol气体A和2mol气体B发生反应:
3A(g)+2B(g) 
反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4。
则下列说法正确的是
正确答案
解析
在恒温恒容的密闭容器中,充入4 mol气体A和2mol气体B发生反应:3A(g)+2B(g) 
A.气体A的平衡转化率为30%,气体B平衡转化率为40%,气体A的平衡转化率小于气体B平衡转化率,错误;
B.反应前后体系压强之比为5:4,反应的正方向应该体积减小,平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数不变,错误;
C.反应前A、B物质的量之和为6mol,反应后A、B物质的量之和为4mol,反应前后体系压强之比为5:4,反应的正方向应该体积减小,根据克拉伯龙方程可知,D为气体,正确;
D.平衡后升高温度,若平衡向左移动,是放热反应,则正反应的△H<0,错误;
故选C。
考查方向
解题思路
在恒温恒容的密闭容器中,充入4 mol气体A和2mol气体B发生反应:3A(g)+2B(g) 
A.气体A的平衡转化率为30%,气体B平衡转化率为40%;
B.反应前后体系压强之比为5:4,反应的正方向应该体积减小;
C.反应前A、B物质的量之和为6mol,反应后A、B物质的量之和为4mol,反应前后体系压强之比为5:4,反应的正方向应该体积减小,根据克拉伯龙方程可知,D为气体;
D.平衡后升高温度,若平衡向左移动,是放热反应,则正反应的△H<0;
易错点
该题设计新颖,综合性强,对学生的思维能力要求高,学生不易得分。明确反应的特点,以及反应中的变量是答题的关键,有利于培养学生的逻辑推理能力和发散思维能力,有助于提升学生的学科素养。
知识点
15.常温下,用0.10 mol·L-1KOH溶液滴定10.00mL 0.10mol·L-1某二元弱酸H2R溶液,所得滴定曲线如图所示。下列叙述正确的是
正确答案
解析
A.a点所示溶液中c(H+)/c(OH-)=c(H+)/Kw=1014 c(H+)2,pH>1,c(H+)/c(OH-)<1012,正确;
B.点c时两溶液恰好完全反应生成了KHR,溶液显酸性,电离大于水解,因此c(K+)>c(HR-)>c(R2-)>c(H2R),错误;
C.点e所示的溶液中,溶质只有K2R,根据电荷守恒和物料守恒可知,c(H+)=c(OH-)-c(HR-)-2c(H2R),错误;
D.五个点中c点时c(HR-)最大,错误;故选A。
考查方向
解题思路
A.a点所示溶液中c(H+)/c(OH-)=c(H+)/Kw=1014 c(H+)2,pH>1,c(H+)/c(OH-)<1012;
B.点c时两溶液恰好完全反应生成了KHR,溶液显酸性,电离大于水解,因此c(K+)>c(HR-)>c(R2-)>c(H2R);
C.点e所示的溶液中,溶质只有K2R,根据电荷守恒和物料守恒可知,c(H+)=c(OH-)-c(HR-)-2c(H2R);
D.五个点中c点时c(HR-)最大,因为溶液的水解和电离程度都较小;
易错点
五个点中c点时c(HR-)最大,因为溶液的水解和电离程度都较小;
知识点
13.下列实验操作对应的结论正确的是
正确答案
解析
A.向NH4HSO4溶液中加入氢氧化钠溶液至中性,c(H+)=c(OH-),根据电荷守恒原理,c(NH4+)+c(Na+)=2c(SO42-),当NH4HSO4和NaOH按照1:1反应时,生成物显酸性,达到中性,应继续加入氢氧化钠,所以c(Na+)>c(SO42-)>c(NH4+),正确;
B.常温下,将金属铝插入浓硝酸,发生钝化,铝的表面生成致密的氧化层,反应不能继续,错误;
C.向鸡蛋清胶体溶液中加入浓的硫酸铵溶液,发生盐析沉淀,蛋白质未变性,错误;
D.某溶液含有相同浓度的Cl-和CrO42-,逐滴加入AgNO3,根据溶度积常数计算,最先沉淀的是氯离子,错误;故选A。
考查方向
解题思路
A.向NH4HSO4溶液中加入氢氧化钠溶液至中性,c(H+)=c(OH-),根据电荷守恒原理,c(NH4+)+c(Na+)=2c(SO42-),当NH4HSO4和NaOH按照1:1反应时,生成物显酸性,达到中性,应继续加入氢氧化钠,所以c(Na+)>c(SO42-)>c(NH4+);
B.常温下,将金属铝插入浓硝酸,发生钝化,铝的表面生成致密的氧化层,反应不能继续;
C.向鸡蛋清胶体溶液中加入浓的硫酸铵溶液,发生盐析沉淀,蛋白质未变性;
D.某溶液含有相同浓度的Cl-和CrO42-,逐滴加入AgNO3,根据溶度积常数计算,最先沉淀的是氯离子;
易错点
D中只有Cl-和CrO42-浓度极小的时候,才会出现CrO42-先沉淀,这个浓度没有意义。
知识点
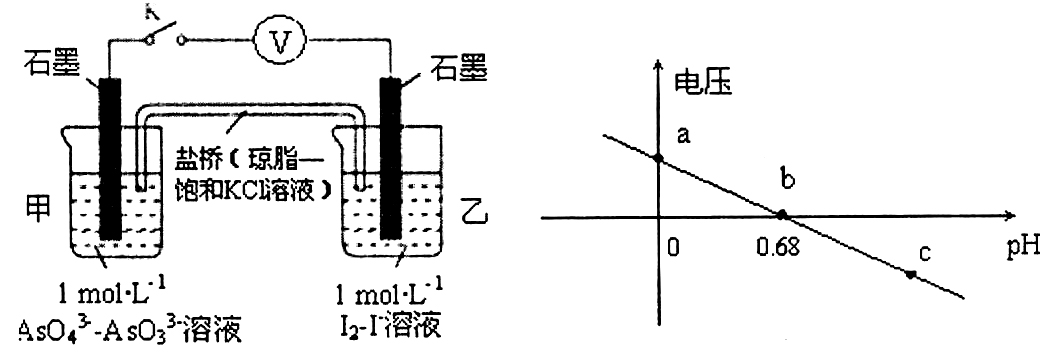
16.某实验小组依据反应AsO43-+2H++2I-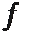
正确答案
解析
A.a点时,pH<0.68,反应向正方向进行,乙池石墨电极为负极,盐桥中K+向左移动,正确;
B.b点时,pH=0.68,电压为0,反应处于相对静止状态,即化学平衡状态,正确;
C.c点时,pH增大,即氢离子浓度减小,反应向逆方向进行,正极的电极反应为I2+2e-=2I-,错误;
D.pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,正确;故选C。
考查方向
解题思路
当pH=0.68时,电压为0,反应处于相对静止状态,即化学平衡状态;pH增大,即氢离子浓度减小,反应向逆方向进行;pH减小,即氢离子浓度增大,反应向正方向进行;
易错点
b点时,pH=0.68,电压为0,反应处于相对静止状态,即化学平衡状态
知识点
19.草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是_______________。
(2)加热到沸腾时发生反应的化学方程式为______________________。
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色, 同时有气体生成。已知反应中MnO4-转化为无色的Mn2+,则该过程中被氧化的元素是_________。若反应中消耗l mol FeC2O4·2H2O,则参加反应的n(KMnO4)=______。
(4)草酸亚铁晶体在氩气气氛中进行热分解,结果如下图所示(TG%表示残留固体质 量占原样品总质量的百分数),请回答下列问题:
①A→B发生反应的化学方程式为________________。
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是_______;释放第二种气体时的化学方程式为___________。
正确答案
(1)抑制Fe2+水解;
(2)(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4+(NH4)2SO4;
(3)铁、碳;0.6mol;
(4)①FeC2O4·2H2O

解析
(1)Fe2+易水解,配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是抑制Fe2+水解;
(2)加热到沸腾时,(NH4)2Fe(SO4)2和H2C2O4反应生成FeC2O4·2H2O、H2SO4、(NH4)2SO4;化学方程式为(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4+(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。说明亚铁离子被氧化成铁离子,同时生成了二氧化碳,,则该过程中被氧化的元素是铁、碳;若反应中消耗l mol FeC2O4·2H2O,失电子为3mol,则参加反应的n(KMnO4)=0.6mol;
(4)FeC2O4·2H2O相对分子质量为180,设FeC2O4·2H2O为1mol,第一步反应后减少36g,正好是2molH2O;第二步反应后,剩余质量为72g,是FeO;第二步生成气体72g,是一氧化碳和二氧化碳的混合气体,物质的量之比1:1;
①通过剩余固体的质量可知,过程Ⅰ发生的反应是草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4·2H2O
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是CO;释放第二种气体时的化学方程式为FeCO3
考查方向
解题思路
(1)Fe2+易水解,配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,需加少量硫酸,目的是抑制Fe2+水解;
(2)加热到沸腾时,(NH4)2Fe(SO4)2和H2C2O4反应生成FeC2O4·2H2O、H2SO4、(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。说明亚铁离子被氧化成铁离子,同时生成了二氧化碳,,则该过程中被氧化的元素是铁、碳;若反应中消耗l mol FeC2O4·2H2O,失电子为3mol,则参加反应的n(KMnO4)=0.6mol;
(4)FeC2O4·2H2O相对分子质量为180,设FeC2O4·2H2O为1mol,第一步反应后减少36g,正好是2molH2O;第二步反应后,剩余质量为72g,是FeO;第二步生成气体72g,是一氧化碳和二氧化碳的混合气体,物质的量之比1:1;
①通过剩余固体的质量可知,过程Ⅰ发生的反应是草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4·2H2O
②精确研究表明,B→C实际上是分两步进行的,每一步只释放一种气体,第二步释放的气体相对分子质量较第一步大,则第一步释放的气体的化学式是CO;释放第二种气体时的化学方程式为FeCO3
易错点
加热分解产物分析
知识点
17.硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体。硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣。
(1)实验室常用FeS固体与酸反应制取H2S。已知l0℃时,FeSO4· 7H2O的溶解度是20.5g,FeCl2·4H2O的溶解度是64.5g。从氧化还原反应、平衡移动和产品纯度等角度分析,实验室制取H2S时最好选用的酸是_____(填字母)。
a.浓硫酸
b.盐酸
c.稀硫酸
d.稀硝酸
实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置可选用的是______(填序号)。
(2)硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
已知四种盐的溶解度随温度变化的曲线如右图所示。请回答下列问题:
①检验加入铁粉过滤后的滤液中是否含有Fe3+的方法是__________。该滤液加入NH4HCO3发生反应的离子方程式是________________。
②(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为______、_____、洗涤、干燥等;反应的化学方程式为_______________。
③实验室煅烧FeCO3(s)的操作中需要的仪器除了三脚架、泥三角、酒精灯,还需要_________________________。
(3)FeS煅烧后生成的SO2通入下列装置:
该实验的目的是_______。若将SO2通入水中制成饱和溶液,请设计实验证明亚硫酸是弱电解质。实验方案__________。(提供的药品及仪器:蒸馏水、0.1 mol·L-1的NaOH溶液;pH计,其他仪器自选)
正确答案
(1)c;bc;
(2)①向过滤后的滤液中加入硫氰化钾(KSCN)若溶液变血红色,证明含有铁离子(Fe3+),否则无铁离子(Fe3+);2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
②蒸发结晶、热过滤;(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;
③玻璃棒、坩埚、坩埚钳;
(3)比较亚硫酸和碳酸的酸性强弱;
解析
(1)实验室常用FeS固体与酸反应制取H2S,浓硫酸和稀硝酸有强烈的氧化性,硫化氢有还原性,a、d不选,盐酸有挥发性,使得制得的硫化氢气体不纯净,且FeSO4· 7H2O的溶解度较小,有利于平衡正向移动,故选c;
实验室制取H2S时,属于固液不加热,发生装置bc;
(2)①检验加入铁粉过滤后的滤液中是否含有Fe3+的方法是:向过滤后的滤液中加入硫氰化钾(KSCN)若溶液变血红色,证明含有铁离子(Fe3+),否则无铁离子(Fe3+);该滤液加入NH4HCO3,反应生成碳酸亚铁、二氧化碳和水,发生反应的离子方程式是2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
②硫酸钾的溶解度相对其他几种物质较小,蒸发后首先结晶析出,因此(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为蒸发结晶,热过滤洗涤、干燥等;反应的化学方程式为(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;
③实验室煅烧FeCO3(s)的操作中需要的仪器除了三脚架、泥三角、酒精灯,还需要玻璃棒、坩埚、坩埚钳;
(3)该实验的目的是比较亚硫酸和碳酸的酸性强弱;若将SO2通入水中制成饱和溶液,请设计实验证明亚硫酸是弱电解质。实验方案__________。(提供的药品及仪器:蒸馏水、0.1 mol·L-1的NaOH溶液;pH计,其他仪器自选)
考查方向
解题思路
使学生对发生装置、收集装置、尾气处理装置的选择条件有个更好的理解,同时让学生掌握实验方案的设计。
易错点
实验方案的设计
知识点
18.氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用。
(1)希腊化学家提出采用高质子导电性的SCY陶瓷(能传递H+)为介质,利用右图所示实验装置,实现了高温常压下的电解法合成氨。则装置中B电极连接电源___极,A电极反应式为________________。
(2)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4)。写出上述反应的化学方程式_______________________。
(3)联氨用亚硝酸氧化生成另一种氮的氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式_____。该氢化物可置于安全气 囊,受撞击则完全分解为氮气和氢气,4.30g该氢化物受撞击后产生的气体在标准状况下的体积为_____L。
(4)联氨与盐酸反应生成重要的化工原料盐酸肼(N2H6C12),盐酸胼是易溶于水的强电解质,溶液呈酸性,水解原理与NH4Cl类似。请写出盐酸肼第一步水解反应的离子方程式___________________。下列盐酸肼溶液中的离子浓度关系正确的是_______(填序号)。
a.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
b.c(Cl-)>c(H+)>c([N2H5·H2O]+)>c(OH-)
c.c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-)
d.c(Cl-)=2c(N2H62+)+2c([N2H5·H2O]+)
正确答案
(1)正;6H++N2+6e-=2NH3;
(2)NH3+Cl2=NH2Cl+HCl、NH3+NH2Cl=N2H4+HCl;
(3)HN3;4.48L;
(4)N2H62++H2O
解析
(1)在电解池中,阳离子向阴极移动,H+由B电极向A电极运动,则装置中B电极连接电源正极,A电极反应式为 6H++N2+6e-=2NH3;
(2)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4)。化学方程式为NH3+Cl2=NH2Cl+HCl、NH3+NH2Cl=N2H4+HCl;
(3)联氨用亚硝酸氧化生成另一种氮的氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,分子中氮原子的个数(43.0×0.977)/14≈3,分子中氢原子的个数(43.0-42)=1计算确定该氢化物的分子式HN3;该氢化物可置于安全气囊,受撞击则完全分解为氮气和氢气,2HN3=3N2+H2,4.30g该氢化物为0.1mol,受撞击后产生的气体为0.15molN2和0.05molH2,在标准状况下的体积为4.48L;
(4)联氨与盐酸反应生成重要的化工原料盐酸肼(N2H6Cl2),盐酸胼是易溶于水的强电解质,溶液呈酸性,水解原理与NH4Cl类似。请写出盐酸肼第一步水解反应的离子方程式N2H62++H2O
b.盐酸肼(N2H6Cl2)属于离子化合物,完全电离,N2H62+、[N2H5·H2O]+水解(水解程度是很小的),溶液显酸性,c(Cl-)>c(H+)>c([N2H5·H2O]+)>c(OH-),因此b正确;
c.根据溶液中电荷守恒可知,2c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-),c错误;
d.根据溶液中物料守恒可知,c(Cl-)=2c(N2H62+)+2c([N2H5·H2O]+)+2c([N2H4·2H2O],d错误;
故选ab。
考查方向
解题思路
(1)在电解池中,阳离子向阴极移动;
(2)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4);
(3)联氨用亚硝酸氧化生成另一种氮的氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,分子中氮原子的个数(43.0×0.977)/14≈3,分子中氢原子的个数(43.0-42)=1计算确定该氢化物的分子式HN3;该氢化物可置于安全气囊,受撞击则完全分解为氮气和氢气,2HN3=3N2+H2,4.30g该氢化物为0.1mol,受撞击后产生的气体为0.15molN2和0.05molH2,在标准状况下的体积为4.48L;
(4)联氨与盐酸反应生成重要的化工原料盐酸肼(N2H6Cl2),盐酸胼是易溶于水的强电解质,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一步水解反应的离子方程式N2H62++H2O
b.盐酸肼(N2H6Cl2)属于离子化合物,完全电离,N2H62+、[N2H5·H2O]+水解(水解程度是很小的),溶液显酸性,c(Cl-)>c(H+)>c([N2H5·H2O]+)>c(OH-),因此b正确;
c.根据溶液中电荷守恒可知,2c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-),c错误;
d.根据溶液中物料守恒可知,c(Cl-)=2c(N2H62+)+2c([N2H5·H2O]+)+2c([N2H4·2H2O],d错误;
故选ab。
易错点
溶液中的电荷守恒和物料守恒
知识点
20.第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量。
(1)处理CO2的方法之一是使其与氢气反应合成甲醇。
①已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(1);
△H=-283.0KJ·mol-12CH3OH(l)+3O2(g)→2CO2(g)+4H2O(1);
△H=-726.0KJ·mol-1写出二氧化碳与氢气合成甲醇液体的热化学方程式___________________。
②右图是科学家现正研发的,以实现上述反应在常温常下合成甲醇的装置。写出甲槽的电极反应式___________。
(2)将CO2和CH4在一定条件下反应可制得工业合成气:CH4(g)+CO2(g)
①下列能说明该反应达到平衡状态的是_______。
a.CO2的浓度不再发生变化
b.v正(CH4)=2v逆(CO)
c.CO与H2的物质的量比为1:l
d.容器内的气体的平均相对分子质量不再发生变化
②据图可知,P1、P2、P3、P4由大到小的顺序为_________,理由是_____________
③用n和P4列式计算X点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4)。氨基甲酸铵 极易发生:H2NCOONH4+2H2O
正确答案
①3H2(g)+CO2(g)=CH3OH(l)+H2O
(1) △H=-61.5KJ·mol-1
②CO2(g)+6H+=CH3OH(l)+H2O;
(2)①ad;
②P4>P3>P2>P1;该反应是分子数增多的反应,因此相同温度下,压强越大,气体转化率越小;
③
(3)0.1 mol·L-1;4×10-9mol·L-1。
解析
①已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(1); △H=-283.0KJ·mol-1
①2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(1); △H=-726.0KJ·mol-1
②由盖斯定律可知,(3①-②)/2得:3H2(g)+CO2(g)=CH3OH(l)+H2O(1) △H=-61.5KJ·mol-1 ②CO2(g)+6H+=CH3OH(l)+H2O;
(2)①a.CO2的浓度不再发生变化,说明正逆反应速率相等,能说明该反应达到平衡状态;
b.v正(CH4)=1/2v正(CO),v正(CH4)=2v逆(CO),1/2v正(CO)=2v逆(CO),正(CO)=4v逆(CO),不能说明该反应达到平衡状态;
c.CO与H2的物质的量比为1:l ,不能说明正逆反应速率相等,不能说明该反应达到平衡状态;
d.容器内气体总质量不变,平均相对分子质量不再发生变化,则物质的量不变,该反应是分子数改变的反应,因此能说明该反应达到平衡状态;故选ad;
②该反应是分子数增多的反应,因此相同温度下,压强越大,气体转化率越小,据图可知,P4>P3>P2>P1;
③用n和P4列式计算X点的平衡常数
(3)氨基甲酸铵极易发生:H2NCOONH4+2H2O
考查方向
解题思路
(1)①已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(1); △H=-283.0KJ·mol-1
①2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(1); △H=-726.0KJ·mol-1
②由盖斯定律可知,(3①-②)/2得:3H2(g)+CO2(g)=CH3OH(l)+H2O(1)
△H=-61.5KJ·mol-1 ②CO2(g)+6H+=CH3OH(l)+H2O;
(2)①a.CO2的浓度不再发生变化,说明正逆反应速率相等,能说明该反应达到平衡状态;
b.v正(CH4)=1/2v正(CO),v正(CH4)=2v逆(CO),1/2v正(CO)=2v逆(CO),正(CO)=4v逆(CO),不能说明该反应达到平衡状态;
c.CO与H2的物质的量比为1:l ,不能说明正逆反应速率相等,不能说明该反应达到平衡状态;
d.容器内气体总质量不变,平均相对分子质量不再发生变化,则物质的量不变,该反应是分子数改变的反应,因此能说明该反应达到平衡状态;故选ad;
②该反应是分子数增多的反应,因此相同温度下,压强越大,气体转化率越小,据图可知,P4>P3>P2>P1;③用n和P4列式计算X点的平衡常数

(3)氨基甲酸铵极易发生:H2NCOONH4+2H2O
易错点
用气体分压表示化学平衡常数