- 真题试卷
- 模拟试卷
- 预测试卷
2.用NA表示阿伏加德罗常数的值,下列说法正确的是()
正确答案
解析
1molCl2参于反应,但在反应中Cl的化合价变化未指明,不一定从0升到+1,A错误。C最外层有4个电子,H最外层有1个电子,每2个价电子,形成一根共价键。1个C9H10中共价键数为:
考查方向
解题思路
注意反应中元素的变价、看清物质所处状态。
易错点
有关利用价电子数计算分子中共价健数目
知识点
3.某有机化合物M的结构简式为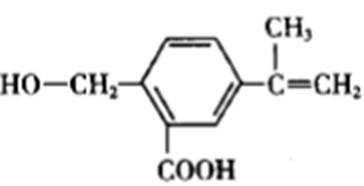
正确答案
解析
该有机物分子式为C11H12O3,A错误。该有机物官能团有碳碳双键、醇羟基、羧基。因含有羧基,故能与碳酸钠反应,每摩尔碳酸钠最多消耗2mol该有机物,B错误。有机物中能与醇、酸等发生酯化反应,因含有碳碳双键能与氢气发生加成反应(还原反应),也能被酸性高锰酸钾氧化,C正确。有机物分子中不含有醛基,故不能与新制氢氧化铜反应,D错误。
考查方向
解题思路
加强有机物结构、性质的知识加化
易错点
官能团性质把握不定
知识点
5.已知X、Y、Z、W都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,W的族序数比X的族序数大1,则下列说法错误的是()
正确答案
解析
由X原子的电子层数与它的核外电子总数相等推知为H。由Z原子的最外层电子数是次外层的3倍推知为O。Y和Z可以形成两种以上气态化合物则Y为N。再由它们的原子序数依次递增,W的族序数比X的族序数大1,得知W为Mg。N与O可形成N2O5质量比达到7:20,A正确。形成的NH4NO3中X、Y、Z元素原子个数比为4 :2 :3,故B正确。Mg3N2与H2O反应生成氢氧化镁与氨气二种碱性物质,C正确。形成的10电子微粒有H2O、NH4+、NH3、OH-等多种,D错误。
考查方向
解题思路
由原子核外电子排布信息进行推断,再结合选项逐一分析。
易错点
周期表结构不熟无法推断
知识点
6.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
正确答案
解析
电极甲通入的是N2H4在电池工作中发生氧化还原,是电池的负极,A错误。题目中讲明反应中生生物均为无毒无害的物质,不会产生有毒的NO,B错误。因为本电池是以固体氧化物为电解质的新型燃料电池,O2-可在该固体氧化物电解质中自由移动,正极反应为O2+4e-
考查方向
解题思路
由电池二极通入物质确定正负极,结合选项逐一分析。
易错点
原电池工作原理、电极反应书写
知识点
1.化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是()
正确答案
解析
形成丁达尔效应的微粒直径在1-100nm,微粒直径在2.5微米以下不一定在这范围内,所以A错误。高温下使病菌蛋白质发生变性,从而达到杀菌消毒的效果,B正确。聚乙烯中不含有毒元素,常用于食品包装袋,C正确。广泛使用含N、P的洗衣粉,会使水体富营养化,D正确。
考查方向
解题思路
逐一分析选项,对每一知识进行解读,找到对应的原因。
易错点
胶体的直径大小记忆不清,以及形成环境污染的原因模糊。
知识点
7.下列电解质溶液有关叙述正确的是
正确答案
解析
Ka是温度的函数,与浓度的大小无关,A错误。向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,溶解产生的OH-与NH4+结合,促进了Mg(OH)2的溶解,c(Mg2+)增大、c(OH-)减小,B错误。
在NaHCO3中存在:NaHCO3=Na++HCO3-与HCO3-+H2O




考查方向
解题思路
盐的水解抓大放小,弄清那一步是起决定作用。
易错点
离子浓度大小判断
知识点
4.下列实验现象与实验解释正确的是
正确答案
C
解析
分离碘的CCl4溶液,是利用CCl4沸点低、易挥发,A错误。KMnO4具有强氧化性,能氧化乙醇,葡萄糖为多羟基的醛也能被氧化,B错误。蔗糖与浓硫酸的反应中,使蔗糖脱水碳化、与脱水生成的C反应体现了其强氧化性,C正确。加入盐酸酸化的Ba(NO3)2因有H+与NO3- 构成了强氧化性环境,如原溶液中混有SO32-等也能被氧化成硫酸根离子,D错误。
考查方向
解题思路
理清实验操作中相关的反应,弄清原理。
易错点
实验原理把握不准,导致对实验现象无法解释。
知识点
能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)
请回答下列问题:
11.在“图1”中,曲线_______(填“a”或“b”)表示使用了催化剂;该反应属于_________(填“吸热”或“放热”)反应。
12.根据“图2”判断,下列说法不正确的是______________。
13.从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)
14.请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出p1、p2,且p1>p2)。
15.科学家常用量热剂来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2
(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式_______。
正确答案
b 放热
解析
使用催化剂能降低反应的活化能,因此b曲线表示使用了催化剂。因生成物的总能量低于反应物的总能量,故该反应为放热反应。
考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
等效平衡原理的运用
正确答案
解析
从图2分析可知CO的起始浓度是1mol.L-1,因为容器体积为2L,所以起始通入的CO为2mol,A错误。增加CO的浓度,提高了H2的转化率,而自身的转化率会降低,B错误。因为CO(g)+2H2(g)
考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
等效平衡原理的运用
正确答案
0.15mol/(L·min) 12 正反应方向
解析


计




考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
等效平衡原理的运用
正确答案
解析
从图1得知反应为放热反应,所以CH3OH%随温度升高而下降。从方程式可和,加大压强有利于反应正向移动,所以在其它条件相同时,压强越大,CH3OH%越大。
考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
等效平衡原理的运用
正确答案
CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H=-280.9KJ/mol
解析
①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,
②H2O(l)= H2O(g)△H=+44 kJ/mol,将①-2
CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H=-280.9KJ/mol
考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
等效平衡原理的运用
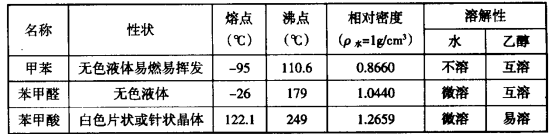
甲苯(
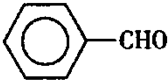
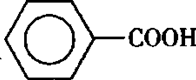
注:甲苯、苯甲醛、苯甲酸三者互溶。
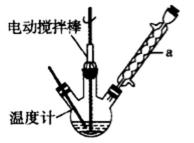
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和
2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧
化氢,在此温度下搅拌反应3小时。
16.装置a的名称是_________,主要作用是___________。
三颈瓶中发生反应的化学方程式为_________________,
此反应的原子利用率理论上可达______________。
17.经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________。
18.反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
19.实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯 甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加人盐酸调节pH=2
d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000moL/KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。下列情况会使测定结果偏低的是__________(填字母)。
a.滴定时俯视读取耗碱量
b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容
d.将酚酞指示剂换为甲基橙溶液
正确答案
球形冷凝管 冷凝回流,防止甲苯的挥发而降低产品产率
解析
因反应需持续加热,又为防有机物挥发,形球形冷凝管起冷凝回流,防止甲苯的挥发而降低产品产率。因为是用甲苯制苯甲醛,所以需用H2O2作氧化剂在催化剂作用下将其氧化,故化学方程式为: 
考查方向
有机化学实验与原理
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
正确答案
H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量
解析
因为H2O2热不稳定性,受热易发生分解,因此随温度升高时,分解率增大,产率随之降低。
考查方向
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
正确答案
过滤 蒸馏
解析
反应完毕后,反应体系中有除苯甲醛外还含有固体催化剂、醋酸、甲苯等,先进行过滤,再利用各组分的沸点不同,进行蒸馏分离。
考查方向
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
正确答案
①dacb ②87.84﹪ ad
解析
①将苯甲醛中混有的苯甲酸分离,可以先在混合体系中加入碳酸氢钠,将苯甲酸转化成可溶于水的盐,再进行分液,在水相中加入酸调节溶液PH重新制得苯甲酸,因苯甲酸在水中溶解度不大,大部分结晶析出,再过滤分离。
②滴定过程中苯甲酸与KOH按1:1反应:滴定过程中消耗n(KOH)=1.8

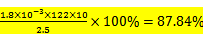
考查方向
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等。
其水溶液中存在平衡:



8.已知有关物质溶解度如图1。
用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入_________(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时,_____________,抽滤得到粗产品,再用重结晶法提纯粗产品。
9.以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2。
①不锈钢作________极,写出该电极的电极反应式________________________。
②分析阳极区能得到重铬酸钾溶液的原因________________________。
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为________________。
10.铬对环境能造成污染。某酸性废水中含有

①Na2S2O5参加反应的离子方程式为____________________。
②经上述工艺处理后的废水,理论上Cr3+浓度约为__________mg·L-1。
(已知室温下Ksp[Cr(OH)3]≈6×10-31)
正确答案
KCl 冷却结晶
解析
由有关物质的溶解度表可知,Na2Cr2O7溶液中加入KCl后会生成溶解度更小的K2Cr2O7,可利用这种方法制得K2Cr2O7。又因K2Cr2O7的溶解度受温度的影响很大,当有少量晶体析出时,便可停止加热,利用降温的方法使其从溶液中结晶析出。
考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
溶度积的计算及电极反应方程式的书写
正确答案
① 阴(1分) 2H2O+2e—=2OH—+H2↑
② 阳极OH—放电,溶液中H+浓度增大,使Cr2O72-+ H2O
正确答案
① 3S2O52—+2Cr2O72-+10H+=6SO42—+4Cr3++5H2O
② 3×10-8
解析
根据题意:利用

考查方向
解题思路
加强选修4核心知识的复习,对原理充分把握。
易错点
溶度积的计算及电极反应方程式的书写
化合物F是用于制备药品盐酸祛炎痛的中间产物,已知其合成路线如下:
Ⅰ.RNH2+



Ⅱ.苯的同系物易被高锰酸钾溶液氧化如下:
Ⅲ.苯胺具有弱碱性,易氧化。
回答下列问题:
20.写出反应①的反应物质和条件_____________,B中所含官能团的名称_____________,C的结构简式__________________。
21.D+E→F的化学方程式:______________。
22.E的一种同分异构体(对位氨基)在一定条件下,可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式__________________。
23.写出D的含有苯环的同分异构体,已知该核磁共振氢谱图有3种不同类型的氢原子,峰面积之比为3 :2 :2,则该物质是______________(写结构简式)。
24.反应①~⑤中,属于取代反应的是(填反应序号)________________,反应③的反应类型_____________。
正确答案
氯气和光照 硝基 结构简式
解析
由A→D的变化可知,是在侧链甲基上用Cl取代一个H原子,所以条件为氯气和光照,在Cl2与催化剂条件下,卤素取代苯环上的H。由A→B的条件可知,该反应是甲苯与混酸的反应,是硝化反应,引入一个硝基,由E的结构简式可知,-NO2应当引入在甲基的邻位,即B(


考查方向
解题思路
充分把握题干信息、通过转化时的反应条件、采用顺推与逆推相结合的方法。
易错点
信息处理不当导致推断失败,化学方程式的书写
正确答案
(2)
解析
D与E生成F的反应,参照信息I,实质是-NH2去H,-CH2Cl去Cl,二者发生取代反应生成HCl,方程式见答案。
考查方向
解题思路
充分把握题干信息、通过转化时的反应条件、采用顺推与逆推相结合的方法。
易错点
信息处理不当导致推断失败,化学方程式的书写
正确答案
解析
(3)E的此种同分异构体为: 
考查方向
解题思路
充分把握题干信息、通过转化时的反应条件、采用顺推与逆推相结合的方法。
易错点
信息处理不当导致推断失败,化学方程式的书写
正确答案
解析
因峰面积比为3:2:2,说明此D的同分异构体有三种氢由此推出结构为:
考查方向
解题思路
充分把握题干信息、通过转化时的反应条件、采用顺推与逆推相结合的方法。
易错点
信息处理不当导致推断失败,化学方程式的书写
正确答案
①②⑤ 氧化反应
解析
由上述分析可知:①②⑤为取代反应。③为氧化反应。④是还原反应。
考查方向
解题思路
充分把握题干信息、通过转化时的反应条件、采用顺推与逆推相结合的方法。
易错点
信息处理不当导致推断失败,化学方程式的书写