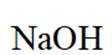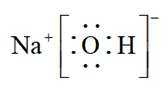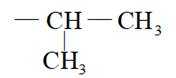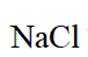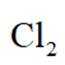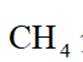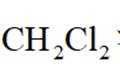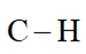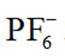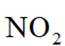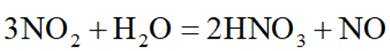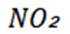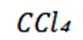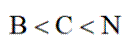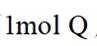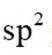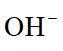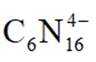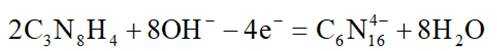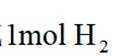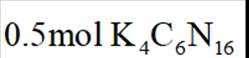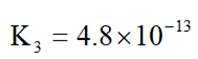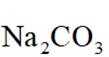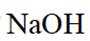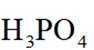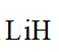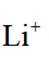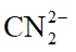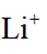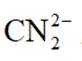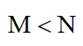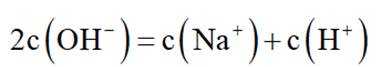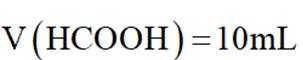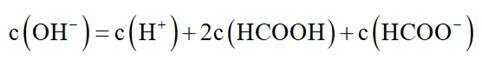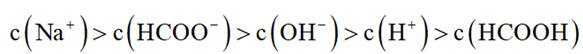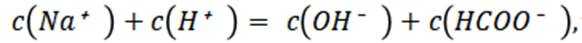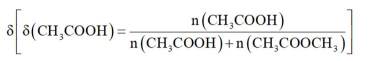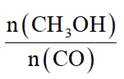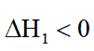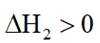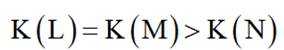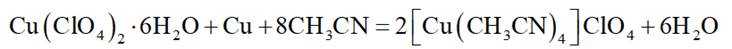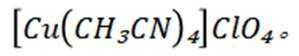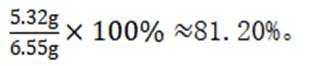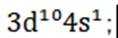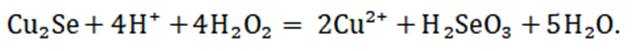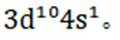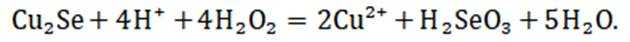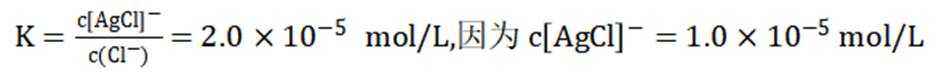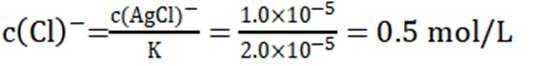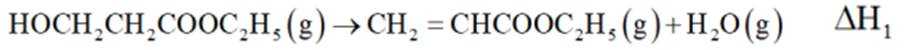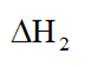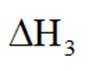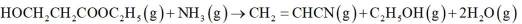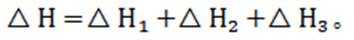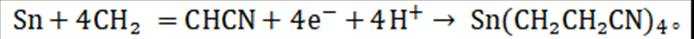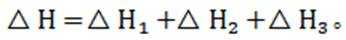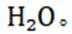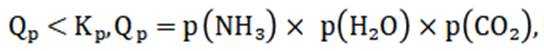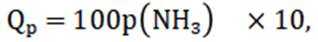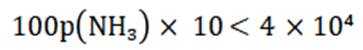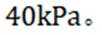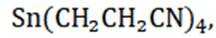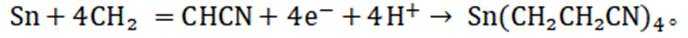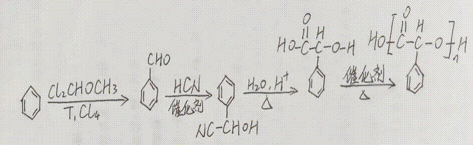- 真题试卷
- 模拟试卷
- 预测试卷
近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是( )
正确答案
解析
此题主要考查了新能源的特点、氢氧燃料电池的优点、锂离子电池工作原理以及太阳能电池能量转化等知识点
选项A:理想的新能源确实应该具备资源丰富、可再生以及对环境无污染等特性,该说法正确。
选项B:氢氧燃料电池具有能量转化率高且产物主要是水,比较清洁,该说法正确。
选项C:锂离子电池放电时锂离子从负极脱嵌,则充电时锂离子在阳极脱嵌,C正确。
选项D:太阳能电池是将光能转化为电能的装置,而不是化学能转化为电能, 该说法错误。
故本题答案为:D。
下列化学用语表述错误的是( )
正确答案
解析
此题主要考查了电子式、结构简式、水合离子以及共价键形成等知识点
选项A: NaOH的电子式为 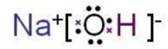
选项B:异丙基的结构简式应为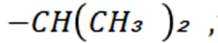
选项C:NaCl溶液中存在水合钠离子和水合氯离子应该一+一-,该选项错误。
选项D: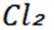
故本题答案为: C
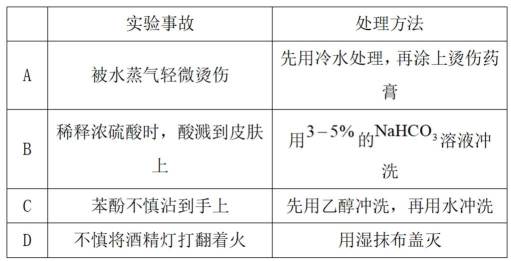
下列实验事故的处理方法不合理的是( )
正确答案
解析
此题主要考查了实验安全及事故处理的相关知识点,包括常见烫伤的处理、浓硫酸溅到皮肤上的处理方法、苯酚沾到手上的处理以及酒精灯着火的处理办法等
选项A:被水蒸气轻微烫伤,先用冷水处理可以降低烫伤处温度,减轻伤害,再涂上烫伤药膏是合理的处理方法。
选项B:稀释浓硫酸时,酸溅到皮肤上, 用水冲洗,是错误的处理方式。
选项C:苯酚不慎沾到手上,能用乙醇冲洗, 因为苯酚易溶于乙醇,可能会使苯酚扩散,应用酒精冲洗,该选项合理。
选项D:不慎将酒精灯打翻着火, 用湿抹布盖灭,可以隔绝空气灭火,是正确的处理方法。
故本题答案为:B
下列有关化学概念或性质的判断错误的是( )
正确答案
解析
此题主要考查了有机物的结构、键能、质谱以及离子液体等知识点
选项A: 甲烷是正四面体结构, 所以二氯甲烷只有一种结构,没有同分异构体,该选项正确。
选项B: 环己烷与苯的结构不同,C-H键所处的化学环境不同,键能不相等,该选项错误。
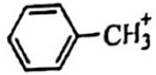
选项C: 甲苯的相对分子质量为92,所以质荷比为92的峰归属于甲苯,该选项正确。
选项D: 离子液体常温下呈液态, 可能是因为离子的体积较大,导致离子间的距离较大,相互作用力较小,容易呈液态,该选项正确。
故本题答案为: B。
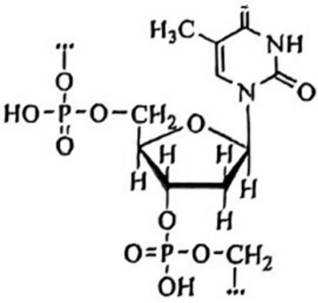
组成核酸的基本单元是核苷酸,下图是核酸的某一结构片段,下列说法错误的是( )
正确答案
解析
这道题主要考查了核酸的组成、结构以及相关性质等知识点
选项A: 脱氧核糖核酸 (DNA) 和核糖核酸 (RNA)结构中的碱基不完全相同,戊糖也不同,DNA中的戊糖是脱氧核糖,KNA中的戊糖是核糖,A错误。
选项B:碱基与戊糖缩合形成核苷,核苷与磷酸缩合形成核苷酸,核苷酸缩合聚合得到核酸,B正确。
选项C:核苷酸含有碱基,碱基具有一定的酸碱性质,所以核苷酸在一定条件下,既可以与酸反应,又可以与碱反应,C正确。
选项D:核酸分子中碱基通过氢键实现互补配对, 如A与T (或U) 、C与G通过氢键配对, D正确。
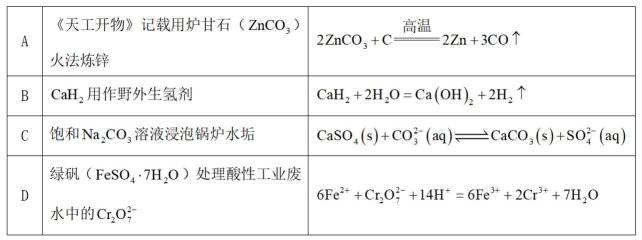
下列过程中,对应的反应方程式错误的是( )
正确答案
解析
此题主要考查了化学方程式的书写及应用、沉淀溶解平衡的相关知识。涉及到碳酸盐的分解反应、氢化钙与水的反应、沉淀转化以及氧化还原反应离子方程式等知识点。
选项A:碳酸锌与碳在高温下反应生成锌和二氧化碳,化学方程式错误。
选项B:氢化钙与水反应生成氢氧化钙和氢气,化学方程式正确。
选项C:饱和碳酸钠溶液与硫酸钙反应转化为更难溶的碳酸钙和硫酸钠, 离子方程式正确。
选项D:根据难溶物转化原则可知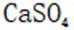
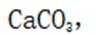
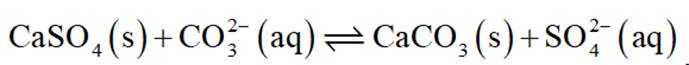
故本题答案为: A
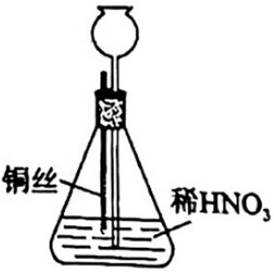
某学生按图示方法进行实验,观察到以下实验现象:
①铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色;
②铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深;
③一段时间后气体颜色逐渐变浅,至几乎无色;
④锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止.
下列说法正确的是( )
正确答案
解析
此题主要考查了金属与酸的反应、化学反应现象的分析、硝酸的性质等知识点
选项A:铜与稀硝酸不发生钝化,开始阶段铜丝表面气泡释放速度缓慢是因为反应开始时硝酸浓度较大,主要发生的是铜与浓硝酸的反应,随着反应进行,硝酸浓度逐渐降低,反应速率逐渐变慢,A错误。
选项B项:铜与稀硝酸反应生成的是NO,NO与空气中的氧气反应生成
选项C项:红棕色逐渐变浅的主要原因是二氧化氮与水反应生成硝酸和一氧化氮,化学方程式为 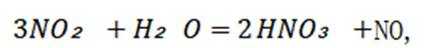
选项D:铜丝与液面脱离接触,反应停止是因为随着反应进行, 生成的一氧化氮不溶于水,在锥形瓶上部聚集,使锥形瓶内压强增大,从而将液体压入长颈漏斗中,导致铜丝与液面脱离接触,反应停止, 而不是硝酸消耗完全, D错误。故本题答案为:C。
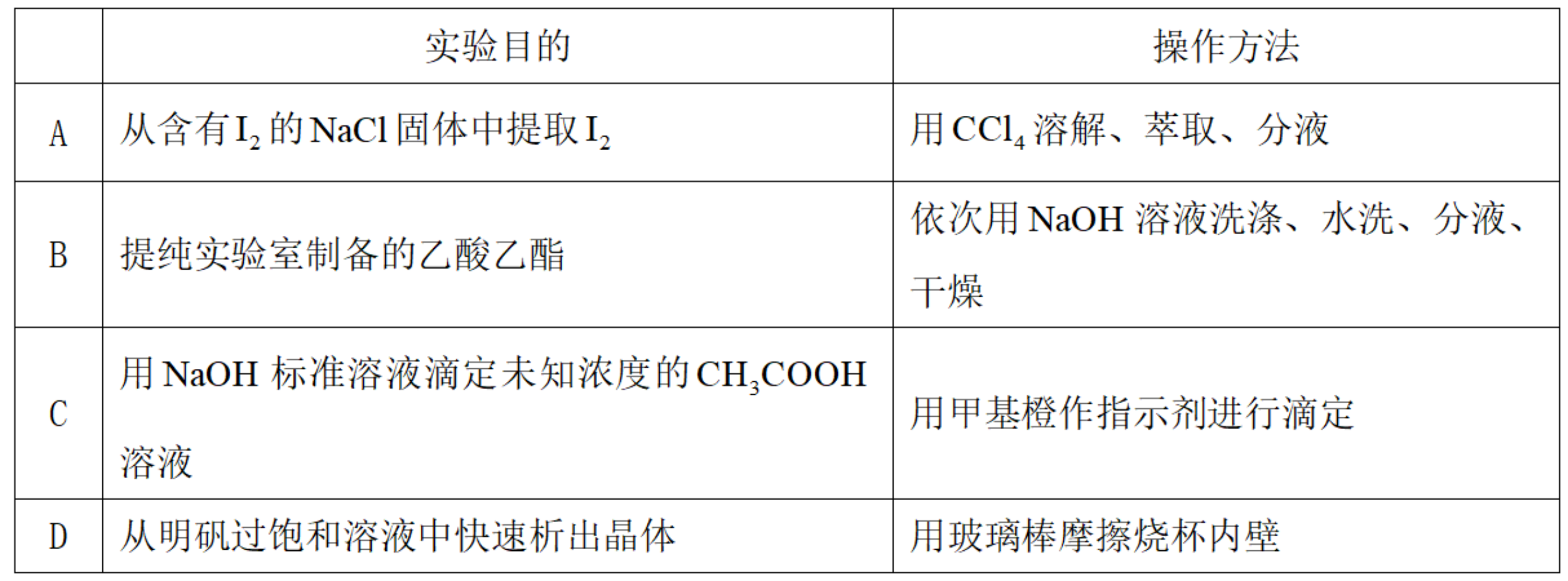
为达到下列实验目的,操作方法合理的是( )
正确答案
解析
此题主要考查了物质的分离与提纯、酸碱中和滴定以及结晶等知识点
选项A: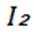

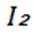
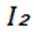
选项B:NaOH溶液会使乙酸乙酯水解,不能用NaOH溶液洗涤提纯乙酸乙酯, B错误。
选项C: 甲基橙的变色范围是3.1~4.4,而醋酸与氢氧化钠恰好完全反应时溶液呈碱性,应选用酚酞作指示剂, C错误。
选项D:用玻璃棒摩擦烧杯内壁可以促使明矾过饱和溶液中晶体析出,操作方法合理, D正确。
故本题答案为D。
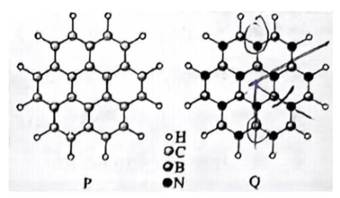
通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是( )
正确答案
解析
此题主要考查了分子极性、第一电离能、电子数以及杂化轨道等知识点
选项A项: P分子结构对称,正负电荷中心重合, 为非极性分子;0分子结构不对称,正负电荷中心不重合, 为非极性分子,该项说法错误。
选项B项: 一般情况下, 同周期元素从左到右第一电离能呈增大趋势,但ⅡA族、 VA族元素的第一电离能大于相邻元素,所以第一电离能应为B
选项C项: 由图可知1molP和1molQ所含原子种类和数目相同,所以所含电子数目相等,该项说法正确。
选项D项:P和Q分子中C、 B和N均形成了3个σ键,且均有一个未参与杂化的p轨道, 所以均为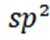
故本题答案为:A。
在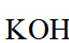
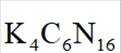
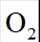
正确答案
解析
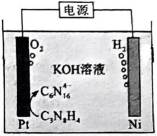
此题主要考查了电解池的原理,包括离子的移动方向、电极反应式的书写、溶液 pH 的变化以及电子转移与产物的定量关系等知识点。
该图展示了在KOH水溶液中进行电化学合成的装置,涉及到电极反应和离子移动等问题。
选项A: 电解时, 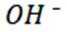
选项B:根据图中信息,在阴极发生还原反应, 生成氢气,在阳极发生氧化反应, 生成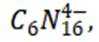
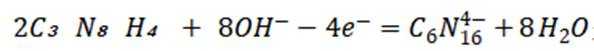
选项C:电解过程中,氢氧根离子在阳极参与反应被消耗,溶液pH应降低,该项错误。
选项D: 由电极反应可知,每生成. 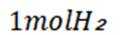
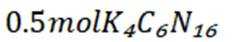
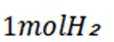
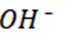
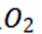
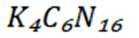
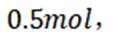
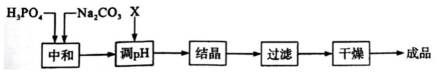
中和法生产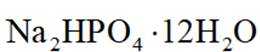
已知:①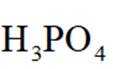
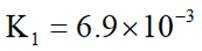
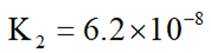
②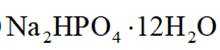
下列说法错误的是( )
正确答案
解析
此题主要考查了电离平衡常数的应用、盐类水解、化学反应在实际生产中的应用等知识点
选项A:若在铁质容器中进行,先加入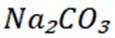
选项B: “调pH”工序若加入NaOH,是为了不引入新的杂质,调节PH,所以该项说法正确。
选项C:最终要得到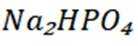
选项D: 因为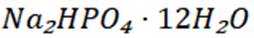
故本题答案为: C。
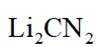

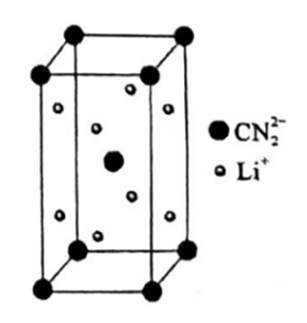
正确答案
解析
此题主要考查了氧化还原反应中还原剂的判断、晶胞的分析以及一些物质结构的相关知识
选项A: 在反应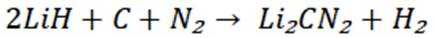
选项B:根据晶胞结构,顶点的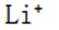
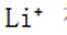
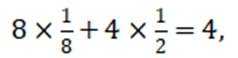
选项C: 以顶点的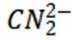
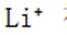
选项D: 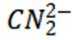
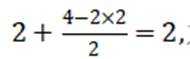
故本题答案为: D。
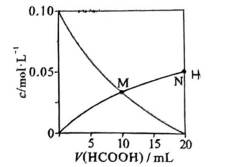
常温下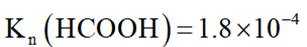
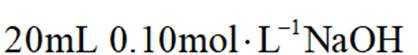
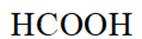
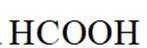
正确答案
解析
此题主要考查了电离平衡常数、水的电离、电荷守恒、物料守恒等知识点
选项A选项:随着甲酸的加入,溶液由碱性逐渐变为酸性,对水的电离抑制程度逐渐减小,所以水的电离程度是M<N, A正确。
选项B选项:M点溶液呈碱性,根据电荷守恒可得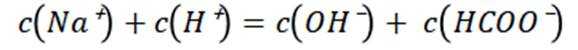
选项C选项: 当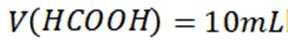
物料守恒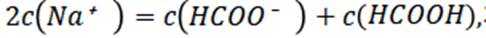
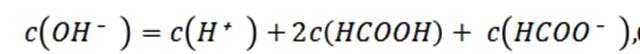
选项D选项:N点时甲酸过量,溶液呈酸性,应该是
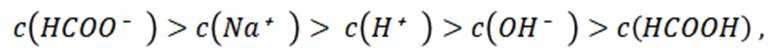
故本题答案为:D。
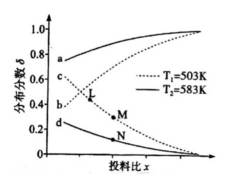
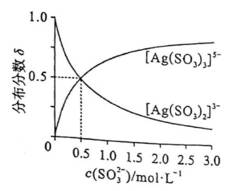
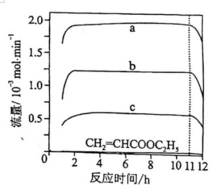
恒压下,向某密闭容器中充入一定量的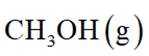
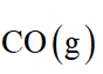
主反应: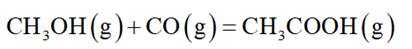
副反应: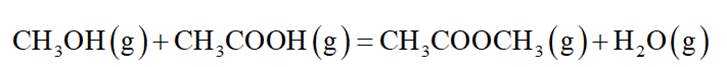
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数
随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是( )
正确答案
解析
此题主要考查了化学反应平衡的相关知识点,包括平衡的移动、反应热与焓变、平衡常数等
选项A:通常情况下,投料比是指投入的两种反应物的物质的量之比,在该反应中投料比x代表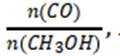
选项B:随着投料比增大,即甲醇相对增多,根据主反应可知会生成更多乙酸,所以曲线6代表乙酸的分布分数,B错误。
选项C: 由图可知,温度升高, 乙酸的分布分数减小,说明升高温度平衡逆向移动,主反应为放热反应,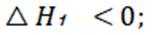
选项D:平衡常数只与温度有关,温度不变平衡常数不变,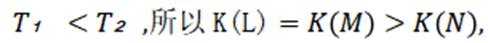
故本题答案为:D。
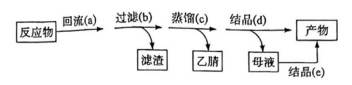
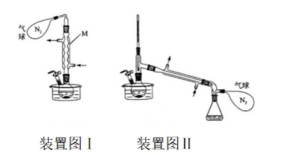
(14分)亚铜配合物广泛用作催化剂.实验室制备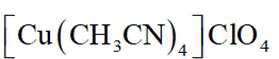
实验步骤如下:
分别称取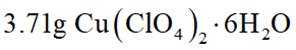
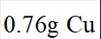
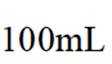
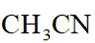
已知:①乙腈是一种易挥发的强极性配位溶剂;
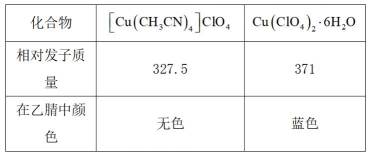
②相关物质的信息如下:
回答下列问题:
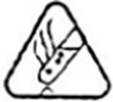
(1)下列与实验有关的图标表示排风的是________(填标号);
A.


(2)装置Ⅰ中仪器M的名称为________________;
(3)装置Ⅰ中反应完全的现象是________________;
(4)装置Ⅰ和Ⅱ中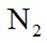
(5)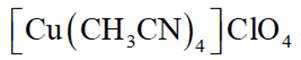
(6)为了使母液中的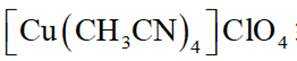
A.水 B.乙醇 C.乙醚
(7)合并步骤d和e所得的产物,总质量为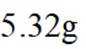
正确答案
(1)D;(2)球形冷凝管;(3)当溶液由蓝色变为无色时,说明反应完全;(4)排出装置内空气,防止制备的产品被氧化;(5) 防止直接冷却结晶得到的晶体不纯,通过先蒸馏至接近饱和,可以减少杂质的含量,降低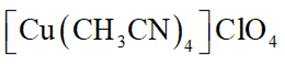
解析
此题主要考查了实验装置的认识、实验现象的判断、物质分离提纯的方法、相对分子质量的计算以及产率的计算等知识点
(1)表示排风的图标是D。
(2)装置1中仪器M是球形冷凝管。
(3) 当溶液由蓝色变为无色时,说明反应完全。 因为反应物中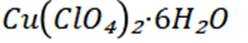
(4)装置Ⅰ和Ⅱ中N气球的作用是平衡气压,排出装置内空气,防止制备的产品被氧化。
(5)这样处理的目的是防止直接冷却结晶得到的晶体不纯,通过先蒸馏至接近饱和,可以减少杂质的含量,直接将水蒸干难以获得晶体状固体,因此需先蒸馏至接近饱和,再经步骤d冷却结晶,从而获得晶体。
(6)应该选择B, 因为乙醚与乙腈互溶性差,有利于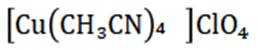
(7)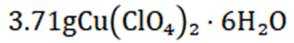
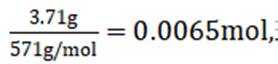
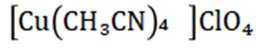
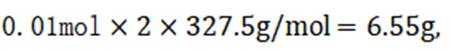
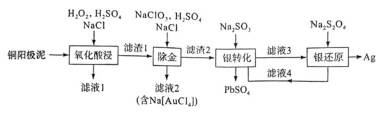
(14分)铜阳极泥(含有Au、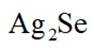
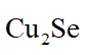
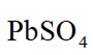
已知:①当某离子的浓度低于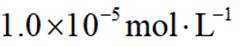
②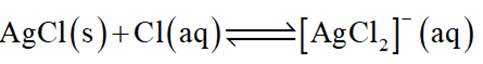
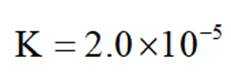
③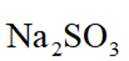
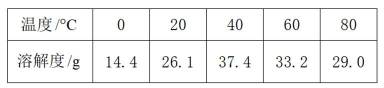
④不同温度下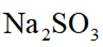
(1)Cu属于________区元素,其基态原子的价电子排布式为________;
(2)“滤液1”中含有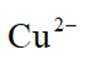
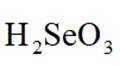
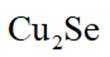
(3)“氧化酸浸”和“除金”工序抣需加入一定量的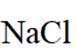
①在“氧化酸浸”工序中,加入适量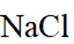
②在“除金”工序溶液中,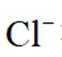
(4)在“银转化”体系中,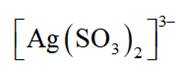
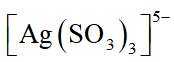
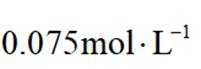
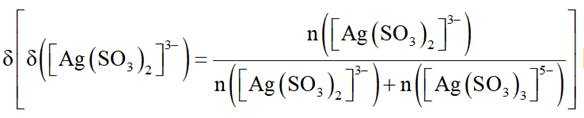
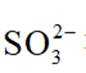
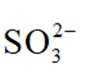
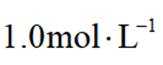
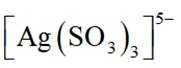
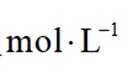
(5)滤液4中溶质主要成分为________________(填化学式);在连续生产的模式下,“银转化”和“银还原”工序需在
正确答案
(1) ds,
(2)
(3)①使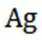
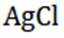
(4) 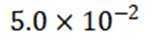
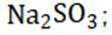

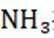
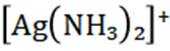
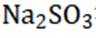
解析
元素分区及原子价电子排布式的相关知识。
氧化还原反应的离子方程式书写。
化学平衡及溶度积相关计算。
离子浓度与分布分数的图像分析与计算。
物质的溶解度随温度变化的应用。
对化工流程中化学反应原理的理解和应用。
(1)Cu 属于ds区元素,其基态原子的价电子排布式为
(2)“氧化酸浸”时Se反应的离子方程式为:
(3)①在“氧化酸浸”工序中,加入适量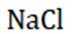
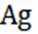
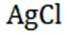
②在“除金”工序溶液中,已知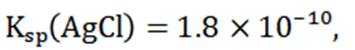
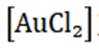
所以
(4) 若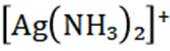
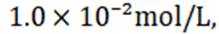
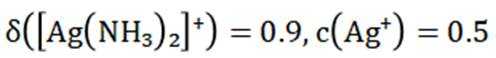
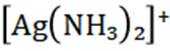
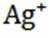
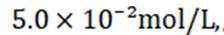
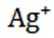
(5)滤液4中溶质主要成分为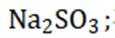
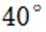

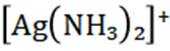
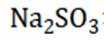
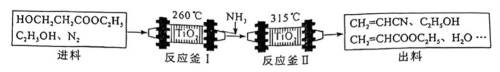
(15分)丙烯腈(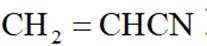
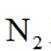
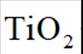
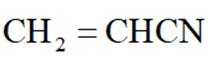
已知:①进料混合气进入两釜的流量恒定,两釜中反应温度恒定:
②反应釜Ⅰ中发生的反应:
ⅰ:
③反应釜Ⅱ中发生的反应:
ⅱ: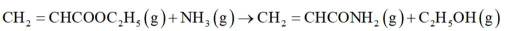
ⅲ: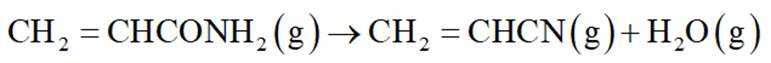
④在此生产条件下,酯类物质可能发生水解.
回答下列问题:
(1)总反应
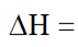
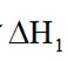
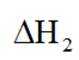
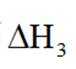
(2)进料混合气中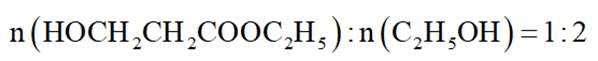
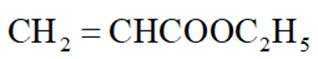
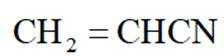
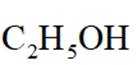
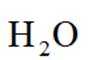
①表示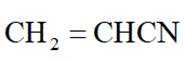
②反应釜Ⅰ中加入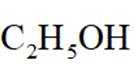
③出料中没有检测到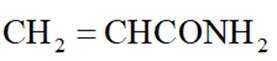
④反应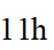
(3)催化剂
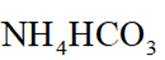
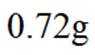
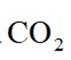
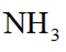
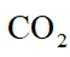
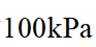

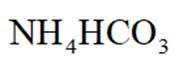
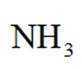
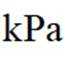
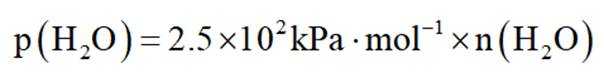
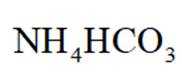
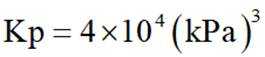
(4)以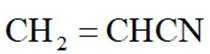
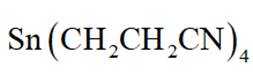
正确答案
(1)
(2)①c;②抑制酯类物质的水解;③该反应为可逆反应,且反应进行程度大,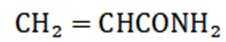
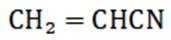
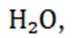
④反应物浓度减小,反应速率减慢,导致各物质的生成速率减慢
(3)40;(4)
解析
该题主要考查了化学反应原理、可逆反应、反应速率等知识点
(1)总反应可以由反应釜1中的反应加上反应釜Ⅱ中的两个反应得到,所以
(2)①根据反应可知生成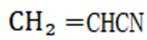
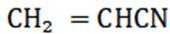
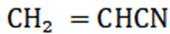
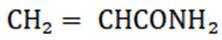
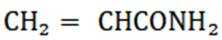
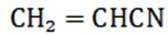
④反应llh后, a、 b、 c曲线对应物质的流量逐渐降低的原因是反应物浓度减小,反应速率减慢,导致各物质的生成速率减慢。
(3) 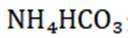
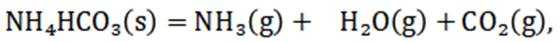
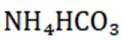
已知
所以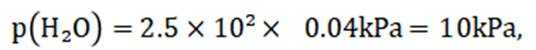
要使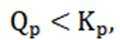

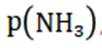
(4)阴极发生得电子的还原反应,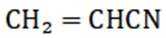
阴极反应式为
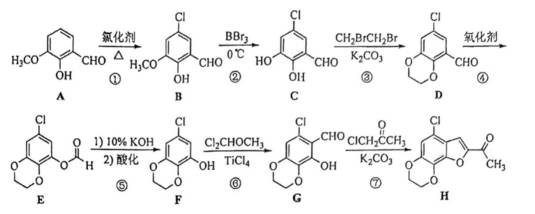
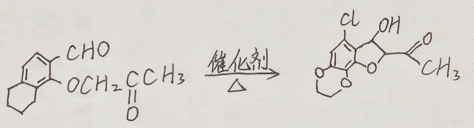
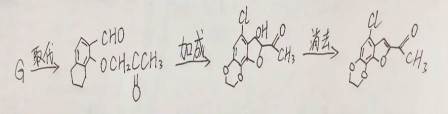
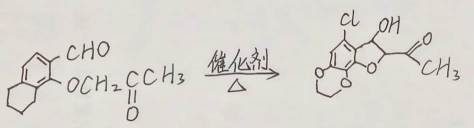
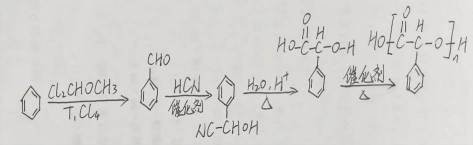
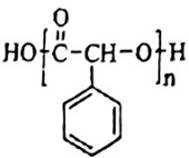
(15分)化合物H是一种具有生物活性的苯并呋喃衍生物,合成路线如下(部分条件忽略,溶剂未写出):
回答下列问题:
(1)化合物A在核磁共振氢谱上有________组吸收峰;
(2)化合物D中含氧官能团的名称为________、________;
(3)反应③和④的顺序不能对换的原因是________________;
(4)在同一条件下,下列化合物水解反应速率由大到小的顺序为________________(填标号);
①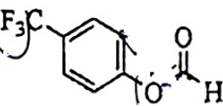
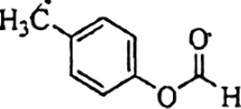
(5)化合物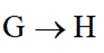
(6)依据以上流程信息,结合所学知识,设计以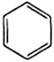
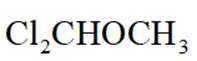

正确答案
(1)6;(2)醛基、 醚键;(3)反应③先引入酯基,若先进行反应④会导致酯基水解; (4)①﹥③﹥②;
(5)
(6)
解析
该题主要考查了有机物的结构与性质、官能团的识别、核磁共振氢谱、反应顺序的分析、酯的水解反应速率比较以及有机合成路线等知识点
⑴化合物A中有6种不同化学环境的氢原子,所以在核磁共振氢谱上有6组吸收峰。
(2)化合物D中含氧官能团的名称为醛基、 醚键。
(3)反应③先引入酯基,若先进行反应④会导致酯基水解,所以反应③和④的顺序不能对换。
(4)酯基水解难易程度主要取决于酯基所连基团的大小,基团越大越难水解,所以水解反应速率由大到小的顺序为①﹥③﹥②。
(5)
加成反应的化学方程式为:
(6)合成路线为: