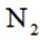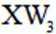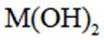- 真题试卷
- 模拟试卷
- 预测试卷
化学与日常生活息息相关。下列说法错误的是
正确答案
《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是
正确答案
下列实验操作规范的是
正确答案
化学物质在体育领域有广泛用途。下列说法错误的是
正确答案
钠和钾是两种常见金属,下列说法正确的是
正确答案
依据下列实验,预测的实验现象正确的是
正确答案
在2.8gFe中加入100mL3mol/LHCl,Fe完全溶解。NA代表阿伏加德罗常数的值,下列说法正确的是
正确答案
某温度下,反应
正确答案
一种采用


下列有关说法正确的是
正确答案
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是
正确答案
已知

正确答案
化合物“E7974”具有抗肿瘤活性,结构简式如下,下列有关该化合物说法正确的是
正确答案
NaClO溶液具有漂白能力,已知25℃时,Ka=(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是
正确答案
某元素M的氢氧化物




正确答案
胆矾(


回答问题:
(1)步骤①的目的是_______。
(2)步骤②中,若仅用浓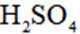
(3)步骤②中,在

(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是_______。
(5)实验证明,滤液D能将
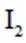
ⅰ.甲同学认为不可能是步骤②中过量
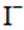

ⅱ.乙同学通过实验证实,只能是


正确答案
(1)除油污 (2)
(3)
(4)胆矾晶体易溶于水
(5) ①溶液 C 经步骤③加热浓缩后双氧水已完全分解 ②取滤液,向其中加入适量硫化钠,使铜离子恰好完全沉淀,再加入
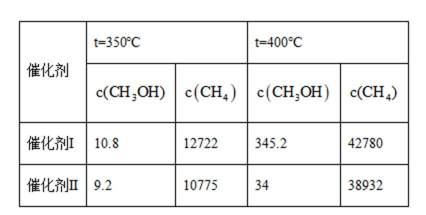
某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:
回答问题:
(1)已知:电解液态水制备



(2)已知:
①若反应为基元反应,且反应的

②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入



(3)在相同条件下,





在选择使用催化剂Ⅰ和350℃条件下反应,


正确答案
(1)-286
(2) ① 
(3) ①5.4 ② 相同催化剂,400℃的反应速率更快,相同温度,催化剂Ⅱ副产物浓度低,甲烷与甲醇比例高
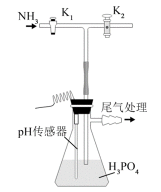
磷酸氢二铵

回答问题:
(1)实验室用

(2)现有浓


(3)装置中活塞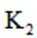
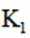

(4)当溶液pH为8.0~9.0时,停止通




(5)若本实验不选用pH传感器,还可选用_______作指示剂,当溶液颜色由_______变为_______时,停止通
正确答案
(1)
(2)11.5
(3) ①平衡气压防倒吸 ②倒吸
(4)① 
(5)①酚酞 ②无 ③ 浅红
黄酮哌酯是一种解痉药,可通过如下路线合成:
回答问题:
(1)A→B的反应类型为_______。
(2)已知B为一元强酸,室温下B与NaOH溶液反应的化学方程式为_______。
(3)C的化学名称为_______,D的结构简式为_______。
(4)E和F可用_______(写出试剂)鉴别。
(5)X是F的同分异构体,符合下列条件。X可能的结构简式为_______(任写一种)。
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(6)已知酸酐能与羟基化合物反应生成酯。写出下列F→G反应方程式中M和N的结构简式_______、_______。
(7)设计以


正确答案
(1)取代反应或磺化反应
(2)

(3) ①苯酚 ②
(4)
(5)
(6)
(7)
以
(1)基态O原子的电子排布式_______,其中未成对电子有_______个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______。
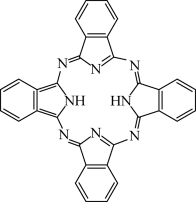
(3)酞菁


(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______。
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
正确答案
(1) ①1s22s22p4或[He]2s22p4 ② 2
(2)自由电子在外加电场中作定向移动
(3) ①sp2 ②两者均为分子晶体,后者能形成分子间氢键,使分子间作用力增大,熔点更高
(4)Zn+4NH3+2H2O=[Zn(NH3)4]2++2OH-+H2↑
(5)电负性O>N,O对电子的吸引能力更强,Zn和O更易形成离子键
(6) ①▱cdhi ②▱bcek