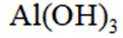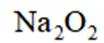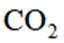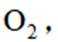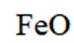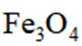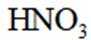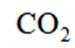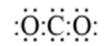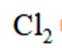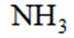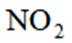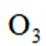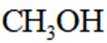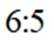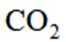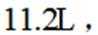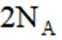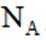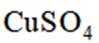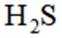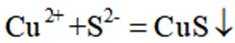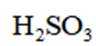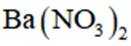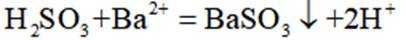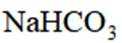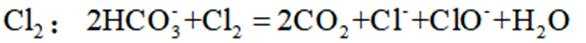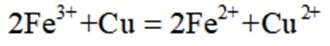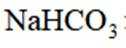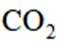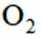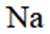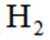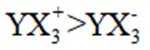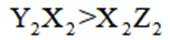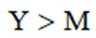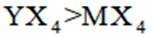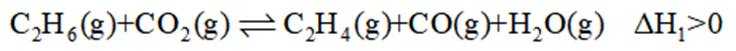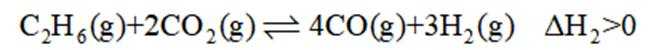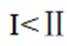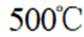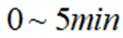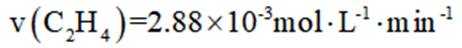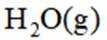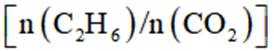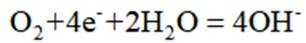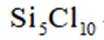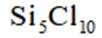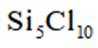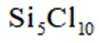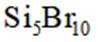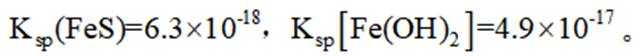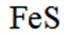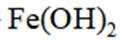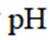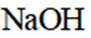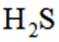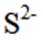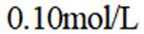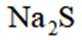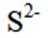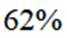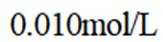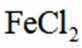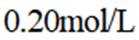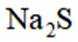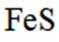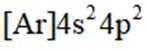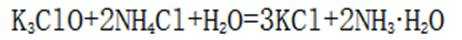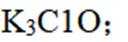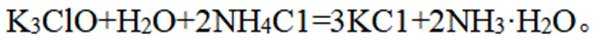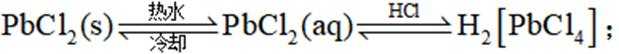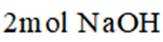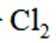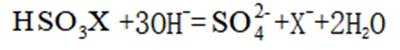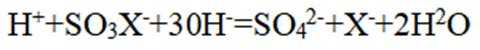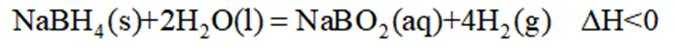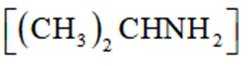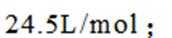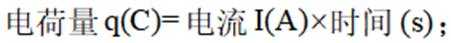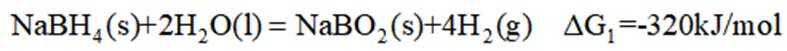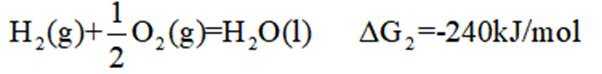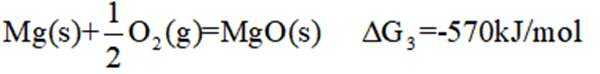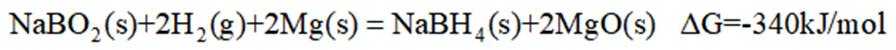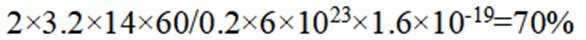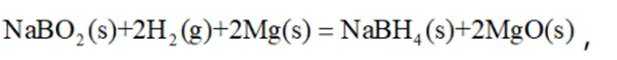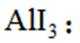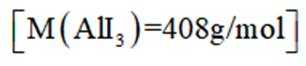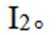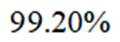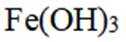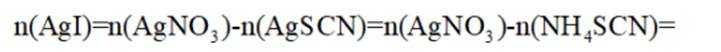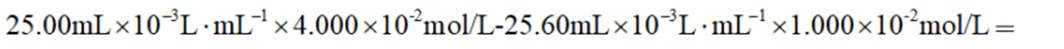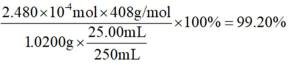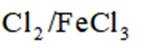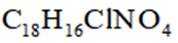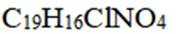- 真题试卷
- 模拟试卷
- 预测试卷
按物质组成分类,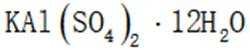
正确答案
解析
本题考查了物质的组成的相关知识点
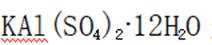
下列说法不正确的是
正确答案
解析
本题考查了物质的性质的相关知识点
A.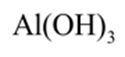
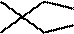
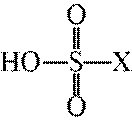
下列表示不正确的是
正确答案
解析
本题考查了电子式键线式的书写和杂化轨道理论的相关知识点
选项A.C=O,碳氧双键。综上所述,本题选A。
下列说法不正确的是
正确答案
解析
本题考查了物质化学反应和物质的萃取的相关知识点
选项C,向上排空气法。综上所述,本题选C。
化学与人类社会可持续发展息息相关。下列说法不正确的是
正确答案
解析
本题考查了物质的特性的相关知识点
选项B,气化属于化学变化。综上所述,本题选B。
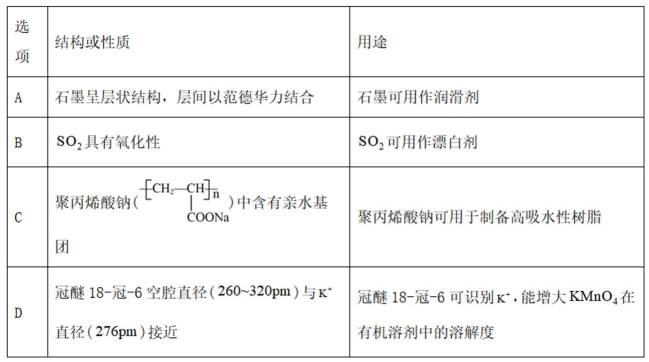
利用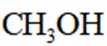
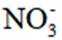
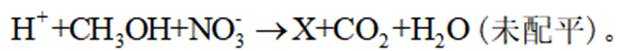
正确答案
解析
本题考查了氧化还原反应的相关知识点
删除A.利用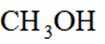
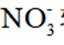
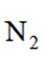
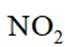
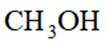
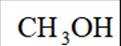
综上所述,本题选C。
物质微观结构决定宏观性质,进而影响用途。下列结构或性质不能解释其用途的是
正确答案
解析
本题考查了分子间作用力的相关知识点
B.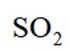
故选B。
下列离子方程式正确的是
正确答案
解析
本题考查了离子反应方程式的书写的相关知识点
选项A.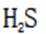
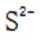
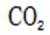
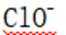
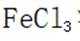
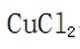
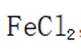
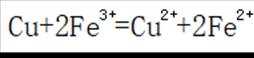
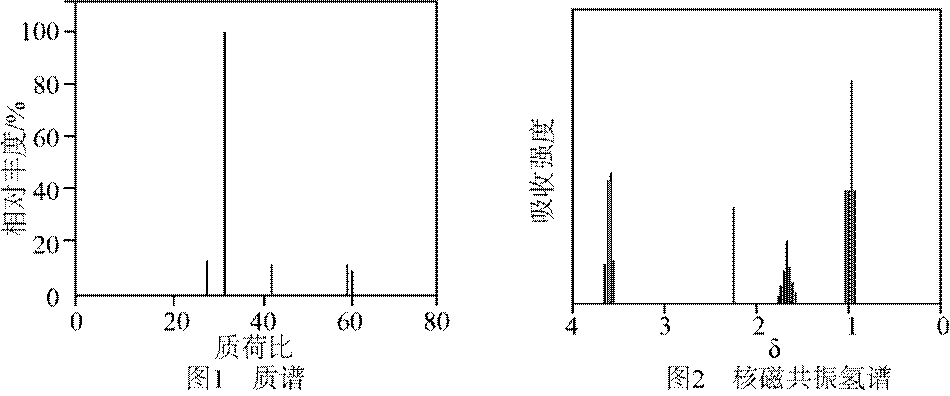
有机物A经元素分析仪测得只含碳、氢、氧3种元素,红外光谱显示A分子中没有醚键,质谱和核磁共振氢谱示意图如下。下列关于A的说法正确的是
正确答案
解析
本题考查了有机物官能团的性质的相关知识点
有题目可知,该化合物为正丙醇。选项A,不能发生水解反应;选项B,不能与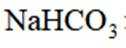
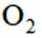
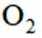
故选D。
X、Y、Z、M四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y与M同主族,Y与Z核电荷数相差2,Z的原子最外层电子数是内层电子数的3倍。下列说法不正确的是
正确答案
解析
本题考查了原子的推断的相关知识点
X、Y、Z、M四种主族元素,依次为H、C、O、Si。选项B,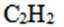
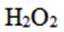
综上所述,本题选B。
二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.
II.
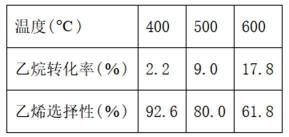
向容积为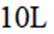
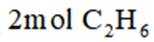
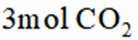
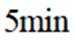
正确答案
解析
本题考查了平衡状态的相关知识点
选项D,其他条件不变,增大投料比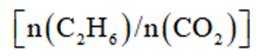
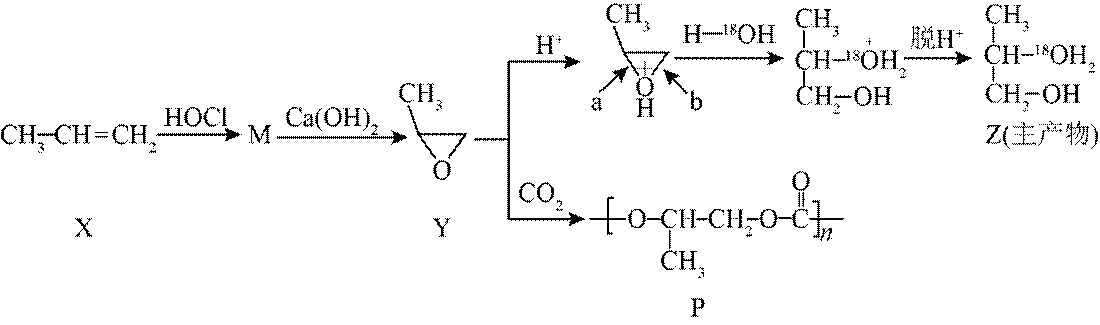
丙烯可发生如下转化(反应条件略):
下列说法不正确的是
正确答案
解析
本题考查了有机物之间的反应的相关知识点
选项D,缩聚反应有小分子副产物,与题目不符。故选D。
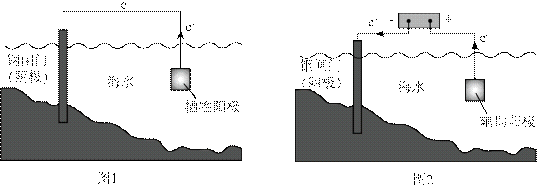
金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两种对海水中钢闸门的防腐措施示意图:
下列说法正确的是
正确答案
解析
选项A,阳极材料得电子;选项B,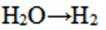
综上所述,本题选B。
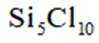
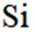
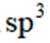
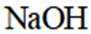
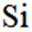
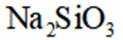
正确答案
解析
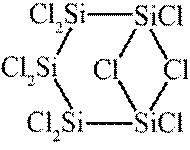
选项A,Cl有连两个键,Si没有配位键。
故选A。
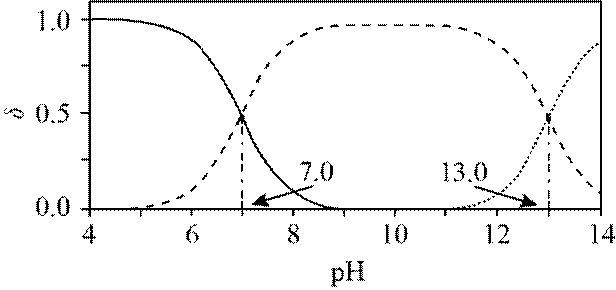
室温下,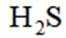
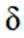
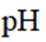
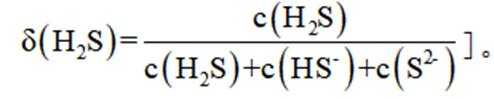
下列说法正确的是
正确答案
解析
本题考查了离子反应及计算的相关知识点
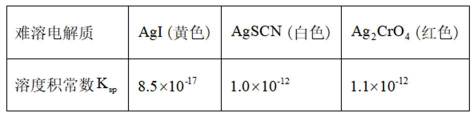
选项A,溶解度: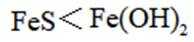
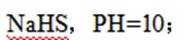
综上所述,本题选C。
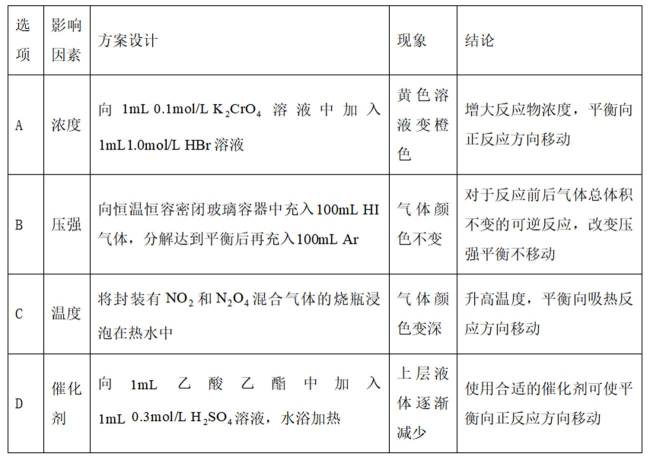
为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是
正确答案
解析
本题考查了化学反应平衡的相关知识点
选项A,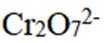
综上所述,本题选C。
氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1,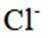
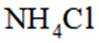
(2)下列有关单核微粒的描述正确的是_______。
A. 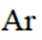
B. 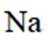
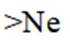
C. 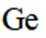
D. 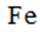
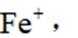
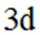
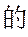
(3)化合物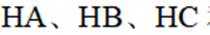
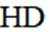
①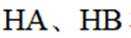
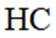
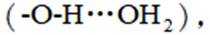
②已知
正确答案
(1)①. 12 ②.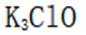
(2)AB
(3) ①. 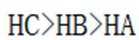
解析
本题考查了物质的结构与性质的相关知识点
(1)(1)配位数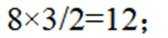
方程式
(2)选项A.Ar原子电子排布方式只有一种;选项B.Na的第二电离能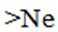
故答案选AB。
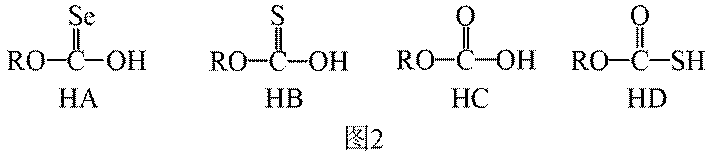
(3)①O、S、Se电负性依次减小,极性减小,HA、HB、HC氢键依次增强。②酸性HD>HC,碱性NaD<NaC
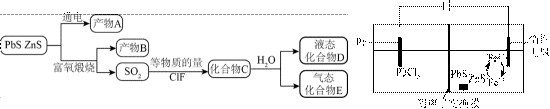
矿物资源的综合利用有多种方法,如铅锌矿(主要成分为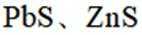
已知:①
②电解前后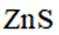
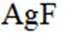
请回答:
(1)根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果,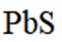
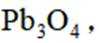
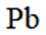
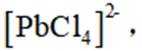
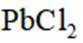
(2)下列说法正确的是_______。
A. 电解池中发生的总反应是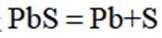
B. 产物B主要是铅氧化物与锌氧化物
C.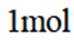
D. 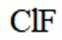
(3)D的结构为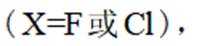
①实验方案:取D的溶液,加入足量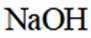
②写出D(用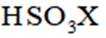
正确答案
(1) ①. 还原性 ②.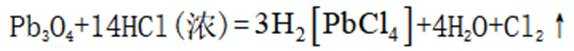
(2)AB
(3) ①. 加入足量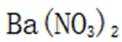

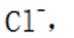
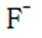
解析
本题考查了氧化还原反应及离子方程式的书写的相关知识点
(1)还原性;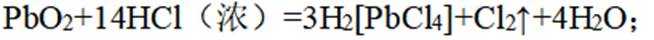
(2)选项C.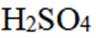
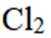
(3)①测试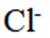
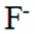
氢是清洁能源,硼氢化钠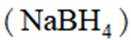
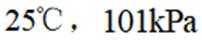
请回答:
(1)该反应能自发进行的条件是_______。
A. 高温 B. 低温 C. 任意温度 D. 无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
A. 升高溶液温度 B. 加入少量异丙胺
C. 加入少量固体硼酸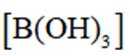
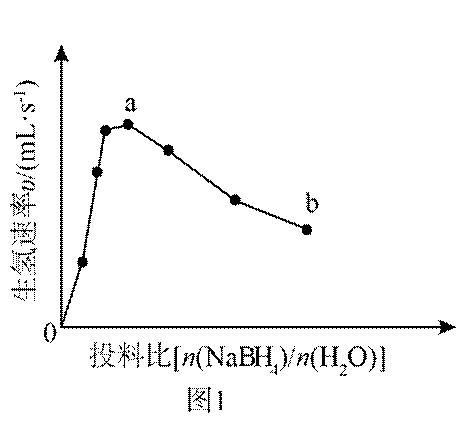
(3)为加速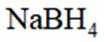
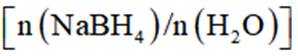
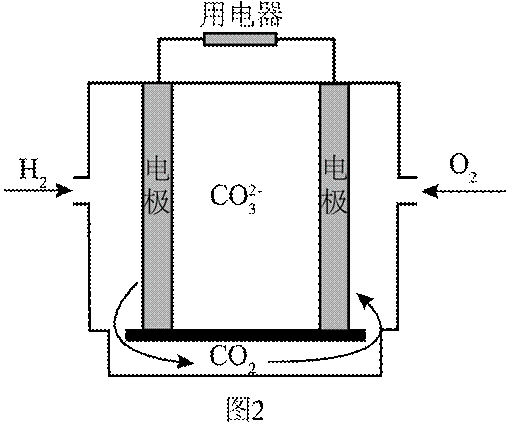
(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图2所示,正极上的电极反应式是_______。该电池以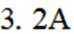
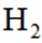
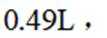
[已知:该条件下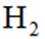
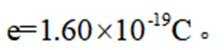
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方法,将反应副产物偏硼酸钠(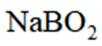
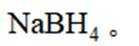
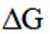
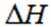
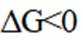
I.
II.
III.
请书写一个方程式表示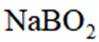
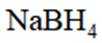

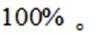
正确答案
(1)C (2)A
(3)随着投料比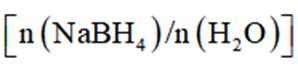
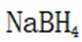
(4) ①. 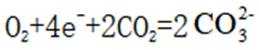
(5)
解析
本题考查了工业制取及化学利用率转化率等相关计算的相关知识点
(1)由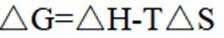
(2)选项A,升温,反应速率快。选项B,加入异丙胺,反应速率降低。选项C,加硼酸,反应速率降低。选项D,加压忽略体积,浓度不变,反应速率降低。答案选A。
(3)比例增大,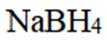
(4)根据题干,该燃料电池中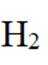
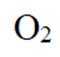
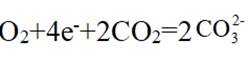
(5)结合题干信息,要使得氢原子利用率为100%,可由
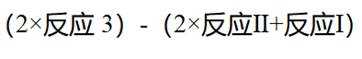
某小组采用如下实验流程制备
已知: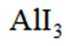
请回答:
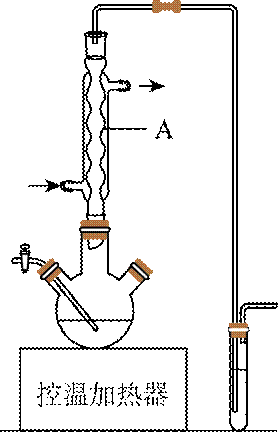
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是_______,判断步骤I反应结束的实验现象是_______。
(2)下列做法不正确的是_______。
A. 步骤I中,反应物和溶剂在使用前除水
B. 步骤I中,若控温加热器发生故障,改用酒精灯(配石棉网)加热
C. 步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜
D. 步骤Ⅳ中,使用冷的正己烷洗涤
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证_______。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中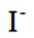
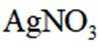
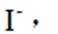
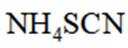
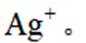
①从下列选项中选择合适的操作补全测定步骤_______。
称取产品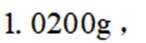
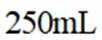
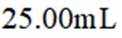
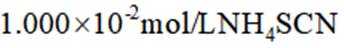
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂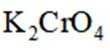
d.滴加指示剂硫酸铁铵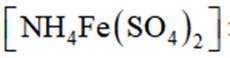
e.准确移取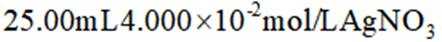
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是_______。
③三次滴定消耗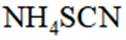
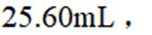
正确答案
(1) ①. 球形冷凝管 ②. 三颈烧瓶溶液紫色褪去
(2)BC
(3)加入淀粉溶液,若溶液出现蓝色,则含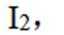
(4) ①.a e d f ②.抑制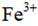
解析
本题考查了工业制取产品的相关知识点
(1)由实验装置图中仪器的结构可知,图中仪器A的名称为球形冷凝管,碘溶于正己烷使溶液显紫红色,当碘反应完全后,紫色褪去因此,三颈烧瓶中紫色褪去。
(2选项A.吸水强,先除水。选项B.乙烯禁止使用明火。选项C.在空气中易氧化,要有保护气。选项D.要用冷的正己烷洗涤。
综上所述,本题选BC。
(3)碘易溶于正己烷,而可溶于热的正己烷、不易溶于冷的正己烷,检验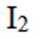
(4)②防止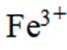
③
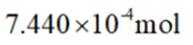
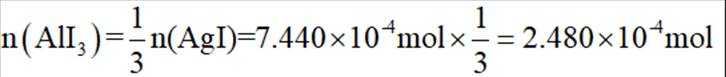
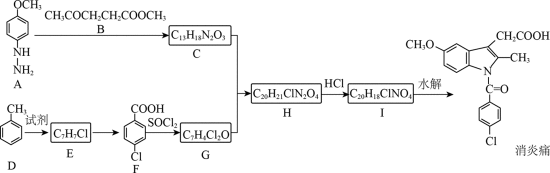
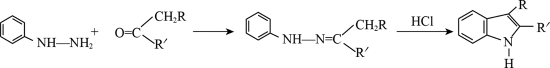
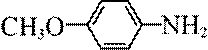
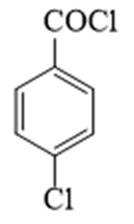
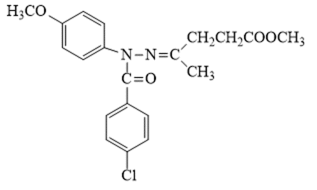
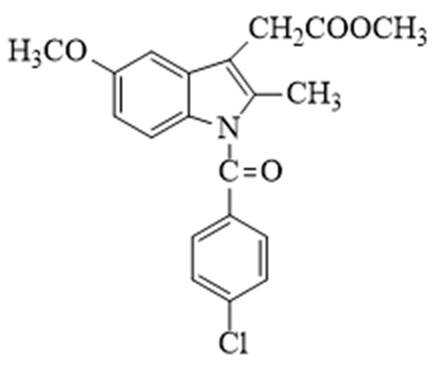
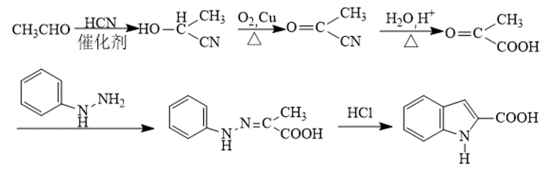
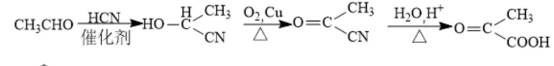
某研究小组按下列路线合成抗炎镇痛药“消炎痛”(部分反应条件已简化)。
已知:
请回答:
(1)化合物F的官能团名称是_______。
(2)化合物G的结构简式是_______。
(3)下列说法不正确的是_______。
A. 化合物A的碱性弱于
B. 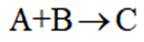
C. 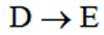
D. “消炎痛”的分子式为
(4)写出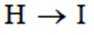
(5)吗吲哚-2-甲酸(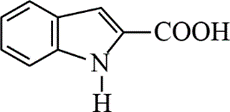
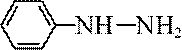
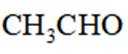
(6)写出4种同时符合下列条件的化合物B的同分异构体的结构简式_______。
①分子中有2种不同化学环境的氢原子;
②有甲氧基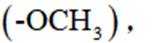
正确答案
(1)羧基、氯原子
(2)
(3)AD
(4)
(5)
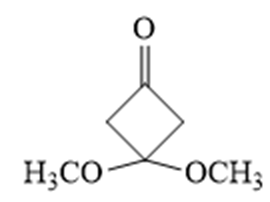
(6)
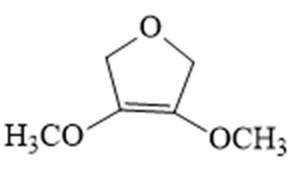
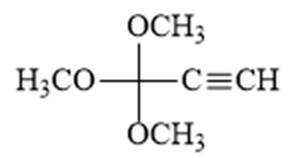
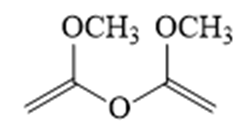
解析
本题考查了有机物的推断和书写的相关知识点
(1)由F的结构可知,F的官能团为羧基、氯原子(碳氯键);
(2)由分析得,G为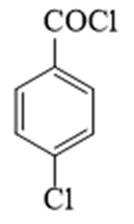
(3)选项A.A中的氨基更易结合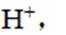
故选AD;
(4)化学方程式为: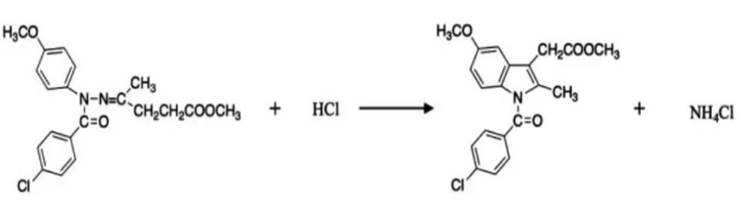
(5)合成路线为:
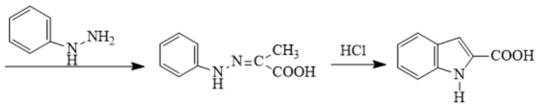
(6)符合条件的结构简式为: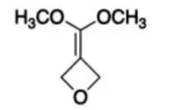
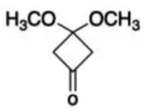
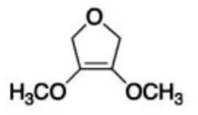
(其他符合条件的结构也可)。