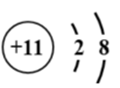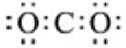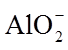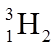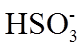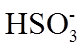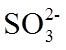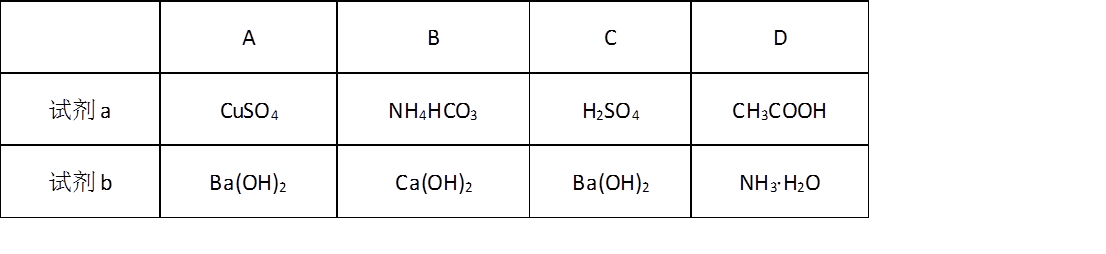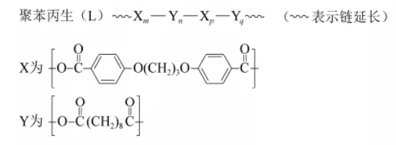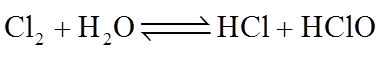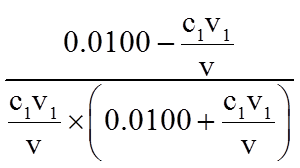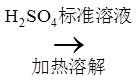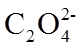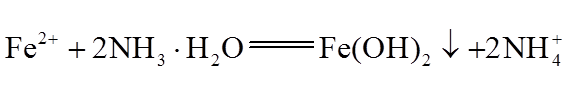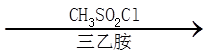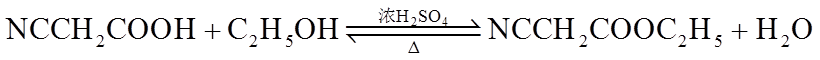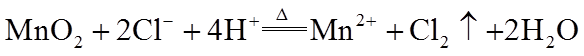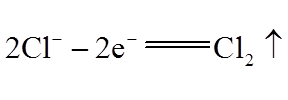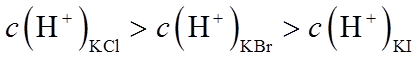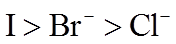- 真题试卷
- 模拟试卷
- 预测试卷
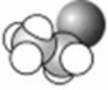
3.下列化学用语或图示表达不正确的是
正确答案
7.下列方程式不能准确解释相应实验现象的是
正确答案
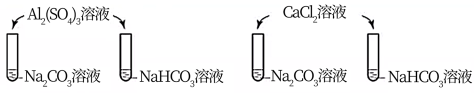
9.用电石(主要成分为CaC2,含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:
①H2S + CuSO4 =CuS↓+H2SO4
②24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4
下列分析不正确的是
正确答案
10.NO2和N2O4存在平衡:2NO2(g)⇌N2O4(g) ΔH<0。下列分析正确的是
正确答案
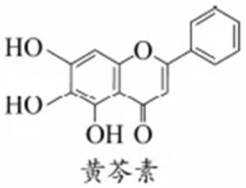
1.我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法不正确的是
正确答案
2.下列有关放射性核素氚(
正确答案
4.下列性质的比较,不能用元素周期律解释的是
正确答案
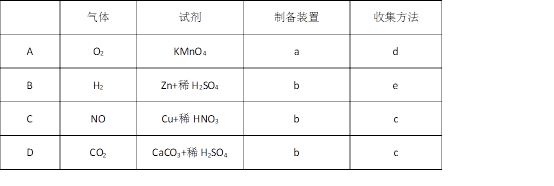
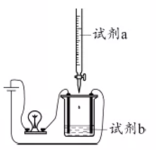
5.实验室制备下列气体所选试剂、制备装置及收集方法均正确的是
正确答案
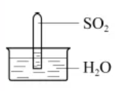
6.室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是
正确答案
8.使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是
正确答案
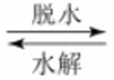
11.可生物降解的高分子材料聚苯丙生(L)的结构片段如下图。
已知:R1COOH+R2COOH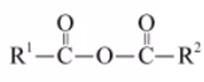
下列有关L的说法不正确的是
正确答案
12.下列实验中,均产生白色沉淀。
下列分析不正确的是
正确答案
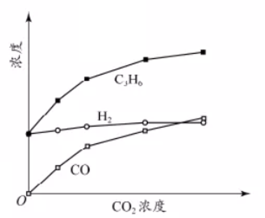
14.丙烷经催化脱氢可制丙烯:C3H8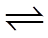
已知:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH -2220 kJ·mol−1
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) ΔH =-1926.1 kJ·mol−1
③H2(g)+1/2O2(g)=H2O(l) ΔH =-286 kJ·mol−1
下列说法不正确的是
正确答案
13.有科学研究提出:锂电池负极材料(Li)由于生成LiH而不利于电池容量的保持。一定温度下,利用足量重水(D2O)与含LiH的Li负极材料反应,通过测定n(D2)/n(HD)可以获知 n(Li)/n(LiH)。
已知:①LiH+H2O=LiOH+H2↑
②2Li(s)+H2(g)⇌2LiH(s) ΔH<0
下列说法不正确的是
正确答案
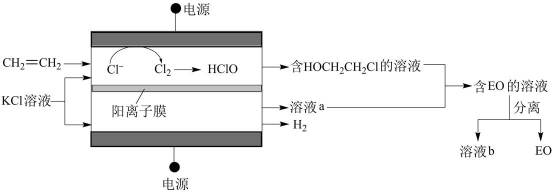
15.(9分)环氧乙烷(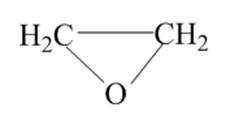
(1)①阳极室产生Cl2后发生的反应有:_______、CH2=CH2+HClO→HOCH2CH2Cl。
②结合电极反应式说明生成溶液a的原理_______。
(2)一定条件下,反应物按一定流速通过该装置。
电解效率η和选择性S的定义:
η(B)=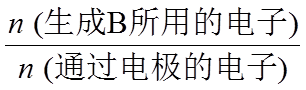
S(B)=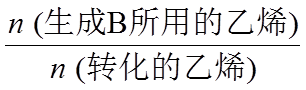
①若η(EO)=100%,则溶液b的溶质为_______。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%。推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是_______。
ii.假设没有生成EO
iii.实验证实推测III成立,所用试剂及现象是_______。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液
正确答案
(1)①
②阴极反应: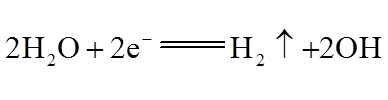
(2)①
②ⅰ.
ⅱ.13
ⅲ.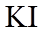
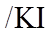
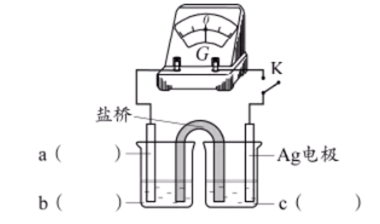
16.(10分)某小组实验验证“Ag++Fe2+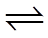
(1)实验验证
实验I.将0.0100 mol·L−1 Ag2SO4溶液与0.0400 mol·L−1 FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II.向少量Ag粉中加入0.0100 mol·L−1Fe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实沉淀为Ag。现象是_______。
②II中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因是_______。
综合上述实验,证实“Ag++Fe2+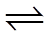
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象_______。
(2)测定平衡常数
实验Ⅲ.一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol·L−1 KSCN标准溶液滴定Ag+,至出现稳定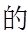
资料:Ag++SCN-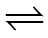
正确答案
(1)①固体溶解,产生红棕色气体 ②酸性条件下,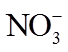
③a:石墨电极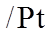
b:酸性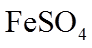
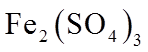
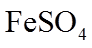
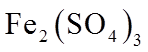
c:
组装好装置后,闭合K,当灵敏电流计指针不动时,向左池加入较浓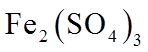

(2)①指示剂
②
(3)①偏低 ②
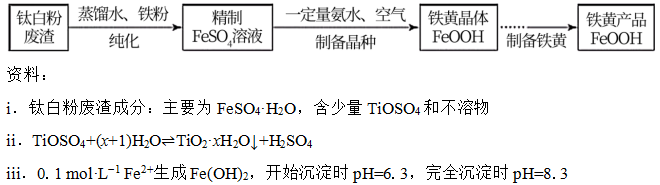
18.(12分)铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
0.1 mol·L−1 Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
①加入过量铁粉的目的是_______。
②充分反应后,分离混合物的方法是_______。
(2)制备晶种
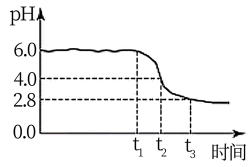
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
①产生白色沉淀的离子方程式是_______。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+)_______0.1 mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:_______。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:_______。
(3)产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
W g铁黄
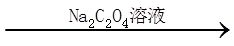
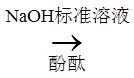
资料:Fe3++3
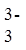
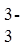
Na2C2O4过量,会使测定结果_______(填“偏大”“偏小”或“不受影响”)
正确答案
(1)①消耗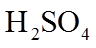
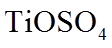
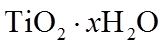
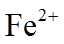
②过滤
(2)①
②>
③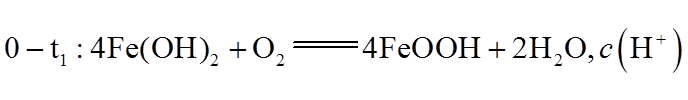
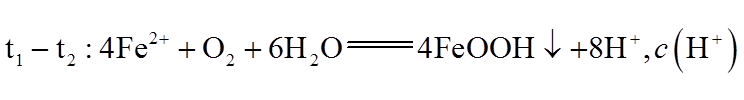
④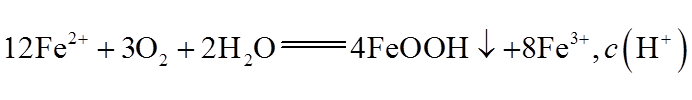
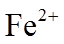
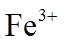
(3)不受影响
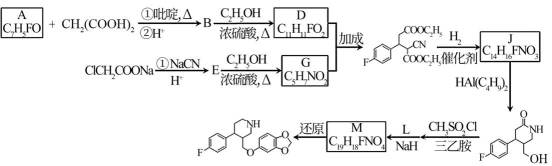
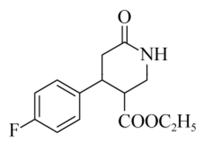
17.(14分)治疗抑郁症的药物帕罗西汀的合成路线如下。
已知:
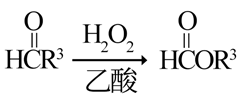
i.R1CHO+CH2(COOH)2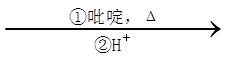
ii.R2OH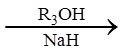
(1)A分子含有的官能团是_______。
(2)已知:B为反式结构。下列有关B的说法正确的是(填序号)_______。
a.核磁共振氢谱有5组峰
b.能使酸性KMnO4溶液褪色
c.存在2个六元环的酯类同分异构体
d.存在含苯环和碳碳三键的羧酸类同分异构体
(3)E→G的化学方程式是_______。
(4)J分子中有3个官能团,包括1个酯基。J的结构简式是_______。
(5)L的分子式为C7H6O3。L的结构简式是_______。
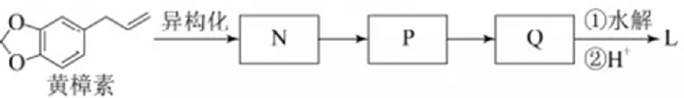
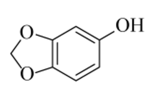
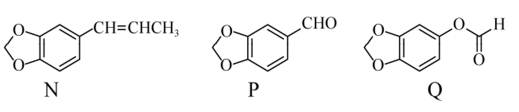
(6)从黄樟素经过其同分异构体N可制备L。
已知:
i.R1CH=CHR2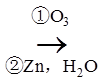
ii.
写出制备L时中间产物N、P、Q的结构简式:_______、_______、_______。
正确答案
(1)醛基、氟原子 (2)a、b、c
(3)
(4)
(5)
(6)
19.(13分)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_______。
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:_______。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,_______。
④补充实验证实了③中的分析。
a是_______,b是_______。
(2)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______,从原子结构角度说明理由______________。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是_______。
(4)Ag分别与1 mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:_______。
(5)总结:物质氧化性和还原性变化的一般规律是_______。
正确答案
(1)①
②
③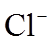
④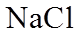
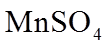
(2)
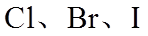
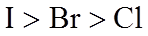
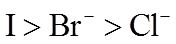
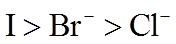
(3)
(4)溶解度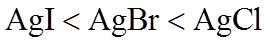
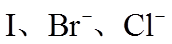
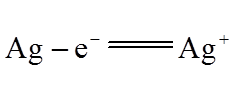
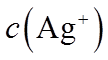
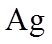
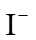
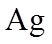
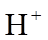
(5)还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强