- 真题试卷
- 模拟试卷
- 预测试卷
1.光纤通信是70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的()
正确答案
解析
石英最重要的用途之一就是做光纤,而硅单质的最重要的用途之一是做硅芯片、太阳能电池等。
考查方向
解题思路
性质与用途记忆准确性的考查。
易错点
易混淆SiO2与Si的用途而错选D。
知识点
6.近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深。Butylated Hydroxy Toluene(简称BHT)是一种常用的食品抗氧化剂,合成方法有如下两种:
下列说法正确的是()
正确答案
解析
A.
B.
C.依据苯酚在空气中易被氧化而变粉红色,推知BHT久置于空气中也会被氧化,故错误;
D.方法一是加成反应,方法二是取代反应,故两种方法的反应类型都是加成反应错误。
考查方向
解题思路
同系物概念、酚类性质、反应类型是入手点。
易错点
往往因为对酚类易在空气中被氧化这一知识点不熟悉拿捏不准确,错选C.
知识点
2.下列实验方案设计中,不可行的是()
正确答案
解析
A. 碘易溶于有机溶剂四氯化碳,故不能分液分离,A不可行。其它均为正确可行的实验方法。
考查方向
解题思路
依据已有的实验知识经验,逐一筛选判断。
易错点
审题出错,选为“可行”。
知识点
3.NA为阿伏加德罗常数,下列说法正确的是()
正确答案
解析
A. 标准状况下,11.2 L的戊烷、液体、物质的量远大于0.5 mol,故所含的分子数
也远大于0.5NA,错误;B.28 g乙烯,是1 mol,从乙烯结构简式H2C=CH2知,每分子含有6个共用电子对,故4NA错误;C.1 mol甲基的电子数目为(7+2)NA,故错误;至此,即筛选出正确选项D——D.乙烯、丙烯、丁烯的分子组成均有相同的最简式CH2,现有混合气体共14 g,求得n(CH2)=1 mol,其所含原子数为3NA。
考查方向
解题思路
充分了解物质的状态及分子组成结构,逐一筛选。
易错点
忘记知识点——4个及以内碳原子数的烃在标准状况下才是气体;或者忽视了碳原子的K层还有2电子,因此会出现错选A或C。
知识点
4.X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子能形成最轻的气体单质;Y原子的最外层电子数是次外层的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是()
正确答案
解析
“X元素的原子能形成最轻的气体单质”推得:X是H;“Y原子的最外层电子数是次外层的2倍”推得:Y是C;“Z、W在元素周期表中处于相邻的位置”且都是原子序数比6C大的非金属,“它们的单质在常温下均为无色气体”推得:Z是N、W是O;“M是地壳中含量最高的金属元素”,故M为Al。
A.五种元素的原子半径从大到小的顺序是:Al>C>N>O>H,故M>W>Z>Y>X错误;
B.X、Z两元素能形成原子个数比(X:Z)为3:1的化合物,即NH3,故正确;
C.化合物YW2、ZW2分别是CO2、NO2,只有CO2是酸性氧化物,故错误;
D.用M单质作阳极,石墨作阴极,电解NaHCO3溶液,电解一段时间后,阳极放电产生的Al3+与定向移动到阳极区的HCO3— 发生双水解,而在阳极区会出现白色沉淀,故错误。
考查方向
解题思路
从“最轻的气体单质”入手,结合“位置——结构——性质”的关系逐层推理。
易错点
选项D,白色沉淀应该是在阳极区。
知识点
5.对于常温下pH均为4的三种溶液:①盐酸,②CH3COOH溶液,③NH4Cl溶液,下列说法中正确的是()
正确答案
解析
A.②CH3COOH抑制水的电离,③NH4Cl促进水的电离,故由水电离出的c(H+):②<③,故错误;
B.稀释100倍后,①是强酸,pH=6、③是水解盐,越稀越水解,4<pH<6,故溶液的pH:①<③错误;
C.pH=4的①盐酸和②CH3COOH,因醋酸只是部分电离,故用NaOH中和时,盐酸消耗的氢氧化钠的量要少于醋酸,即与相同体积的上述溶液中和时消耗NaOH溶液的体积:①<②,正确;
D.②和③等体积混合后的溶液呈酸性,故c(OH-)<c(H+),则由电荷守恒得c(CH3COO-)+c(Cl-)>c(NH4+),选项错误。
考查方向
解题思路
正确把握强弱酸的电离、及盐的水解。
易错点
易错选B。主要是忽视“越稀越水解”。
知识点
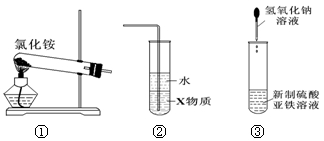
7.关于下列各装置图的叙述中,正确的是()
正确答案
解析
A.实验室用装置①制取氨气,缺少反应物石灰,故错误;
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸,是一种重要的防倒吸装置,正确;
C.装置③制备氢氧化亚铁时,要观察其颜色,必须是用较长的滴管、且伸入到硫酸亚铁液面滴下。故错误;
D.装置④ b口进气,只能收集密度比空气小的气体,故可收集CO2等气体错误。
考查方向
解题思路
依据实验操作的规范(细节)、原理解题。
易错点
对某些实验基本操作细节的忽视或遗忘,就会错选C等。
知识点
损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
8.钠、钾着火,下列可用来灭火的是_____(填字母)。
9.NaCN是属于________(填“离子化合物”或“共价化合物”),NaCN的电子式为:_________。
10.白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 + 10HClO3 + 18H2O = 10HCl + 12H3PO4,该反应的氧化剂是_________,氧化产物是_________,若有1mol P4参加反应转移电子为 _________mol。
11.NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,请写出发生非氧化还原反应的热分解方程式_________。
12.NaCN属于剧毒物质,有多种无害化处理方法,H2O2处理法是其中之一:NaCN + H2O2→N2↑+ X + H2O,推测X的化学式为_________。
正确答案
解析
钠、钾着火,因其又易与水剧烈反应等,故不能用含有水(A.B.)或生成水(C.)的物质灭火,则可用来灭火的只有D。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
离子化合物 ; 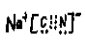
解析
NaCN是属于 “离子化合物”,NaCN的电子式为: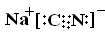
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
HClO3; H3PO4;20。
解析
白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 + 10HClO3 + 18H2O = 10HCl + 12H3PO4,该反应的氧化剂是HClO3(得到电子、化合价降低的反应物),氧化产物是H3PO4(失去电子、化合价升高的产物),若有1mol P4参加反应转移电子为4×5=20 mol。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
NH4NO3 = NH3↑+HNO3
解析
NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
其发生非氧化还原反应的热分解方程式NH4NO3 = NH3↑+HNO3 。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
NaHCO3。
解析
NaCN属于剧毒物质,有多种无害化处理方法,H2O2处理法是其中之一:NaCN + H2O2→N2↑+ X + H2O,依据质量守恒定律及氧化还原反应规律,推测X的化学式为NaHCO3。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
13. 写出甲醚燃烧的热化学方程式________________________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)== 2CH3OCH3(g)的反应热为________________;
14.工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g)
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2 mol H2消耗时,有1 mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)。
15.以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式__________;
16.用(3)中的燃料电池为电源,以石墨为电极电解500 mL NaCl溶液,装置如图所示:
请写出电解过程中Y电极附近观察到的现象是___________;当燃料电池消耗2.8 L O2(标准状况下)时,计算此时:NaCl溶液的pH=________(假设溶液的体积不变,气体全部从溶液中逸出)。
正确答案
CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H= —1455 kJ/mol;△H= —378.8 kJ/mol。
解析
已知甲醚的燃烧热为1455 kJ·mol-1,
故甲醚燃烧的热化学方程式CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H= —1455 kJ/mol;
已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)= 2CH3OCH3(g)的反应热为:
① H2(g)+1/2O2(g)= H2O(l) △H= —285.8 kJ/mol
②C(s)+O2(g)=CO2(g) △H= —393.5 kJ/mol
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H= —1455 kJ/mol
由①×6+②×4—③×2可得:反应4C(s)+ 6H2(g)+ O2(g)= 2CH3OCH3(g)的反应热为:△H= —285.8 kJ/mol×6—393.5 kJ/mol×4—(—1455 kJ/mol)×2= —378.8 kJ/mol。
考查方向
解题思路
依据反应原理解题。
易错点
(2)①平衡标志的判断及题中所涉及的计算等。
正确答案
①a d;②变小。
解析
工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g)
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变 (即浓度保持不变,是判断标志)
b.单位时间内有2 mol H2消耗时,有1 mol H2O生成(均是指正反应,不能作为判断标志)
c.容器中气体密度不再改变(恒容时,容器体积、且反应混合物均气体,即反应前后气体的总质量不变、总体积不变,故密度均不变,不能作为平衡判断标志)
d.容器中气体压强不再改变(恒容时,容器内的压强与分子数成正比,且该反应前后是个气体分子数减少的反应,故压强可以作为平衡判断标志)
②温度升高,因△H<0,故平衡逆向移动,达到新的平衡,CH3OCH3的产率将 “变小”。
考查方向
解题思路
依据反应原理解题。
易错点
(2)①平衡标志的判断及题中所涉及的计算等。
正确答案
CH3OCH3+16OH-—12e-=2CO32-+11H2O。
解析
以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-(特别提示甲醚氧化的产物CO2继续与氢氧化钾溶液反应),则该负极反应式CH3OCH3+16OH-—12e-=2CO32-+11H2O;
考查方向
解题思路
依据反应原理解题。
易错点
(2)①平衡标志的判断及题中所涉及的计算等。
正确答案
Y电极附近溶液中有气体产生,上部分呈黄绿色;14。
解析
用(3)中的燃料电池为电源,以石墨为电极电解500 mL NaCl溶液,装置图略:
电解过程中Y电极(是与电源正极相连的阳极),其反应为:2Cl——2e— = Cl2↑,故在附近观察到的现象是有气泡产生、上部呈黄绿色;当燃料电池消耗2.8 L O2(标准状况下)时,计算依据——电子得失守恒:O2~4e—~4 OH—,n(OH—)=4×2.8 L/22.4 L·mol-1=0.5 mol,c(OH—)=0.5 mol/0.5 L = 1 mol/L,此时:NaCl溶液的pH=—lg1×10-14/1 =14。
考查方向
解题思路
依据反应原理解题。
易错点
(2)①平衡标志的判断及题中所涉及的计算等。
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁,请根据以下药品说明书回答问题:
17.药片上的糖衣可以起_______的作用,鉴定时溶解加盐酸的目的是____________。
18.某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有__________、___________。
②滴定时,含硫酸亚铁的滤液放在___________(填仪器)中,高锰酸钾溶液放在__________(填仪器)中,滴定时加入___________(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点_____________。
19.另一研究小组乙设计了如下测量方案:
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。A过滤 B洗涤 C萃取 D分液 E冷却 F灼烧
正确答案
隔绝空气,防止被O2氧化 ; 防止Fe2+水解。
解析
因为Fe2+易被空气中的氧气氧化,故在Fe2+的药片上披上糖衣以隔绝空气、防止被O2氧化,鉴定时溶解加盐酸的目的是防止Fe2+水解。
考查方向
解题思路
依据亚铁盐等的性质、基本的实验操作解题。
易错点
(2)②中简答用语的规范性等。
正确答案
瓶中,溶液变为紫色,振荡,半分钟内不恢复原色,则滴定达到了终点。
解析
①精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有250 mL的容量瓶、胶头滴管。
②滴定时,含硫酸亚铁的滤液放在锥形瓶(因其易被氧化、不宜与空气长期或过度的接触)中,高锰酸钾溶液放在酸式滴定管中,滴定时加入 “不用加”指示剂(其本身的紫红色就是很好的指示剂);最后一滴酸性高锰酸钾溶液滴入锥形瓶中,溶液变为紫色,振荡,半分钟内不恢复原色,则滴定达到了终点。
考查方向
解题思路
依据亚铁盐等的性质、基本的实验操作解题。
易错点
(2)②中简答用语的规范性等。
正确答案
①2Fe2++2H++H2O2=2Fe3++2H2O。②A B F E。
解析
①检验过程中加过量H2O2(绿色氧化剂)反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作依次是:过滤、洗涤、灼烧、冷却,再称量。
考查方向
解题思路
依据亚铁盐等的性质、基本的实验操作解题。
易错点
(2)②中简答用语的规范性等。
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)
回答下列问题:
20.已知:N2(g)+O2(g)= 2NO(g) △H= +180.5 kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H= -905 kJ/mol
2H2(g)+O2(g)= 2H2(g) △H= — 483.6 kJ/mol
则N2(g)+3H2
21.如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为____________。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
22.合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法:________(填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是___________________________________;
23.可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为______________________________;
24.假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水___________mL(用100 mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH _______14-a(填“大于”“小于”或“等于”)。
正确答案
-92.4 kJ/mol
解析
已知:N2(g)+O2(g)= 2NO(g) △H= +180.5 kJ/mol ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H= -905 kJ/mol ②
2H2(g)+O2(g)= 2H2(g) △H= — 483.6 kJ/mol ③
则[①×2—② + ③×3]/2可得N2(g)+3H2
考查方向
解题思路
依据化学原理(反应热、化学平衡、溶液中的离子平衡)解题。
易错点
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水___________mL(用100 mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH _______14-a(填“大于”“小于”或“等于”)。如不按100 mL的容量瓶计算而错误的用“需用体积80 mL”求解等。
正确答案
0.057;①②
解析
依据 N2(g)+ 3H2 
起始浓度/ kJ·mol—1 1.5 6 0 Σn1 =7.5 mol
变化浓度/ kJ·mol—1 x 3x 2x
平衡浓度/ kJ·mol—1 1.5- x 6-3x 2x Σn2 =(7.5-2x )mol
又有:p1/p2 =Σn1/Σn2,得:1/0.8 =7.5 mol/(7.5-2x )mol,x=0.75
则其平衡常数为:K= c2(NH3)/c(N2)c3(H2) =(2x)2/(1.5- x)( 6-3x)3≈0.0569。
能使平衡向正反应方向进行且平衡常数不变的是:①增大压强、②增大反应物质的浓度。温度改变会改变平衡常数、催化剂不改变平衡移动方向。
考查方向
解题思路
依据化学原理(反应热、化学平衡、溶液中的离子平衡)解题。
易错点
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水___________mL(用100 mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH _______14-a(填“大于”“小于”或“等于”)。如不按100 mL的容量瓶计算而错误的用“需用体积80 mL”求解等。
正确答案
②;通过温度的改变而改变物质的状态,达到分离的目的。
解析
合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法是通过改变物质的聚集状态(使氨液化)而实现分离的,故其原理类似于 ②蒸馏(是把液体变为气体实现分离的)。
考查方向
解题思路
依据化学原理(反应热、化学平衡、溶液中的离子平衡)解题。
易错点
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水___________mL(用100 mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH _______14-a(填“大于”“小于”或“等于”)。如不按100 mL的容量瓶计算而错误的用“需用体积80 mL”求解等。
正确答案
8NH3+3Cl2=N2+6NH4Cl
解析
检验输送氨气的管道是否漏气,是利用氯气的强氧化性和氨气的还原性。
考查方向
解题思路
依据化学原理(反应热、化学平衡、溶液中的离子平衡)解题。
易错点
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水___________mL(用100 mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH _______14-a(填“大于”“小于”或“等于”)。如不按100 mL的容量瓶计算而错误的用“需用体积80 mL”求解等。
正确答案
25 mL;小于。
解析
①依据稀释前后溶质的量不变,得:20 mol·L—1·V(浓氨水)=5 mol·L—1×100 mL,
V(浓氨水)=25 mL。
②盐酸与氨水反应后呈中性的溶液是:NH4Cl和少量NH3·H2O。
假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,设盐酸的pH=b,若a+b=14,则氨水过量较大(氨水是弱电解质),反应混合液会呈碱性(多余的氨水电离为主)。故使氨水略过量,则有a+b<14,b<14-a。
考查方向
解题思路
依据化学原理(反应热、化学平衡、溶液中的离子平衡)解题。
易错点
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水___________mL(用100 mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH _______14-a(填“大于”“小于”或“等于”)。如不按100 mL的容量瓶计算而错误的用“需用体积80 mL”求解等。