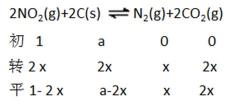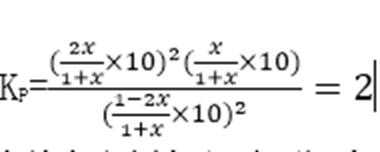- 真题试卷
- 模拟试卷
- 预测试卷
10.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
正确答案
B
解析
先加入稀硝酸,因其具有强氧化性,如果溶液中含有SO32-等也会形成BaSO4白色沉没,A错误。如果溶液中含有NH4+遇碱、加热会产生氨气,使湿润的红色石蕊试纸变红,B正确。两饱和溶液中的A-与 B- 的浓度不一定相同,无法判断水解程度的大小,C错误。蔗糖溶液水解得到的还原性糖与新制Cu(OH)2悬浊液的反应应当在碱性环境下进行,必须加入氢氧化钠中和多余的酸,D错误。
考查方向
解题思路
把握现象与结论之间的因果关系,加强重点实验的学习。
易错点
实验现象与结论之间的因果关系。
知识点
11.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )
正确答案
解析
由图分析可知,通入a电极的为BH4-其中的B失电子化合价降低生成BO2-,因此a为电池的负极。b为电池的正极,H2O2中O由-1价降到-2价发生还原反应,反应式为:H2O2+2e-=2OH-,A正确。原电池工作时,电解质溶液中的阳离子由负极区向正极区移动,B正确。电子由负极流出,正极流入,即a→b,故C错误。正极区产生的氢氧根,可以经处理后输入a极室循环使用,D正确。
考查方向
解题思路
先判断出原电池的正负极,结合两极的材料与电解质环境,再掌握两极的反应书写。
易错点
原电池工作原理
知识点
12.短周期主族元素W、X、Y、Z的原子序数依次增大。W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半。下列叙述正确的是( )
正确答案
解析
由W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半,可推出W(C)、X (Na)、Y(Al)、Z(Si)。金属性Na>Al故A错误。原子半径Al>Si,B正确。氢化物的稳定性是看非金属性的强弱,因非金属性C>Si,所以C错误。Al(OH)3具有两性能与强碱NaOH发生反应,D错误。
考查方向
解题思路
加强元素化合物知识的学习,熟悉元素周期表。
易错点
未能正确处理好结构、位置、性质三者的关系,元素推断出现障碍。
知识点
13.25℃时,向100 mL 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )
正确答案
解析
a点时溶液中存在:NH4HSO4=NH4+ +H+ +SO42- 与NH4+ +H2O 


考查方向
解题思路
把握电离与水解的关系,影响溶液导电性的因素,掌握三大守恒的运用。
易错点
电荷守恒运用不当
知识点
7.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
正确答案
解析
从文字叙述可以看出是从浓酒中分离出乙醇,是利用酒精与水的沸点不同,用蒸馏的方法将其分离提纯,因此答案选择C。
考查方向
解题思路
把握关键的信息,排除干扰。
易错点
借用古籍记载,学生阅读时不理解其中的意义。
知识点
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
正确答案
解析
30g乙烷的物质量为1mol,利用C与H的最外层电子数计数共价键数目,所含有的共价键数目为N=
考查方向
解题思路
逐项分析,把握要点,分清标况下物质的状态。
易错点
审题不清,极性键数目计算
知识点
9.EDTA是一种重要的络合剂。4 mol 一氯乙酸和1 mol乙二胺(
正确答案
解析
一氯乙酸的分子式为C2H3ClO2,乙二胺分子为C2H8N2,根据题目信息利用原子守恒,列式4

考查方向
解题思路
利用反应中原子守恒进行分子式的推断。
易错点
分子式书写
知识点
不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、
NO3-、F-和+6价铬的含氧酸根离子等。下图是综合利用该酸洗废液的工艺流程:
已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3 
19.再生酸中含有 ,采取减压蒸馏的原因是 。
20.利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是 。
21.请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式: 。
22.已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为: 。
23.滤渣3的主要成分为CaF2、Ca(OH)2和 。
24.经检测,最后的残液中c(Ca2+)=0.004 mol•L-1,则残液中F-浓度为 mg•L-1,
(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11 mol3•L-3,国家排放标准要求氟离子浓度小于10 mg•L-1]。
正确答案
硝酸、氢氟酸;降低蒸馏的温度以减少硝酸的分解。
解析
因溶液中有F-与NO3-遇H+会生成易挥发性的HF与HNO3,减压蒸馏后能得到它们的混合物。因为HNO3受热易分解,采用减压蒸馏可以降低沸点,减少硝酸的分解。
考查方向
解题思路
排除干扰,把握有效的信息进行合理的推断。
易错点
离子方程式的书写、溶度积的计算
正确答案
实现废物利用,降低生产成本。
解析
利用废氧化铁可以降低H+的浓度,调节溶液的PH,又能降低成本提高经济效率。
考查方向
解题思路
排除干扰,把握有效的信息进行合理的推断。
易错点
离子方程式的书写、溶度积的计算
正确答案
Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O
解析
Cr2O72-有强氧化性,HSO3-有还原性,二者之间发生氧化还原反应,Cr化合价由+6价降到+3价,S由+4价升高到+6价,反应为Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O
考查方向
解题思路
排除干扰,把握有效的信息进行合理的推断。
易错点
离子方程式的书写、溶度积的计算
正确答案
[Ni(NH3)6]2++S2-=NiS↓+6NH3
解析
沉镍之后溶液中还含有F-、SO42-加入Ca(OH)2后生成CaF2与CaSO4。
考查方向
解题思路
排除干扰,把握有效的信息进行合理的推断。
易错点
离子方程式的书写、溶度积的计算
正确答案
CaSO4。
解析
沉镍反应是利用S2-夺取[Ni(NH3)6]2+中的Ni2+形成沉淀反应方程为:[Ni(NH3)6]2++S2-=NiS↓+6NH3
考查方向
解题思路
排除干扰,把握有效的信息进行合理的推断。
易错点
离子方程式的书写、溶度积的计算
正确答案
1.9
解析
c(Ca2+) c2(F-)= Ksp(CaF2),求得c(F-)=1

考查方向
解题思路
排除干扰,把握有效的信息进行合理的推断。
易错点
离子方程式的书写、溶度积的计算
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2
14.装置的合理连接顺序为A、 、D,其中E装置U形管左边设计为粗导管的目的是 。
15.A装置中发生反应的化学方程式为 。
16.反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为 。
17.待B中充分反应后,停止加热后,还需持续通氧气至 。
18.设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱: 。
②测定装置B的残留固体中铁元素的质量分数: 。
正确答案
CBEC防止FeCl3冷凝在导管中,堵塞导管(1分,答到“防堵塞”即可得分)。
解析
由题干部分得知,本实验是先制得氧气,再与FeCl2反应制得FeCl3,但由于氯化铁有很强的吸湿性,遇水会水解,故在制氯化铁装置的前后都要加上干燥装置。正确的连接顺序为C→B→E→C,由A生成氧气经干燥,再与氯化亚铁反应,用E装置收集氯化铁,D装置是用于尾气处理,为防生成的氯化铁水解,在D前也加干燥装置。为防止氯化铁凝聚阻塞导管,所以用较粗的玻璃导管。
考查方向
解题思路
充分把握好题干信息,由氯化铁易水解联想到要前后加干燥装置。再就是对陌生的反应方程式的书写要充分把握已知信息。
易错点
不能根据信息进行反应的合理推断。
正确答案
2Na2O2 +2 H2O = 4NaOH + O2↑
解析
A中利用过氧化钠与水反应制氧气:2Na2O2 +2 H2O = 4NaOH + O2↑
考查方向
解题思路
充分把握好题干信息,由氯化铁易水解联想到要前后加干燥装置。再就是对陌生的反应方程式的书写要充分把握已知信息。
易错点
不能根据信息进行反应的合理推断。
正确答案
4FeCl2 +3O2 2Fe2O3 +4Cl2
解析
由信息可知,黄绿色气体为氯气,红棕色固体为氧化铁:4FeCl2 +3O2 2Fe2O3 +4Cl2
考查方向
解题思路
充分把握好题干信息,由氯化铁易水解联想到要前后加干燥装置。再就是对陌生的反应方程式的书写要充分把握已知信息。
易错点
不能根据信息进行反应的合理推断。
正确答案
硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失。
解析
为使生成的氯气能被完全吸收,待B中充分反应后,还需继续通氧气至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失。
考查方向
解题思路
充分把握好题干信息,由氯化铁易水解联想到要前后加干燥装置。再就是对陌生的反应方程式的书写要充分把握已知信息。
易错点
不能根据信息进行反应的合理推断。
正确答案
①取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,即证
②称取一定质量B中的残留固体,加入足量的盐酸(或硫酸等)溶解,加足量的H2O2氧化后(不答也可)再加入足量氢氧化钠溶液得沉淀,过滤、洗涤、在空气中充分灼烧至恒重称量,计算。
解析
①取少量氯化铁固体溶于水,再用PH试纸测溶液的酸碱性,如果显酸性则证明Fe3+发生水解:Fe3++3H2O
考查方向
解题思路
充分把握好题干信息,由氯化铁易水解联想到要前后加干燥装置。再就是对陌生的反应方程式的书写要充分把握已知信息。
易错点
不能根据信息进行反应的合理推断。
氮的化合物在生产生活中广泛存在。
25.①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
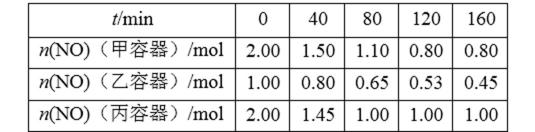
26.用焦炭还原NO的反应为:2NO(g)+C(s)
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
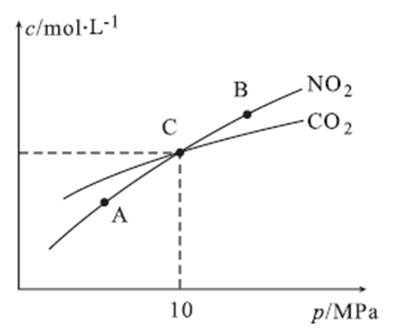
27.用焦炭还原NO2的反应为:2NO2(g)+2C(s)
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
正确答案
① ;+11.3 kJ•mol-1②NH2Cl+H2O NH3+HClO
解析
①氯胺为共价化合物电子式为: 。反应热=反应物的总键能-生成物的总键能:
即ΔH=[391.3×3+243-(391.3×2+191.2)-431.8]KJ.mol^(-1)=11.3 KJ.mol^(-1)
②由信息可知NH2Cl与水反应生成强氧化性的物质为HClO,反应式为NH2Cl+H2O NH3+HClO
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①放热;②0.003 mol•L-1•min-1。
解析
对比图表数据中的甲与丙,在起始物相同时,丙建立平衡的时间短,由此说明,丙的反应温度更高,反应速度更快。再对比建立平衡后甲容器中NO的量更低,说明低温更有利于NO的转化,因此该反应为放热反应。
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①=(1分) ②A
③2 MPa
解析
①A、B两点温度相同,所以Kc(A)=Kc(B)
②因为2NO2(g)+2C(s)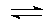
③在C点c(NO2)=c(CO2)即1-2x=2x,可计数出x=0.25mol,
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
回答下列问题:
28.A的名称是 ;已知C是反式产物,则C的结构简式为 。
29.⑥的反应类型是 ,⑧的反应类型是 。
30.F含有的官能团的名称是 。
31.反应⑤的化学方程式为 。
32.肉桂酸(
33.参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯
(
正确答案
乙炔
解析
由A的分子为C2H2,所以A为乙炔。B的结构简式为:

考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
加成反应;氧化反应。
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
碳碳双键;羟基
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
7种;CH3CH2OCH2CH3
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。