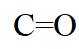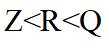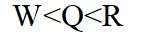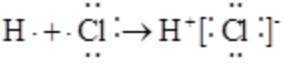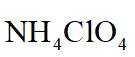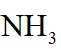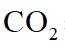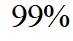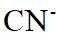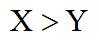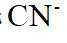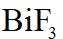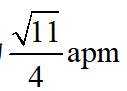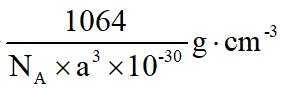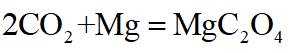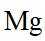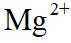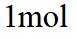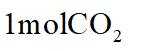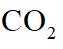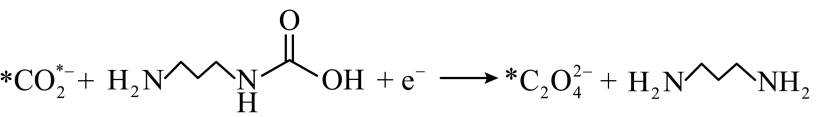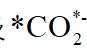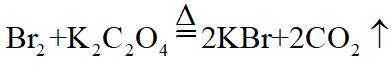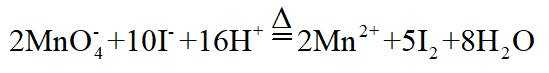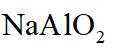- 真题试卷
- 模拟试卷
- 预测试卷
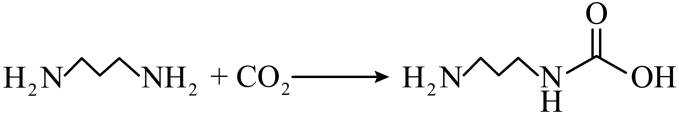
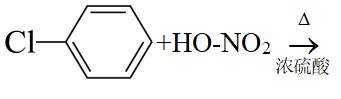
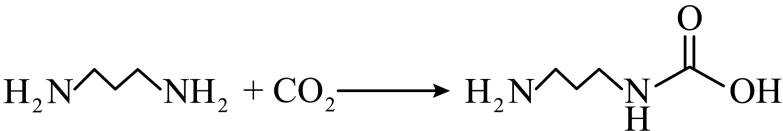
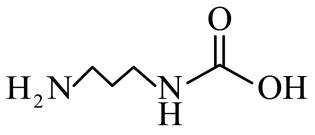
侯氏制碱法工艺流程中的主反应为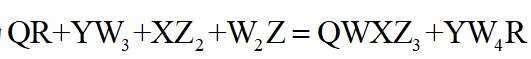
正确答案
解析
侯氏制碱法主反应的化学方程式为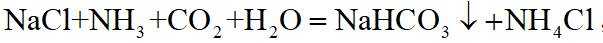
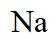
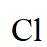
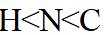
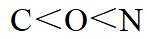
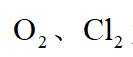
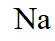
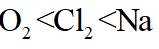
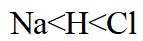
故选C。
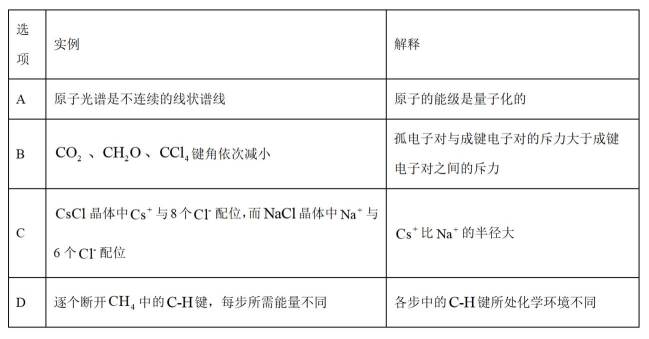
从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是
正确答案
解析
A.原子光谱是不连续的线状谱线,说明原子的能级是不连续的,即原子能级是量子化的,故A正确;B.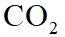
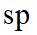
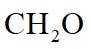
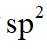
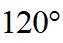

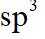
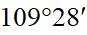
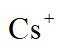
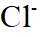

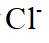
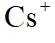
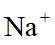
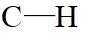
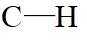
故选B。
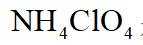
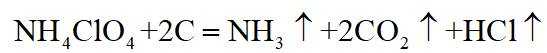
正确答案
解析
【详解】A.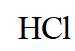
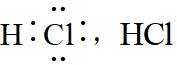

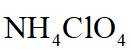

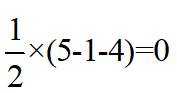
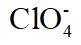
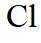
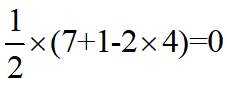
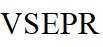
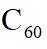
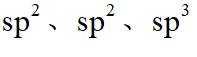
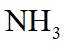
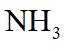
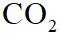
故选B。
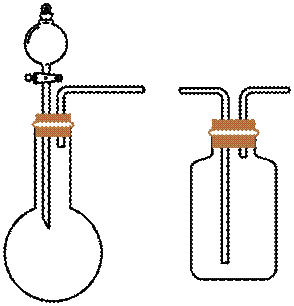
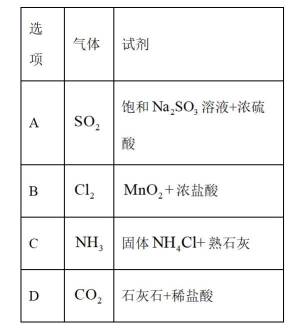
图示装置不能完成相应气体的发生和收集实验的是(加热、除杂和尾气处理装置任选)
正确答案
解析
如图所示的气体发生装置可以为固液加热型反应,也可以是固液不加热型;右侧气体收集装置,长进短出为向上排空气法,短进长出为向下排空气法,装满水后短进长出为排水法;
A.饱和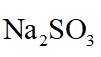
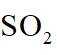
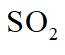
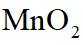
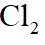
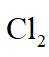
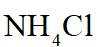
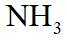
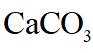
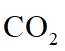
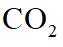
本题选C。
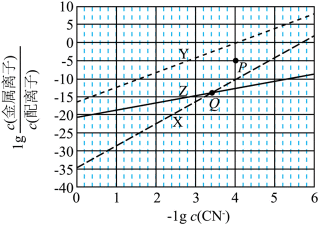
在水溶液中,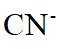


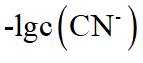
下列说法正确的是
正确答案
解析
A.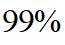
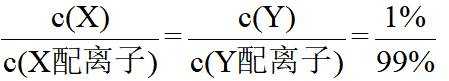
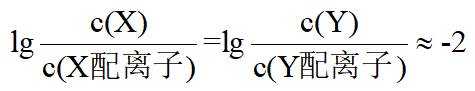
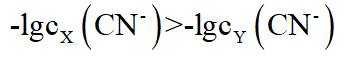
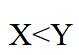
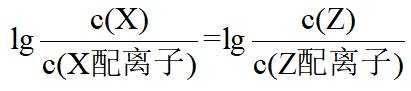
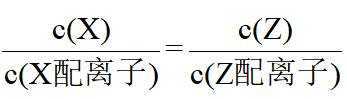
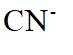
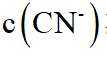
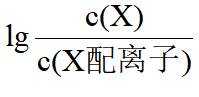

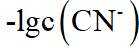
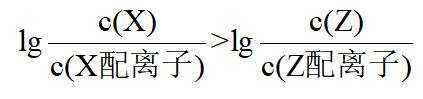
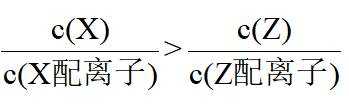
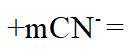

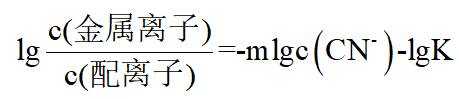
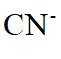
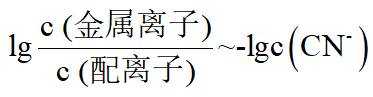
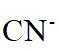
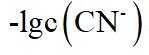
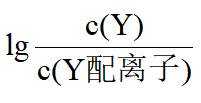
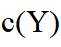
本题选B。
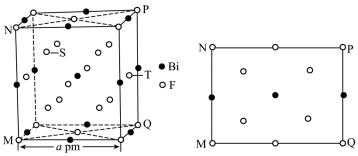
金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中MNPQ点的截面图,晶胞的边长为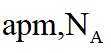
正确答案
解析
A.根据题给晶胞结构,由均摊法可知,每个晶胞中含有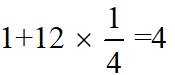
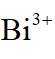
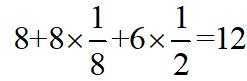
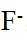
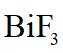
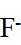
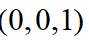
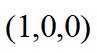
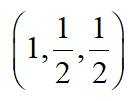
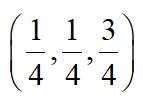
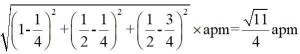
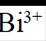
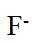
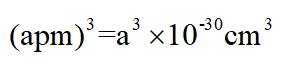
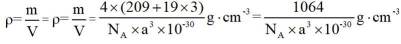
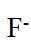
故答案为:D。
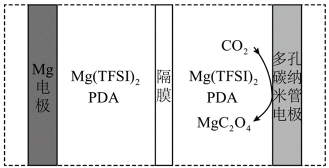
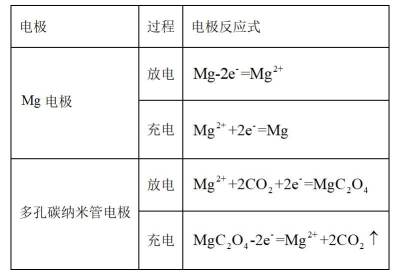
我国科技工作者设计了如图所示的可充电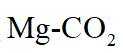

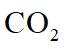
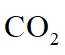
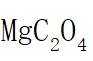
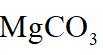
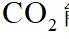
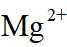
回答下列问题。
下列说法错误的是
正确答案
解析
放电时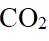
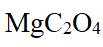
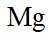
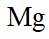
定位:二次电池,放电时阳离子向正极移动,充电时阳离子向阴极移动。
A.根据以上分析,放电时正极反应式为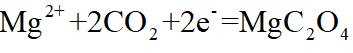
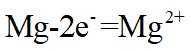
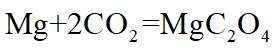
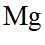
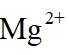
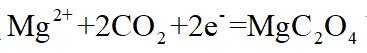
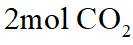
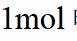
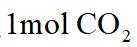
故选C。
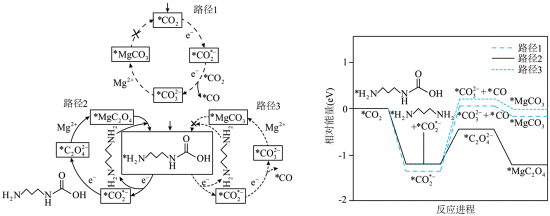
对上述电池放电时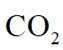
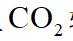
下列说法错误的是
正确答案
解析
A.根据题给反应路径图可知,
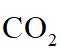
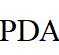
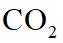

因此速控步骤反应式为
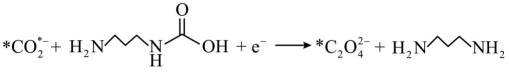
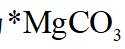
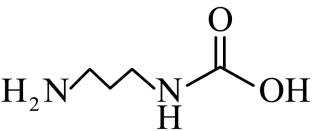
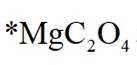
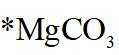
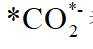
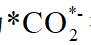
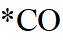
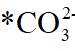
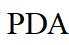
故选D。
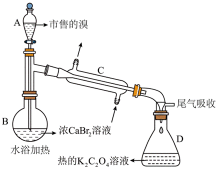
市售的溴(纯度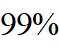
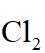
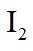
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓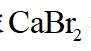

(2)将D中溶液转移至_______(填仪器名称)中,边加热边向其中滴加酸化的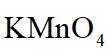
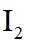
(3)利用图示相同装置,将R和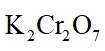
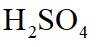
(4)为保证溴的纯度,步骤(3)中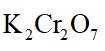
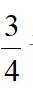
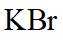
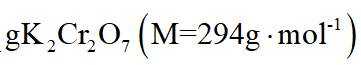
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用_______,滤液沿烧杯壁流下。
正确答案
(1)①. 直形冷凝管 ②. 除去市售的溴中少量的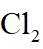
(2)①. 蒸发皿 ②.
(3)①. 液封 ②. 降低温度
(4)
(5)玻璃棒引流,玻璃棒下端靠在三层滤纸处
解析
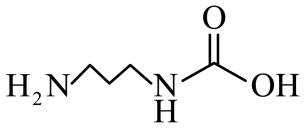
市售的溴(纯度99%)中含有少量的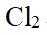
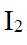
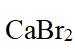

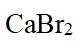
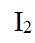
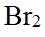
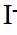
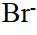
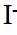
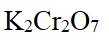
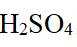
(1)仪器C为直形冷凝管,用于冷凝蒸气;市售的溴中含有少量的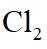
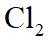
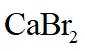
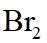
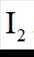

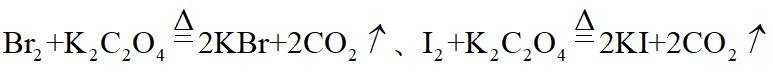
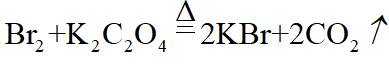
(2)将D中溶液转移至蒸发皿中,边加热边向其中滴加酸化的
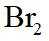
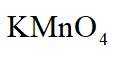
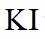
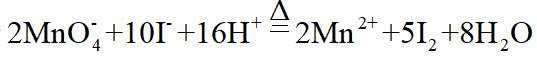
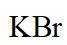
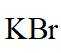
(3)密度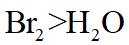
(4)m克KBr固体的物质的量为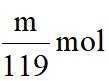
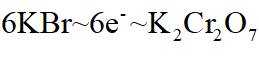
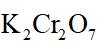
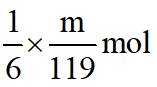
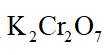
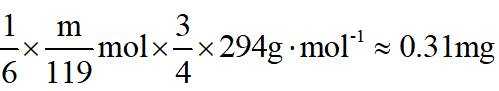
(5)趁热过滤的具体操作:漏斗下端管口紧靠烧杯内壁,转移溶液时用玻璃棒引流,玻璃棒下端靠在三层滤纸处,滤液沿烧杯壁流下。
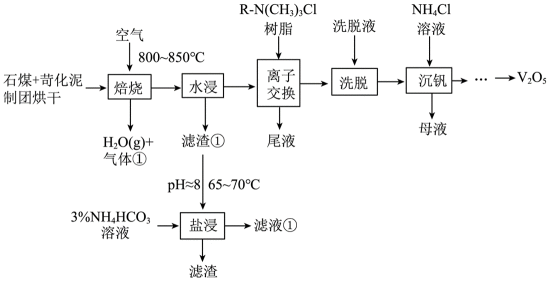
已知:i石煤是一种含
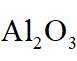
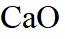
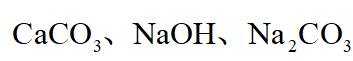
ⅱ高温下,苛化泥的主要成分可与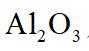
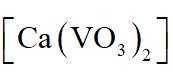
(1)钒原子的价层电子排布式为_______;焙烧生成的偏钒酸盐中钒的化合价为_______,产生的气体①为_______(填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______(填化学式)。
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______;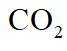
(4)洗脱工序中洗脱液的主要成分为_______(填化学式)。
(5)下列不利于沉钒过程的两种操作为_______(填序号)。
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低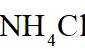
正确答案
(1)①. 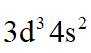
(2)
(3) ①. 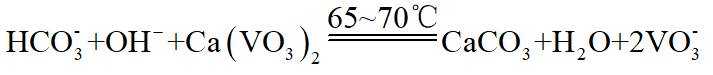
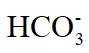
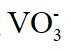
(4)
(5)bd
解析
石煤和苛化泥通入空气进行焙烧,反应生成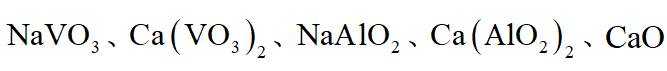
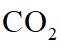
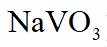
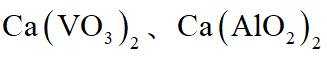

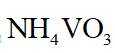
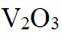
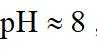
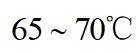
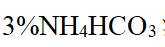
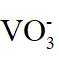
(1)钒是23号元素,其价层电子排布式为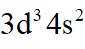
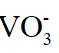
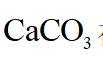
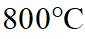
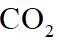
(2)由已知信息可知,高温下,苛化泥的主要成分与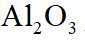
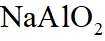
(3)在弱碱性环境下,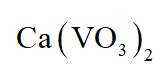
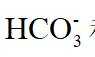
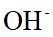


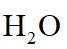
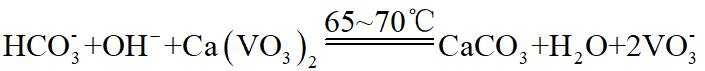
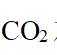
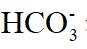
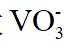
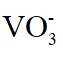
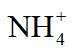
(4)由离子交换工序中树脂的组成可知,洗脱液中应含有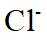
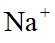
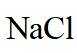
(5)a.延长沉钒时间,能使反应更加完全,有利于沉钒,a不符合题意;
b.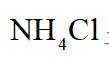
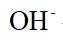

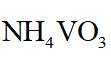
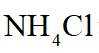
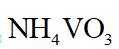
故选bd。
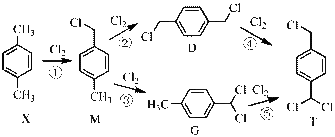
氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下: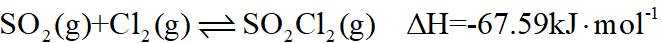
①若正反应的活化能为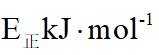

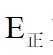
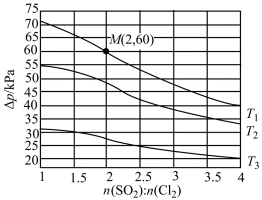
②恒容密闭容器中按不同进料比充入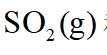
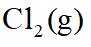
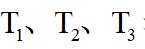
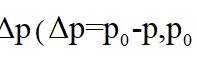
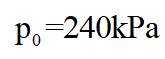
上图中温度由高到低的顺序为_______,判断依据为_______。M点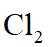
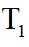

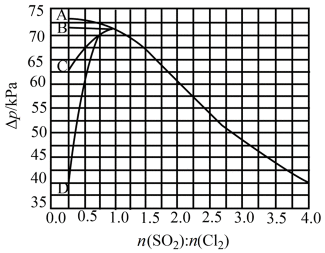
③下图曲线中能准确表示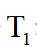

(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为
以上各反应的速率方程均可表示为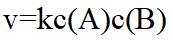
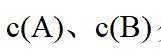
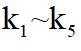
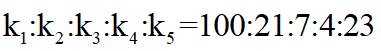
①
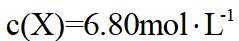
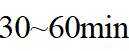
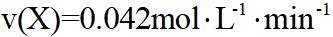

②

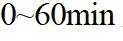
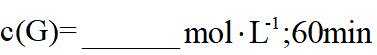
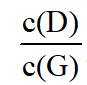
正确答案
(1) ①. 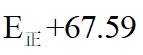
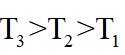
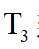
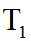
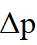
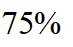
(2) ①. 5.54 ②. 0.033 ③. 增大
解析
(1)①根据反应热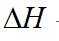
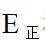
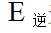
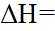
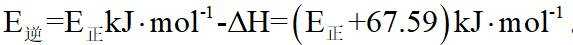
②该反应的正反应为气体体积减小的反应,因此反应正向进行程度越大,平衡时容器内压强越小,
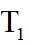
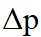
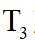
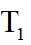
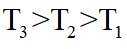
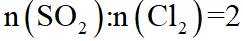
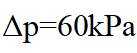
可计算得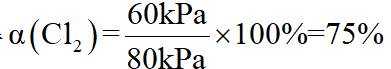
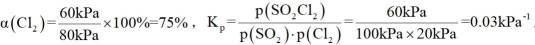
③由题图甲中M点可知,进料比为2时,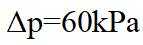
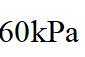
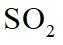
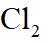
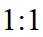
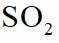
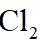
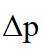
(2)①根据化学反应速率的计算公式时,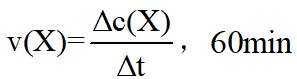
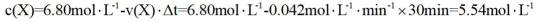
②已知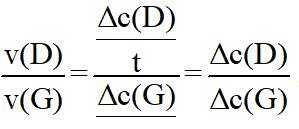
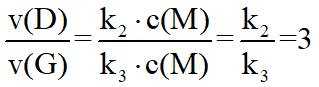
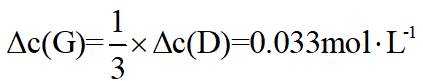
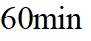
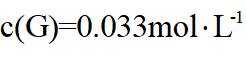
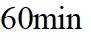
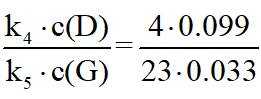
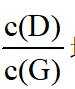
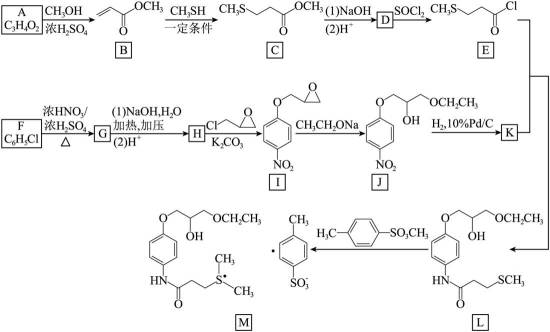
甲磺司特(M)是一种在临床上治疗支气管哮喘、特应性皮炎和过敏性鼻炎等疾病的药物。M的一种合成路线如下(部分试剂和条件省略)。
回答下列问题:
(1)A的化学名称为_______。
(2)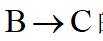
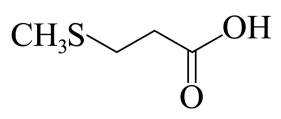
(3)D的结构简式为_______。
(4)由F生成G的化学方程式为_______。
(5)G和H相比,H的熔、沸点更高,原因为_______。
(6)K与E反应生成L,新构筑官能团的名称为_______。
(7)同时满足下列条件的I的同分异构体共有_______种。
(a)核磁共振氢谱显示为4组峰,且峰面积比为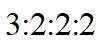
(b)红外光谱中存在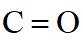
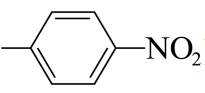
其中,可以通过水解反应得到化合物H的同分异构体的结构简式为_______。
正确答案
(1)丙烯酸 (2)加成反应
(3)
(5)H分子中存在羟基,能形成分子间氢键
(6)酰胺基 (7) ①. 6 ②.
解析
由流程图可知,A与甲醇发生酯化反应生成B,则A的结构简式为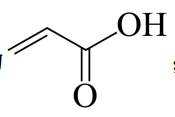
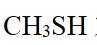
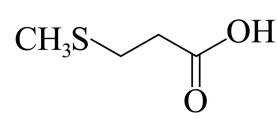
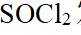
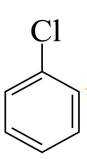
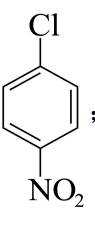
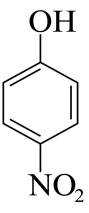
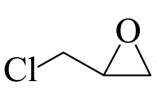
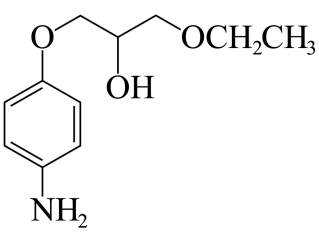
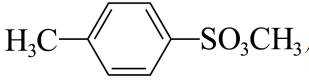
(1)由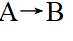
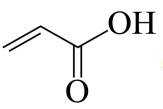
(2)B与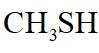

(3)结合C和E的结构简式以及C→D和D→E的反应条件,可知C→D为C先在碱性条件下发生水解反应后酸化,D为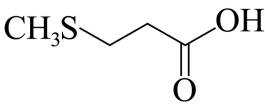
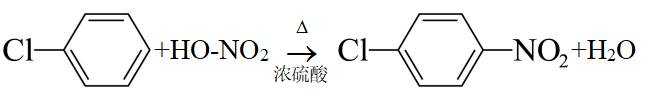
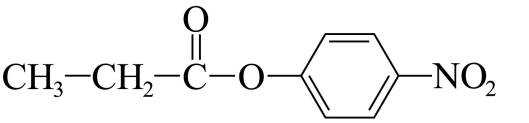
(4)F→G的反应中,结合I的结构可知,苯环上碳氯键的对位引入硝基,浓硫酸作催化剂和吸水剂,吸收反应产物中的水,硝化反应的条件为加热,反应的化学方程式是: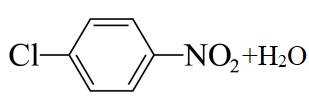
(5)由分析可知,G的结构简式为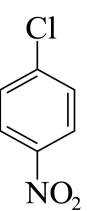
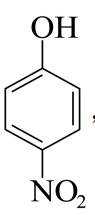
(6)根据分析可知,K与E反应生成L为取代反应,反应中新构筑的官能团为酰胺基。
(7)I的分子式为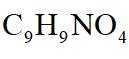
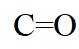
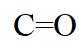
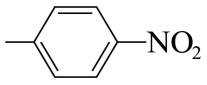
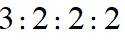
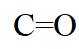
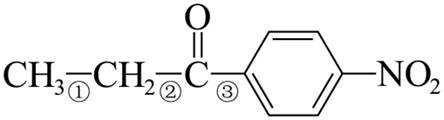
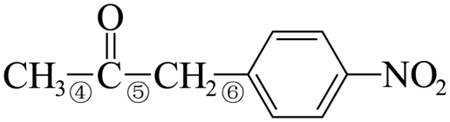
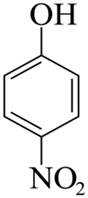
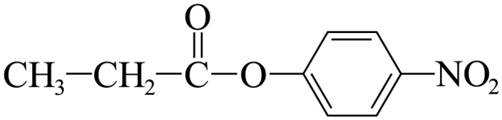
【点睛】第(7)问在确定同分异构体数量时也可以采用排列法,首先确定分子整体没有支链,且甲基和硝基苯基位于分子链的两端,之后可以确定中间的基团有亚甲基、